
Mariagiovanna Di Chiano, et al., |
要約 |
| 神経変性疾患は認知障害や身体障害の主な原因であり、世界中で何百万人もの人々に影響を与えており、その発症率は上昇傾向にあります。新たな証拠は、腸-脳軸のコミュニケーション障害、特に腸内微生物のディスバイオシス(dysbiosis:腸内毒素症、腸内細菌叢の乱れ)がこれらの疾患の発症の一因であることを明らかにしています。実際、ディスバイオシスは神経炎症プロセス、神経免疫系の過剰活性化、認知機能障害、老化、うつ病、睡眠障害、不安と関連しています。メタゲノミクス、メタボロミクス、ビッグデータ分析の急速な進歩と学際的アプローチにより、トランスレーショナル神経変性疾患の分野に新たな地平が開かれました。実際、神経変性疾患の発症における分類学的プロファイリングとリーキーガットに焦点を当てた最近の研究は、見過ごされてきた分野に光を当てているだけでなく、これらの疾患を治療するためのバイオマーカーの発見や新しい治療および補助戦略の開発の機会も生み出しています。 Lactiplantibacillus plantarum (LBP) 株は、これらの疾患の治療のための有望な精神バイオティクスとして浮上しています。実際、Lactiplantibacillus plantarum株は、ユービオシス(訳者注:eubiosisとは、消化管内の微生物生態系のバランスの取れた状態を表す用語です)を促進し、短鎖脂肪酸などの有益な代謝物を産生する細菌の濃縮を高め、神経伝達物質の産生を促進し、腸脳系の恒常性をサポートします。このレビューでは、神経変性疾患の発症における腸内細菌叢の役割に関する現在の知識を要約し、特にアルツハイマー病、パーキンソン病、筋萎縮性側索硬化症、自閉症、不安症、うつ病におけるLactiplantibacillus plantarum株の利点に焦点を当てています。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 健康と神経変性における腸-細菌叢-脳軸 |
| 3. 乳酸菌、Lactiplantibacillus plantarum、および神経変性疾患 |
| 4. アルツハイマー病、認知障害、老化 |
| 5. パーキンソン病 |
| 6. 多発性硬化症 |
| 7. 筋萎縮性側索硬化症 |
| 8. 自閉症スペクトラム障害 |
| 9. 不安とうつ病 |
| 10. 結論、限界、および将来の展望 |
| 本文 |
| 1.はじめに |
| 神経変性疾患は、老化に伴って生じることが多い深刻な世界的な負担です。2019年には、アルツハイマー病(AD)とパーキンソン病(PD)を中心に、約3億5000万件の神経疾患症例と、それに関連する1000万人を超える死亡が報告されました[1]。老化は生理学的プロセスですが、その影響により認知機能の低下や酸化ストレスが促進される可能性があります。従来、神経学と微生物学の関係は、プリオン感染症、肝性脳症、敗血症、中枢神経系(CNS)のウイルスまたは細菌感染症に起因すると考えられてきました。血液-脳関門(BBB)は、分子が脳に選択的に侵入するのを制御し[2]、有害な誘因の侵入から中枢神経系を保護します。脳卒中や神経変性疾患は、血液-脳関門の破壊と関連しています[3]。その結果、病原体が血液-脳関門を通過して、髄膜炎、脳炎、局所膿瘍などの神経炎症を引き起こす感染症を引き起こし、衰弱効果を引き起こし、場合によっては死に至ることもあります[3]。過去20年間の研究の進歩により、消化管(GI)系に常在する微生物叢が、腸と中枢神経系の間のコミュニケーションの調節に大きな役割を果たしていることが明らかになりました。実際、腸の恒常性が乱れると、消化管の機能が損なわれるだけでなく、脳にも大きな影響が及ぶ可能性があります。 |
| 消化管の生理活動は、食物摂取から栄養素の消化・吸収、代謝活動まで多岐にわたります。栄養と神経に依存する調節機構により、栄養素の吸収を担う小腸粘膜への栄養素の最大限の曝露が確保されます [4]。腸粘膜は宿主と外部環境の境界面を表し、さまざまな抗原にさらされています。そのため、腸は潜在的な有害誘因に対する第一線の防御としても機能し、宿主の重要な自然免疫系および獲得免疫系構成要素の形成と訓練において重要な役割を果たします。免疫細胞と抗体の約 70% は、腸のパイエル板を通過するか、パイエル板で成熟します。 |
| 腸内細菌叢(GM)は、細菌、ウイルス、原生動物、酵母など40兆個以上の微生物で構成されています[5]。細菌ドメインは最も豊富で多様であるため、最も多く存在します[6]。現在までに9つの異なる細菌門が特定されています。これらのうち、Firmicutes(フィルミクテス門)とBacteroidetes(バクテロイデス門)が最も豊富で、Actinobacteria(放線菌)とProteobacteria(プロテオバクテリア)がそれに続きます[7,8]。腸内細菌叢は私たちの生命と健康に不可欠であり、その構成は人間の生涯にわたって動的に変化します。赤ちゃんが生まれた瞬間から、幼少期、成人期、老年期まで、時間の経過とともに変化します[9]。生後1年間、Bifidobacteria (ビフィズス菌)は母乳オリゴ糖の代謝を活性化し、A型免疫グロブリンの産生の増加や腸粘膜バリアの強化などの潜在的に有益な効果をもたらします[10]。その後、食物の摂取初期から成人期にかけて、腸内細菌叢の構成は変化し続けます[11]。 |
| 生理学的条件下では、腸内微生物の構成はいわゆるユーバイオシス状態にあり、有益な潜在能力を持つ種が優勢です。対照的に、ディスバイオシスはこのバランスの崩壊を表します。腸内細菌叢シフトは、栄養選択、ライフスタイル、薬物使用、およびさまざまな環境要因への曝露によって影響を受けます[12]。ディスバイオシスの最も古典的な原因は、抗生物質治療または腸内感染症であり[13,14]、主に腸内細菌叢組成シフトを引き起こし、有益な種の減少を伴う細菌の多様性の喪失と、病原体にとってより好ましいニッチの確立をもたらし、次に腸内バリアの完全性を破壊し、炎症を引き起こします[13]。さらに、ディスバイオシスでは、免疫調節機能が損なわれる可能性があります[13]。腸と体の他の部分は密接につながっているため、ディスバイオシスの影響は腸自体だけでなく、離れた臓器にも見られます。過去20年間で、次世代シーケンシング技術、全ゲノムショットガンシーケンシング、グローバルメタボロミクス、高度な計算戦略、ヒト化動物モデル、培養ベースのヒトオルガノイドシステムの発達により、腸内細菌叢とその腸内だけでなく他のシステムとの相互作用における機能についての理解が初めて深まりました[15]。 |
| 腸内細菌は、何千もの微生物酵素をコードする遺伝子で構成されており、無数の代謝産物 [16,17] を生成し、消化・吸収過程の調節からエネルギー採取 [17]、代謝 [17]、さらには免疫系や神経系の活性化 [16,17] に至るまで、基本的な役割を果たしています。実際、微生物由来の代謝産物は、それらが摂取する基質や栄養素に応じて生成され、さまざまな臓器に到達してその機能を調節することができます。繊維発酵によって生成される最も重要な微生物代謝産物のセットの 1 つは、短鎖脂肪酸 (SCFA)、すなわち酪酸、酢酸、プロピオン酸です。他の機能の中でも、酪酸は結腸細胞の基本的なエネルギー源となります [18]。酢酸は、中枢食欲調節、腸内満腹ホルモン、脂質代謝とエネルギー消費の改善に影響を与えるさまざまなメカニズムを通じて、体重維持の調節に関与しています [18]。プロピオン酸は脂質とグルコースの代謝に関与している[19]。これらはすべて、腸管上皮を超えて健康に影響を及ぼすと考えられており、腸-肝軸や腸-脳軸など、腸-他の臓器軸の相互コミュニケーションにおいて主要な役割を果たしている。さらに、細菌はビタミン、トリプトファン、ポリフェノールの代謝産物を生成することができる[20,21]。 |
| 2. 健康と神経変性における腸-細菌叢-脳軸 |
| これらすべての理由から、腸内細菌叢は宿主内の複数の相互作用の交差点に位置しており、腸-脳軸は、腸から脳への微生物とその副産物の通過と、腸を支配する副交感神経系 [22,23] を介した双方向のコミュニケーションを特徴とする動的システムであり、腸と脳の感情および認知中枢を結び付けています。血液-脳関門はこのコミュニケーション ネットワークの基本的な部分です。血液-脳関門生理機能の障害は、アルツハイマー病、パーキンソン病、多発性硬化症 (MS)、脳血管疾患などの神経変性疾患に対する感受性を高める可能性があります [24]。血液-脳関門は不浸透性であると考えられていますが、神経伝達物質、免疫担当細胞、および特定の細菌代謝物の通過を許可します。脳内では、腸内細菌叢代謝物は神経保護系の活性化に関与し、セロトニン、ドーパミン、抗酸化酵素、細胞カルシウム恒常性の調節タンパク質の産生を促進することに寄与している[25]。 |
| 最近の研究では、腸内細菌叢または腸管上皮細胞が微生物叢によって刺激されて直接分泌し、中枢神経系(CNS)を標的とした直接作用を発揮する、いわゆる「神経代謝物」が特定されています。神経伝達物質を含むこれらの分子は、直接的または間接的に中枢神経系に影響を及ぼし、多数のシグナル伝達経路の活性化を引き起こします[22,23]。Bifidobacteria, Lactobacillus, Streptococcus, および Enterococcus spp. はセロトニンを産生します[26]。実際、セロトニンの最大95%は、腸内微生物依存性のトリプトファン代謝によって産生されます[27]。セロトニンは脳機能の調整を助け、心臓機能、腸の運動性、射精潜時、膀胱制御、血小板凝集に影響を及ぼします。Lactobacillus および Bifidobacteriaは、哺乳類の中枢神経系におけるシナプス後レベルで神経インパルスの抑制効果を示すガンマアミノ酪酸(GABA)を分泌することができる[28,29,30,31]。Bifidobacterium dentium, Bifidobacterium longum subsp. Infantis [30,32], およびBifidobacterium adolescents [33]は、生体内でガンマアミノ酪酸を産生することが示されており、最近「サイコバイオティクス」という名前で呼ばれている。つまり、神経信号を調節することで、睡眠、食欲、気分、認知などの神経活動に影響を与えることができる[29]。さらに、Lactiplantibacillus plantarum PS128は、マウスの脳内で非定型行動を改善し、ドーパミン作動性およびセロトニン作動性シグナル伝達経路の両方の調節を決定することが観察されている。特に、無菌マウスモデル[34]と幼少期にストレスを受けた未経験の成体マウス[35]の研究では、Lactiplantibacillus plantarum PS128の投与により感情の変化が誘発され、その結果モノアミン神経伝達物質のレベルの上昇に関連する行動の変化が起こることが示されています。 |
| 中枢神経系では、短鎖脂肪酸は血液-脳関門の完全性を維持するだけでなく、行動、記憶、シナプス可塑性、学習、その他の神経機能にも総合的に影響を及ぼします。実際、無菌マウスでは腸と血液-脳関門の透過性が高まり、短鎖脂肪酸を産生する Clostridium tyrobutyricum の補給により腸と脳の関門の恒常性が回復することが示されています [36]。短鎖脂肪酸はグルタミン酸、グルタミン、ガンマアミノ酪酸、神経栄養因子の産生にも影響を及ぼします。プロピオン酸と酪酸はセロトニンとカテコールアミンを合成する酵素の発現を調節し、細胞内のカリウム濃度を調節します ([37] でレビュー)。腸内細菌叢の不均衡の状態では、一部の病原体は、神経毒性効果を発揮し、認知機能や脳の獲得免疫系の機能的反応を損なう可能性のある、D-乳酸、アンモニア、インドキシル硫酸などの代謝物を産生する可能性があります [38,39,40,41,42]。さらに、うつ病との関連における腸内細菌叢に関する最新の知識により、この病理に対抗する上での短鎖脂肪酸の重要性が強調されています。特に、うつ病のマウスモデルに関するいくつかの研究では、酪酸が認知障害や社会的障害に関連する行動の変化に対抗する抗うつ特性を持つことが示されています [43,44,45]。 |
| 腸内細菌叢は神経保護に関与する他の重要な成分とも密接に相互作用しており、特にグリア細胞の恒常性は腸内細菌叢の影響を受けることが示されています [46]。グリア細胞は中枢神経系と末梢神経系の両方に存在する非神経細胞です。神経系の恒常性の維持からミエリン形成、ニューロンへの酸素と栄養の供給、病原体の破壊まで、さまざまな機能を持っています。腸グリア細胞は腸管上皮細胞の直下の腸粘膜に存在し、神経保護、腸管バリアの維持、免疫応答の調整を担っています [47]。腸内細菌叢はグリア細胞の出生後の発達的移動プロセスに関与し [46]、神経系のミクログリアの成熟と機能を制御することが観察されています [46,48]。グリア細胞の恒常性は腸内細菌叢によって影響を受けることが示されており[46]、特にグリアは微生物叢が存在しない場合はリポ多糖類(LPS)やウイルスなどの免疫刺激剤に反応できない[49]。 |
| これまでに議論された証拠は、腸-脳軸における分子レベルのミスコミュニケーションが神経精神疾患および神経変性疾患に寄与していることを強く示唆しています(図 1)。腸の炎症は腸管バリアの完全性を損ない、それによって粘膜透過性を高めます。これにより、病原体とその代謝物が全身循環に漏れ出し、免疫シグナル伝達と炎症を誘発する可能性があります。新たな証拠は、腸内細菌叢の乱れが、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)、多発性硬化症(MS)などの神経変性疾患の発症と進行に寄与していることを示しています [50,51](図 2)。たとえば、アルツハイマー病患者では、腸内細菌叢組成の大きな変化、加速した老化、タウリン酸化、β アミロイド形成、神経炎症などの神経変性の特徴が観察されています [52,53]。さらに、腸内細菌叢の乱れは、脳神経ペプチドYの血漿および結腸代謝プロファイルの変化などの有害な誘因を通じて神経変性を悪化させ、脳の老化、うつ病、睡眠障害、不安に寄与する可能性があります[54,55,56]。最後に、老化した脳は一般的に、DNA修復システムの障害、ミトコンドリア機能障害、炎症、酸化損傷、オートファジー、神経カルシウム恒常性の調節不全、および異常な神経ネットワークによって特徴付けられ、これらすべてが一緒になってアルツハイマー病、パーキンソン病、および脳卒中に対する感受性を高めます[57]。 |
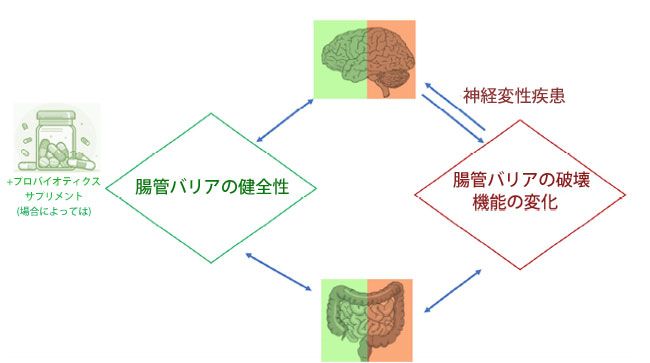 |
| 図 1 キャプション。腸内細菌叢- 腸-脳軸。ユービオシスと健全な腸管バリアは、腸-脳軸内の生理学的コミュニケーションを促進します。逆に、ディスバイオシス(腸内細菌叢の乱れ)は腸管バリアの破壊と関連しており、炎症性メディエーターの放出を引き起こし、それが脳に到達して神経細胞の変化を引き起こし、神経変性疾患の発症につながります。 |
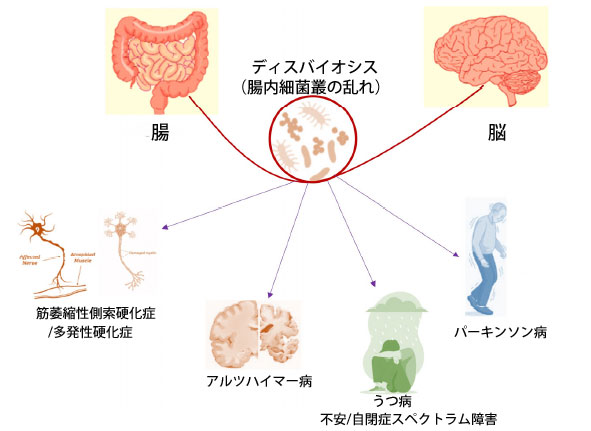 |
| 図 2 キャプション。ディスバイオシス(腸内細菌叢の乱れ)が脳-腸間相互作用に影響を及ぼします。腸内細菌叢の種の豊富さの不均衡は脳-腸間軸に影響を及ぼし、神経変性疾患の発症に重要な役割を果たします。 |
| 逆に、健康な遺伝子組み換え食品の促進は神経変性疾患のリスクを最小限に抑える可能性がある [58,59,60]。新たな証拠によると、適切な量を摂取すると宿主生物に健康上の利益をもたらすことができる生きた細菌である補助プロバイオティクスの投与は [61]、老化を含むいくつかの状態でユーバイオシスを回復できる一般的な有望な治療法であることを示しています [62,63,64,65]。 特に、最新のデータでは、プロバイオティクス細菌Lactiplantibacillus plantarumは腸の慢性炎症性疾患、がん、感染症、妊娠に有益であるだけでなく [66,67,68]、腸-脳軸にも有益であり、げっ歯類モデルとヒトの両方で血液-脳関門の完全性を維持し、神経変性に対抗することを示しています [69,70,71]。いくつかの(主に)前臨床研究では、さまざまなLactiplantibacillus plantarum株が神経細胞の酸化ストレスや、加齢やアルツハイマー病における認知機能の低下に対抗できることも示されています[72,73,74,75,76,77,78,79,80,81,82,83]。 |
| 3. 乳酸菌、Lactiplantibacillus plantarum、および神経変性疾患 |
| 乳酸菌は、グラム陽性菌の多様なグループです。その代謝特性と安全性特性のおかげで、古代からいくつかの乳酸菌が食品の発酵に使用され、食品の保存、感覚的および栄養的品質に貢献してきました。過去数十年間、さまざまな種がプロバイオティクス特性のために科学的関心を集めています[84]。乳酸菌は、乳糖消化の促進、腸内感染の抑制から免疫システムの調節、腸の保護に至るまで、多くの推定健康効果を発揮します。乳酸は、炭水化物発酵から生じる主な分解産物です[85]。 乳酸菌グループの中で、Lactobacillus 属は最も代表的でありながら異質な属であり、遺伝子型、表現型、生理学的特性に大きな違いを持つ100を超える同定された種で構成されています[85]。Lactobacillus 株は自然界に広く分布しており、多くの健康促進作用があり、人間が安全に摂取してきた長い歴史があります[86]。常在細菌の最も重要な作用の1つは、粘膜免疫系を調節することによって達成される宿主の健康の促進です。乳酸菌依存性免疫調節作用は、外来の無害な抗原に対する寛容原性機構の活性化に不可欠であるだけでなく[87]、腸の恒常性の維持にも重要です[88]。乳酸菌には抗酸化作用があることも示されており、これはおそらく抗酸化代謝物や活性酸素を除去する酵素を産生する能力、宿主の抗酸化酵素の活性をアップレギュレーションしながら酵素の活性酸素産生を阻害し、宿主と宿主の腸内細菌叢の抗酸化関連シグナル伝達経路を調節する能力に起因すると考えられる[89,90,91]。 |
| プロバイオティクスサプリメントやヨーグルト、発酵食品などのプロバイオティクス含有製品の食事摂取は、腸内細菌叢組成を有益に操作し、ユーバイオシスを再開し、多様性を高めるための効果的な戦略として浮上しています。乳酸菌は、多くの場合 Bifidobacteriaと組み合わせて、免疫調節機能を促進し、短鎖脂肪酸や結腸免疫グロブリンA(IgA)などの微生物副産物を生成し、消化管機能を調節することが示されています。Lactobacillus属の中でも、ヘテロ発酵性、非運動性、非胞子形成細菌であるLactiplantibacillus plantarumは、健康に有益な効果を示す最も有望な種の1つです[92]。Lactiplantibacillus plantarumは土壌、野菜関連、および人間の消費のための発酵食品を含む食品関連のニッチに定着するため、環境中に非常に広く分布しています。さらに、Lactiplantibacillus plantarumは口や膣、腸管を含むヒトの粘膜に自然に存在する菌です[93,94]。プロバイオティクス効果を謳うLactiplantibacillus plantarum株は現在、栄養補助食品や多様なプロバイオティクス製剤の形で商品化されています[71,95]。 |
| 腸内細菌叢の活用には、プロバイオティクス、プレバイオティクス、シンバイオティクス、抗生物質、糞便細菌叢移植(FMT)の使用を含むいくつかの戦略が含まれます。心血管疾患 [96]、消化管感染症 [97,98]、婦人科疾患 [99]、過敏性腸症候群および炎症性腸疾患 [100,101]、大腸がん [102]、高コレステロール血症および肥満 [103,104]、糖尿病 [105] などの病状の予防および/または改善のための食事介入として、多様なヒトプロバイオティクスLactiplantibacillus plantarum株を使用することが成功したことを裏付ける十分な証拠があります。これらの理由から、Lactiplantibacillus plantarum株は病気の被験者と健康な被験者の両方で臨床研究に使用されています。例えば、ランダム化プラセボ対照二重盲検クロスオーバー試験では、22人の健康な被験者が、4週間のウォッシュアウト期間を挟んで、Lactiplantibacillus plantarumR1012、Bifidobacterium longum R0175と Lactobacillus helveticus R0052を含む混合物またはプラセボのいずれかによる4週間の治療期間を受けました。プロバイオティクス補給介入により、脳の形態と安静時の脳機能に明確な変化が見られ、腸-脳軸の心理(生物学的)マーカーも改善しました[106]。このような状況で、Lactiplantibacillus plantarum補給は、認知障害[107]および神経変性疾患(表1)の患者の臨床管理のための補助戦略として浮上しています。 |
| 表 1 神経変性疾患を軽減するために研究されている 乳酸菌。乳酸菌の中で、さまざまな種が神経変性疾患と関連付けられています。Lactiplantibacillus plantarum は、あらゆる神経変性疾患で最も研究されているものの 1 つです。 |
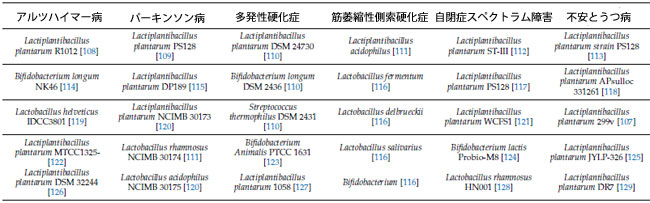 |
| Lactiplantibacillus plantarumの精神生理学的活性は、腸内細菌叢の再構成、核因子E2関連因子2(Nrf2)の活性化、活性酸素の産生の減少または除去の増強、抗炎症性サイトカインの産生など、さまざまなメカニズムの活性化を介して起こると考えられています[130]。腸内細菌叢の有益な再構成は腸の運動を助け、粘液、短鎖脂肪酸、神経系の不安や痛みを軽減する上で重要な役割を果たすガンマアミノ酪酸やセロトニンなどの神経伝達物質の産生を容易にします[113]。さらに、キヌレニンなどの代謝物の阻害を介して、腸内細菌叢は抗炎症メカニズムと抗酸化機構を促進し、神経新生を促進することができます[107,131,132,133]。 短鎖脂肪酸は、その生理機能の中でも、核因子E2関連因子2(Nrf2)を活性化する能力があり[134]、DNA修復機構を活性化し、線条体細胞、脳、結腸の多数の抗酸化遺伝子を制御します[109,125]。さらに、Lactiplantibacillus plantarumは中枢神経系の重要な免疫細胞であるミクログリアの過剰活性化を抑制することが示されています[135]。ミクログリアの生理機能が変化すると、神経免疫応答の過剰活性化と炎症が起こり、神経変性を引き起こします[135]。この点で、Lactiplantibacillus plantarumはミクログリアにおける抗炎症機構を促進しながら、炎症性サイトカインの産生を減らすことができます[135]。 |
| 次のセクションでは、腸内細菌叢の役割に関する証拠を検討し、神経変性疾患における Lactiplantibacillus plantarum補給の潜在的な精神生物学的役割について説明します。 |
| 4. アルツハイマー病、認知障害、老化 |
| アルツハイマー病または認知障害は、中枢神経系に影響を及ぼし、進行性の認知機能低下を特徴とする高齢者の典型的な病理です。アルツハイマー型認知症の罹患患者数は2060年までに現在の2倍以上に増加し、アルツハイマー病は米国で6番目に多い死因になると推定されています[136,137]。老化の要の1つは、Bacteroides, Prevotella, および Lactobacilli,などの重要な分類群の遺伝子組み換え多様性の喪失であり、同時にRuminococcus とEnterobacteriaceaeの存在が増加しています[136]。アルツハイマー病の主な特徴は、アミロイドβ(Aβ)と過剰リン酸化タウの過剰な沈着です[138]。これらは、それぞれ細胞外老人斑と細胞内神経原線維変化の基本構造タンパク質です。アミロイド蓄積と神経炎症がシナプス喪失や認知機能低下を引き起こす関係については、まだ議論が続いています。しかし、新たな観察結果は、アルツハイマー病の病原性因子として腸内細菌叢の乱れが関与していることを示唆しています。細菌性エンドトキシンは、アルツハイマー病におけるアミロイドーシスとそれに伴う神経炎症に関与していることが以前に示されており[139,140]、プラークの成分として発見されています[139,141]。200人以上のアルツハイマー病患者を対象とした研究では、対照群と比較して、糞便中のEscherichia/Shigella、すなわち炎症誘発能を持つ分類群の存在量が増加し、有益なEubacterium rectaleの存在量が減少していることが示されました[142]。これらの患者では、この特異な腸内細菌叢シグネチャーは、インターロイキン-6(IL-6)、C-X-Cモチーフケモカインリガンド2(CXCL2)、ヌクレオチド結合オリゴマー化ドメイン(NOD)受容体およびロイシンリッチリピートおよびピリンドメイン含有-3(NLRP-3)などの血液炎症性バイオマーカーと有意に関連していた[142]。さらに、中国のアルツハイマー病患者コホートでは、糞便真菌のディスバイオシスが観察され、IP10およびTNFαと正の相関関係にあるCandida tropicalisおよびSchizophyllum communeの増加と、TNFαと負の相関関係にあるRhodotorula mucilaginosaの減少がみられた[143]。 |
| 腸内細菌叢代謝産物、特に短鎖脂肪酸のレベルの低下も、アルツハイマー病発症の要因として示唆されています。アルツハイマー病マウスモデルでは、腸内細菌叢の多様性の低下と循環短鎖脂肪酸レベルの低下が見られました[144]。代謝予測では、これらのマウスのアミロイド蓄積や腸の形態異常と関連する可能性のある30以上の代謝経路の変化が強調されました[144]。さらに、短鎖脂肪酸はタンパク質間結合やアミロイドβ(Aβ)ペプチド間の結合の形成を阻害し、アルツハイマー病に関連するシナプス機能障害や認知障害の原因となる神経毒性オリゴマーの生成を阻害できることが観察されました[106,145]。アルツハイマー病におけるLactiplantibacillus plantarum補給の役割は、腸内細菌叢の組成、循環短鎖脂肪酸レベル、炎症に有益な影響を与え、最終的にアルツハイマー病動物モデルの認知機能を改善する可能性があります[146,147]。さらに、アルツハイマー病誘発ラットモデルでは、Lactiplantibacillus plantarum MTCC1325株は、神経エネルギー代謝に関与し、そのレベルが減少するとアルツハイマー病の進行に関与することが知られているATPase酵素のすべての構成成分を元に戻し、神経変性を遅らせました[122]。アルツハイマー病マウスへの別の株の補給、すなわちLactiplantibacillus plantarum PS128は、運動機能を改善し、認知機能低下、うつ病および不安行動特性、アミロイドβ沈着、糞便中の短鎖脂肪酸プロピオン酸レベル、およびその他の神経変性マーカーに対抗することが示唆されています[108]。 |
| 加齢に伴う神経変性は左脳半球にも影響を及ぼすことが知られており、非対称な灰白質の減少を伴う領域は神経変性と関連していると考えられています[148]。この症状に対するプロバイオティクスの効果を分析した最近の臨床研究の結果では、乳酸菌ベースのプロバイオティクスサプリメントがうつ症状を軽減し、灰白質の容積を増加させることができることが示されています[149]。 |
| 5. パーキンソン病 |
| パーキンソン病(PD)は、黒質のドーパミンニューロンの喪失、線条体のドーパミン欠乏、およびミスフォールドしたα-シヌクレインの蓄積により、時間の経過とともに蓄積するいくつかの運動症状と非運動症状を特徴とする神経変性疾患です[150]。今日、パーキンソン病は世界中で障害の主な原因の1つとなっており、個人と医療制度に大きな負担をかけています[150,151]。パーキンソン病は主に高齢者に発生しますが、50歳未満の若い成人にも発症する可能性があります。パーキンソン病財団の最新データによると、世界中で1,000万人以上がパーキンソン病に苦しんでいます。 1994年から2019年の間に、男女ともに世界死亡率が大幅に増加し、1994年の1.76から2029年には5.67(10万人あたり)に上昇しました[152]。いずれにせよ、パーキンソン病の発症率は、遺伝的要因とエクスポーソーム要因によって患者によって異なります。男性は女性よりも、高齢者は若年者よりも死亡率が高いことが観察されました[152]。パーキンソン病患者によく見られる症状は、動作の緩慢化、震え、バランスの欠如、硬直、震え、痛みを伴う筋収縮、発話困難です。また、認知障害、うつ病、自律神経機能障害、嗅覚低下などの非運動症状も数多く報告されています。 |
| この病態は治癒不可能だが、病気の進行を遅らせ [153]、患者の健康を改善することを目的とした治療法はいくつかあり、例えば脳深部刺激療法やドーパミン補充療法 [154,155] などがある。腸内細菌叢と脳の関連は、パーキンソン病を含む神経変性疾患の分野で活発に議論されているトピックである。腸内細菌叢の配列データによると、パーキンソン病患者の便にはEnterobacteriaceaeが豊富に存在し、姿勢不安定性の重症度と直接相関している [156]。さらに、Escherichia coli, Klebsiella, Salmonella, Shigella, およびYersinia pestisなどの細菌種は炎症性 リポ多糖類を産生し、パーキンソン病患者の運動重症度と正の相関関係にある [156,157]。 パーキンソン病患者では、腸内細菌叢の乱れ、酪酸産生菌の減少、その結果としての短鎖脂肪酸濃度の低下が観察されており、内毒素と神経毒素の濃度上昇と相まってパーキンソン病の発症に関係している可能性がある。パーキンソン病患者の短鎖脂肪酸濃度の低下は、認知機能の低下やBMI(ボディマス指数)の低下と有意に関連しており、特に酪酸濃度の低下は姿勢不安定性・歩行障害スコアと直接相関している[158]。短鎖脂肪酸は消化管運動にも関与し、腸管神経系を生理的に調節するため、パーキンソン病患者は便秘を呈することがある[159]。さらに、糞便中の短鎖脂肪酸レベルと、非運動症状スケールスコア、ローマIII便秘/排便サブスコア、ビクトリア腸機能スケールにおける便秘に関連する便の硬さ、老年うつ病スケール-15などのいくつかのパーキンソン病関連臨床変数との間に逆相関が観察された[160]。パーキンソン病マウスモデルにおける短鎖脂肪酸、特に酪酸の補給は、運動機能を改善し、ドーパミンレベルの上昇を誘発することが示されており、短鎖脂肪酸がパーキンソン病の臨床管理における有益な補助治療である可能性があることを示唆している[161,162]。Lactiplantibacillus plantarum PS128およびCRL2130プロバイオティクス補給は、特にミクログリア活性化、炎症、神経伝達、および神経細胞死の減少において、有望な精神バイオティクスの可能性を示している[60,109,163,164]。臨床的証拠によれば、抗パーキンソン病薬と併用した補助Lactiplantibacillus plantarum PS128投与はパーキンソン病患者の生活の質を改善する可能性があることも示唆されている[109]。 |
| 6. 多発性硬化症 |
| 多発性硬化症(MS)は、腸内細菌叢のディスバイオシスを含む遺伝的要因と環境的要因によって引き起こされる再発寛解型の神経炎症性疾患です。この疾患は、脳と脊髄の白質と灰白質の複数の脱髄病変として現れるのが一般的で、リンパ球浸潤と抗体沈着によって引き起こされ、いくつかの神経症状が促進されると考えられます。腸内細菌叢、血液-脳関門、およびT細胞介在性自己免疫の変化は、多発性硬化症発症の重要な要因であることが示されています[165]。現在までに、いくつかの研究で、ヒトとげっ歯類の両方のモデルにおいて、多発性硬化症における腸内細菌叢の役割が示されています。特に、多発性硬化症患者では、Faecalibacteriumprausnitzii、Eubacterium rectale、酪酸産生細菌を含むClostridium clusters IVおよびXIVaの存在量の減少が報告されている[166]。また、主にBacteroides、Prevotella、Firmicutes、Sutterellaに属するButyricimonasなどの他の種の減少も報告されている[167,168]。また、動物モデルとヒトの両方を対象とした広範な研究により、腸内細菌叢が中枢神経系自己免疫における保護的または病原的な役割を果たしていることが強く示唆されており[169,170,171,172,173,174]、腸内細菌叢とその代謝物は免疫応答や、オリゴデンドロサイト、アストロサイト、ミクログリアなどの中枢神経系常在細胞に影響を及ぼすことが示唆されている[165,175]。治療の観点からは、多発性硬化症マウスモデルにおける短鎖脂肪酸、特に酪酸の経口投与は脱髄を抑制し、オリゴデンドロサイトの再髄鞘形成を改善することが知られている[176,177]。 |
| 多発性硬化症患者では腸内微生物叢の構成にばらつきが見られることから、食事療法やプロバイオティクスの投与が多発性硬化症患者で試験的に行われてきた。パイロット研究では、Saresellaらは小規模な多発性硬化症患者コホートに高野菜・低タンパク質食を投与し、臨床的利益を得た[178]。その結果、Firmicutesに属する酪酸産生細菌の相対的存在量が増加することが観察された。別の臨床試験では、多発性硬化症患者にLactobacillus, Bifidobacterium, およびStreptococcusを含むプロバイオティクス混合物を2か月間投与したところ、対照群と比較してLactobacillusのレベルが回復し、免疫反応が減少した[110]。一次進行性多発性硬化症のマウスモデルを用いた前臨床研究では、Vivomixxの投与により、Bacteroidetes, Tenericutes, Actinobacteria, および Saccharibacteriの相対的存在量が増加した。これには、運動障害の明らかな改善、白血球浸潤の減少、炎症性サイトカインレベル、ミクログリア症およびアストログリオーシスの減少、および酪酸および酢酸の血漿レベルの上昇が伴った [179]。 この文脈では、Lactiplantibacillus plantarumベースのプロバイオティクスサプリメントは、他の戦略と組み合わせると多発性硬化症に有益な効果をもたらすことが示されています。 たとえば、Bifidobacterium animalisと組み合わせたLactiplantibacillus plantarumプロバイオティクスは、多発性硬化症モデルで 中枢神経系への単核浸潤を減らし、自己免疫性脳脊髄炎などの多発性硬化症関連合併症を改善することが示されています [123]。 さらに、有酸素運動とLactiplantibacillus plantarum経口投与を組み合わせると、クプリゾン誘発性多発性硬化症モデルで脱髄が改善されました [127]。 |
| 7. 筋萎縮性側索硬化症 |
| 筋萎縮性側索硬化症(ALS)は進行性の神経変性を特徴とし、脳、脳幹、脊髄の運動ニューロンが失われ、随意骨格筋が失われます。臨床的負担が非常に大きいにもかかわらず、筋萎縮性側索硬化症の世界的疫学に関する明確なデータは存在しません。研究は小規模なデータセットで実施されており、多施設研究ではないため、入手可能な情報の一般的な妥当性には限界があります[180]。最近のデータによると、米国における筋萎縮性側索硬化症の有病率は10万人あたり3.84~5.56人と推定され、発症率は10万人年あたり約1.5人です[181]。 筋萎縮性側索硬化症の既知の症状には、筋力低下、筋硬直、筋けいれんなどがありますが、神経学的症状に先行して現れると思われる、便秘、腹痛、膨満感、吐き気、排便困難などの消化器症状もあります [182]。これまでに、ヒト筋萎縮性側索硬化症の神経および筋障害を再現した SOD1G93A 筋萎縮性側索硬化症マウスモデルでは、腸内細菌叢の乱れと腸管透過性の増大がみられることが実証されています [183]。また、これらのマウスに酪酸を与えると、腸管バリアの完全性と腸内細菌叢恒常性が改善され、寿命が延びます [184]。これに沿って、Rowin らは小規模なヒト研究で、 5人の筋萎縮性側索硬化症および運動ニューロン障害患者は、対照群と比較して、多様性の低下、Firmicutes/Bacteroidetes比の低下、胃食道逆流症、慢性便秘、膨満感、断続的な下痢、腹痛などの消化管障害の兆候を特徴とする変化した腸内細菌叢を呈していたことが実証された[185]。別の研究では、Mazziniらは、50人の筋萎縮性側索硬化症患者と50人の対照群における主要なヒト腸内微生物群と全体的な微生物多様性を研究し、Lactiplantibacillus plantarumを含むLactibacillus株の混合物の効果も調べた。この研究の予備的な結果では、筋萎縮性側索硬化症患者の腸内細菌叢の組成に違いがあり、E. coli と Enterobacteriaが豊富で、酵母の総量が少ないことが示されている[116]。さらに、筋萎縮性側索硬化症患者は単球/マクロファージの活性化と相関して血漿中のリポ多糖類レベルが高く、より重篤な疾患の患者ほどリポ多糖類レベルが高かった[186]。プロバイオティクス療法の結果はまだ進行中である。 |
| 8. 自閉症スペクトラム障害 |
| 自閉症スペクトラム障害(ASD)は、遺伝的要因と環境的要因の影響を受ける多因子神経発達障害であり、社会的コミュニケーションの欠陥と制限された興味および反復的な行動の存在を特徴とし、国際的な有病率は0.76%と推定されていますが、これは世界の児童人口の約16%を占めるに過ぎません[187]。 |
| 治療法は多様で均一ではなく、自閉症スペクトラム障害における行動および治療反応を理解するためにさらなる研究が必要です[188,189]。この話題は最近爆発的に広まり、十分な知識や普遍的なコンセンサスはまだありませんが、腸内細菌叢の乱れは直接的または間接的に自閉症スペクトラム障害と関連しています。特に、乳酸菌の減少[190]または過剰[191,192]がいくつかの研究で報告されており、矛盾しているように見えますが[193]、乳酸菌の不均衡と自閉症スペクトラム障害の発症との臨床的関連性を示唆しています。サプリメントの形でのプロバイオティクスの使用は、Lactobacillus acidophilus, Lactobacillus rhamnosus, およびBifidobacterium longumを含む多菌株プロバイオティクスを3か月間投与された5~9歳の罹患小児の自閉症スペクトラム障害関連症状およびディスバイオシス(腸内細菌叢の乱れ)を改善するための補助療法としても説明されている[194]。このような改善は、多菌株サプリメントを4週間摂取した小児でも観察された[195]。神経生理学的観点から見ると、自閉症スペクトラム障害は中枢神経系の主な抑制性神経伝達物質であるガンマアミノ酪酸作動性システムの改変によって特徴付けられる。脳レベルでの興奮と抑制の非定型的な交替は、自閉症スペクトラム障害患者の反応行動に影響を与える[196]。ある研究では、特に自閉症スペクトラム障害児へのプロバイオティクスの摂取が脳機能の改善を促し、興奮/抑制の不均衡を緩和することが強調された[196]。自閉症ラットでは、プロバイオティクス、特にB. longum、CCFM1077の摂取により、脳活動と小脳レベルに存在するミクログリア細胞の機能性が改善したことが示された[197]。マウスモデルで生成されたデータは、腸の健康と恒常性を維持することでLactiplantibacillus plantarum補給により自閉症スペクトラム障害症状が改善する可能性があることを示している[112,198]。したがって、腸内細菌叢調節は一部の患者に有効である可能性があると思われる[199]。これは、スペクトラム内の年少児を対象としたランダム化二重盲検プラセボ対照試験でも示されている[117]。また、自閉症スペクトラム障害患者35名を対象に、鼻腔内オキシトシンと併用したLactiplantibacillus plantarumプロバイオティクスの毎日の補給に対する自律神経反応を調査することを目的とした研究で生成されたデータでは、自律神経機能指標が改善したことが示された(表2)[200]。 |
| 表 2 臨床試験で研究されたLactiplantibacillus plantarumは神経変性疾患を軽減することが示唆されています。Lactiplantibacillus plantarumの中でも、さまざまな株が神経変性疾患と関連付けられています |
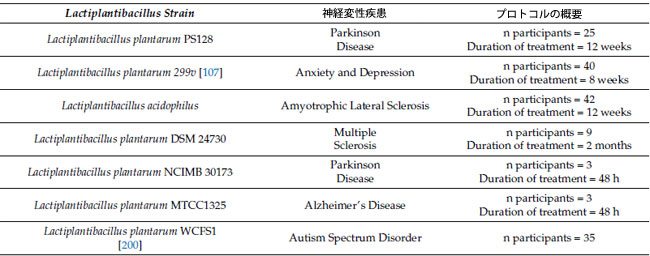 |
| 9. 不安とうつ病 |
| これまで議論してきた神経変性疾患と同様に、腸内細菌叢は行動関連および精神疾患にも影響を及ぼす可能性がある [201]。すでに述べたように、Lactiplantibacillus plantarumは 中枢神経系機能に関連する最も有望なプロバイオティクス細菌の 1 つです。ヒトの薬剤の 25% が腸内細菌叢に悪影響を及ぼし、精神疾患を悪化させる可能性があると推定されており、これらの薬剤の大部分は抗精神病薬です [202,203]。プロバイオティクスの補給は、不安やうつ病などの精神疾患に対する安全で効果的な治療戦略である可能性があり [204]、うつ病や不安関連の症状を緩和するための治療戦略としてのプロバイオティクスの臨床使用は、活動性精神疾患の患者だけでなく、非常にストレスの多い日常生活の出来事にさらされている健康な被験者にも有効であると考えられています [205]。プロバイオティクスの補給は、精神疾患やストレス誘発性行動の調節に関与するLactiplantibacillus plantarumの量を増やすことが示されています[125,149,206]。さらに、ヒトとマウスにおいて、Lactiplantibacillus plantarum PS128は神経化学物質やストレス関連症状、不安、うつ病様行動、および大うつ病性障害を有益に調節することが示されています[35,113]。また、ごく最近のBALB/cマウスの研究では、Lactiplantibacillus plantarum APsulloc 331,261が海馬の炎症をダウンレギュレーションし、短鎖脂肪酸の酢酸塩とプロピオン酸を産生するコミュニティへの微生物シフトを誘導し、うつ病様行動を弱めました[118]。著者らは、この調節が脳内の結腸セロトニン合成と神経新生の増加を刺激する可能性があると結論付けました[118]。二重盲検プラセボ対照試験では、大うつ病性障害患者を対象に、選択的セロトニン再取り込み阻害薬と併用したLactiplantibacillus plantarum 299v補給により、認知能力が改善し、キヌレニン濃度が低下した(表2)[107]。 |
| 10. 結論、限界、および将来の展望 |
| 近年、ヒトおよびげっ歯類モデルから、中枢神経系の生理機能における腸内細菌叢の役割を示す多くの証拠が明らかになっています。実際、ディスバイオシス(腸内細菌叢の乱れ)は、神経変性の発症と進行に重要な役割を果たしていることが強く示唆されています。このレビューでは、中枢神経系の健康と疾患における 腸内細菌叢の役割、特に神経変性疾患におけるLactiplantibacillus plantarumの精神生物学的可能性について説明しました。短鎖脂肪酸産生菌の濃縮を促進することで腸内細菌叢組成を有益に調整する能力と、神経伝達物質の産生を促進する能力により、Lactiplantibacillus plantarumは腸-脳軸の恒常性を維持し、中枢神経系の抗炎症および抗酸化経路を制御します。新たに出現したデータはすべて、神経変性疾患に罹患した患者の臨床管理のための新しい治療または補助戦略の設計の基礎にもなっています。しかし、決定的な結論を出すにはまだ程遠いことを指摘しておく価値はあり、無差別にプロバイオティクス療法を処方する際には注意が必要である。なぜなら、免疫反応性から敗血症、さらには抗生物質耐性まで、さまざまな悪影響が報告されているからである[207]。これは、高齢者や免疫不全患者、重篤な患者などの脆弱なサブグループでは特に考慮すべきである[208]。さらに、動物モデルで生成されたデータを人間に翻訳する際には注意が必要であり、RCT(訳者注:ランダム化比較試験とは、有効性評価のための科学的研究方法で、因果推定のための厳格な手法)。によって生成されたデータが出てきてはいるものの、治療期間、使用するプロバイオティクスの株、投与量など、考慮すべき重要な落とし穴がある。さらに、同じ神経変性疾患内であっても、異なるRCTにおける患者の募集はまだ最適ではない。さらに、腸内コロニー形成と腸内細菌叢の調節に関する患者の生理機能への利点に関するより信頼性の高いデータを得るためには、患者に投与されるプロバイオティクスの処方を、各株または複数株のバイオアベイラビリティに依存するように標準化する必要があります。また、「健康なマイクロバイオーム」の定義は依然として最も謎めいた問題の1つであり、食事に依存した腸内細菌叢の変化が健康と病気に果たす役割に関するより多くのデータが必要であり、薬物と腸内細菌叢の相互作用についてはさらなる研究が必要であり、有望な結果にもかかわらず、神経変性疾患を標的とする万能の解決策はありません。これらのタイプの研究に参加する患者の食事とライフスタイルは、腸内コロニー形成に影響を与える可能性があるため、常に考慮する必要があります。たとえば、アルツハイマー病は、プロバイオティクスは安定した腸内環境でコロニー形成を確立しないようです。そのため、複数株の処方内のどの特定の細菌が最も影響力があるかを理解することはほぼ不可能になります[209]。さらに、一部のアルツハイマー病患者では、被験者にセロトニン症候群が発生する可能性がある[210]。したがって、臨床試験の設計を実施し、登録患者数を増やし、より長い追跡期間を見据える必要がある。さらに、炎症性バイオマーカーや各神経変性疾患に関連する特定の認知評価など、より多くのエンドポイントを含める必要がある。いずれにせよ、マルチオミクスデータとシステム生物学に基づくアプローチの統合は間違いなくこの分野を前進させ、より高度なデータ解釈は腸内細菌叢と脳の軸の難問に対するより深い理解を可能にするだろう。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Int J Mol Sci. 2024 Sep; 25(17): 9489.に掲載されたPsychobiotic Properties of Lactiplantibacillus plantarum in Neurodegenerative Diseases.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |