
Zhang Min et al., |
要約 |
| ヨーグルトにプロバイオティクスを添加すると、望ましい健康効果が得られるという研究結果が、ますます注目を集めています。プロバイオティクス Lactobacillus plantarum が発酵乳の品質と機能に与える影響をさらに理解するため、プロバイオティクス L. plantarum K25 とヨーグルトスターター (L. delbrueckii ssp. bulgaricus および Streptococcus thermophilus) で作ったプロバイオティクス発酵乳 (PFM) を、ヨーグルトスターターのみで作った対照発酵乳 (FM) と比較しました。プロバイオティクス菌株は、4°C で 21 日間保存した後も、プロバイオティクス発酵乳サンプル中の生菌数が 7.1 ± 0.1 log CFU/g と良好に生存することが示されました。菌株は、ミルクの香りとともにアセトインや 2,3-ブタンジオールなどの揮発性物質の生成を促進することが示され、冷蔵保存中に後酸性化は引き起こしませんでした。 ガスクロマトグラフ質量分析計(GC-MS)データセットと多変量統計解析を組み合わせたメタボロミクス解析により、L. plantarum K25の添加により、発酵乳で検出された20種類以上の代謝物の生成が増加し、その中でγ-アミノ酪酸が最も顕著であることが示されました。グリセリン酸、リンゴ酸、コハク酸、グリシン、アラニン、リボース、1,3-ジヒドロキシアセトンなど、発酵乳に比較的多く含まれる他のいくつかの代謝物とともに、これらはL. plantarum K25のプロバイオティクス機能に重要な役割を果たしている可能性があります。プロバイオティクス発酵乳サンプルの生物活性をさらに分析したところ、冷蔵保存1日目の22.3%から21日目の49.3%へと、アンジオテンシン変換酵素(ACE)阻害活性が有意に(p < 0.05)増加しました。したがって、プロバイオティクスL. plantarum K25は、機能性乳製品への潜在的な応用が検討される可能性があります。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.材料と方法 |
| 2.1.細菌培養 |
| 2.2.発酵乳の調製 |
| 2.3.生菌数の計測 |
| 2.4.pH変化の測定 |
| 2.5.固相マイクロ抽出-ガスクロマトグラフィー/質量分析プロファイリング |
| 2.6.誘導体化 |
| 2.7. ガスクロマトグラフ質量分析計分析 |
| 2.8. アンジオテンシン変換酵素阻害活性 |
| 2.9.データ分析 |
| 3.結果と考察 |
| 3.1.発酵乳におけるプロバイオティクスの生存性と pH の変化 |
| 3.2.ヘッドスペース固相マイクロ抽出-ガスクロマトグラフィー/質量分析で測定した揮発性代謝物プロファイル |
| 3.3.発酵乳の保存前の異なる代謝産物の分析 |
| 3.4.発酵乳の保存中の代謝物の変化の分析 |
| 3.5.アンジオテンシン変換酵素阻害活性 |
| 本文 |
| 1.はじめに |
| 腸内細菌叢の調整、コレステロール値の低下、血糖値の調整など、さまざまな機能を備えたプロバイオティクス食品の開発への関心が高まっています [1]。ヨーグルトは世界中で消費されている発酵乳製品で、栄養価が高く、特にプロバイオティクス細菌で強化された場合に健康上の利点が確立されています [2-5]。ヨーグルトにプロバイオティクスのビフィズス菌と乳酸菌を添加することは、現在ヨーグルト製造で一般的になっていますが、ヨーグルトの加工および保管中にさまざまな機械的ストレス、低 pH、低温、酸素などの不利な要因を考慮すると、プロバイオティクスの生存率を維持することが懸念されています [6]。消費者に健康上の利点を提供するには、消費されるまでプロバイオティクス製品中の生菌数を 106 ~ 109 CFU/ml の範囲で冷蔵 (約 6°C) 中に生存可能なプロバイオティクス細胞を維持することが最も重要です [7]。 |
| メタボロミクスは、生体(微生物など)の代謝によって生成および変化する細胞内代謝物の同時測定と定量分析を扱います。これらの低分子量(1,500 Da未満)の代謝化合物は遺伝的にコード化されておらず、ペプチド、アミノ酸、核酸、炭水化物、有機酸、ビタミン、ポリフェノール、アルカロイド、ミネラルが含まれます[5, 8]。メタボロミクスは、大豆製品、チーズ、ヨーグルト、ワインなどの発酵食品の分子指紋を食品の品質と熟成度、および製品のトレーサビリティと真正性に関して評価するために食品科学で効果的に使用されてきた[9]。たとえば、過敏性腸症候群の患者の血清と糞便を使用して、高解像度マジック角回転核磁気共鳴(HRMAS-NMR)によるメタボロミクス分析が行われました。結果は、プロバイオティクスのLactobacillus 菌株とBifidobacteria菌株を含む発酵乳による治療の有効性を明らかにし、2か月の治療後に血糖値、チロシン、乳酸値の変化が正常化した[10、11]。 |
| 我々は以前の研究で、中国チベットケフィア粒から、病原菌のバイオフィルム形成を阻害し、血清コレステロール値を下げ、マウスモデルで腸内細菌叢を調整する能力を持つプロバイオティクスL. plantarum K25株を分離し、同定した[12-14]。L. plantarum K25の全ゲノム配列決定が完了し、そのプロバイオティクス特性に関連する機能遺伝子も分析された[15]。しかし、代謝物の形成と変化、またはL. plantarum K25を含む発酵乳の揮発性物質と生物活性に対する関連する影響についてはほとんどわかっていない。(ACE)に対する阻害活性を持つ発酵乳がアンジオテンシンIからアンジオテンシンIIへの変換を防ぎ、血圧を下げるという報告がいくつかあった[13, 14]。 アンジオテンシン変換酵素阻害(ACEi)活性は、Bifidobacterium bifidumMF20/5 [16]、Enterococcus durans, L. acidophilus および L. rhamnosus [17]によるプロバイオティクス発酵乳などの乳酸菌で発酵させた乳で報告されている。しかし、L. plantarumよる発酵乳のアンジオテンシン変換酵素阻害(ACEi)活性についてはあまり研究されていない。食品源からのいくつかの生理活性成分は、発酵/酵素加水分解中に形成されるペプチド [19]、発酵乳中のγ-アミノ酪酸(GABA) [20]、茶とココアのポリフェノール [21] など、抗高血圧作用があることが証明されている。 |
| 本研究では、プロバイオティクス L. plantarum K25 を添加した発酵乳について、プロバイオティクスの生存性、SPME (固相マイクロ抽出)-GC/MS (ガスクロマトグラフィー/質量分析) で分析した揮発性物質の生成、および ガスクロマトグラフ質量分析計(GC-MS)ベースのメタボロミクス法で分析した代謝物の変化について研究しました。発酵乳中の L. plantarum K25 の関連代謝経路が提案されました。さらに、プロバイオティクス発酵乳の アンジオテンシン変換酵素阻害(ACEi)活性と冷蔵保存中の活性変化も評価しました。本研究は、プロバイオティクス機能に関連する細胞代謝と、プロバイオティクス発酵乳の アンジオテンシン変換酵素阻害(ACEi)活性への影響について、さらなる理解をもたらすはずです。 |
| 2.材料と方法 |
| 2.1.細菌培養 |
| チベットのケフィア粒から分離・同定されたプロバイオティクス L. plantarum K25 は、中国長春の中国東北農業研究センターから入手しました。この菌株は、-80°C で 30% (v/v) グリセロールに保存されました。MRS (Man Rogasa Sharpe) (Difco、USA) ブロスに接種し、37°C で 12 時間培養して、細胞数を log 8-9 CFU/ml にしました。次に、この培養ブロスを再構成脱脂乳 (12%、w/v) に 2% (w/v) で接種し、発酵乳を作るためのスターターを準備しました。粉末状の L. delbrueckii ssp. bulgaricus と Streptococcus thermophilus のヨーグルトスターターは、DANISCO, Denmark から入手しました。 |
| 2.2.発酵乳の調製 |
| 発酵乳は、再構成脱脂乳 (12% w/v) を 95°C で 5 分間加熱処理し、その後 45°C に冷却し、ヨーグルトスターター 0.002 g/L を無菌的に接種して調製しました。接種した乳を 2 つの部分に分け、1 つは L. plantarum K25 を接種せずにコントロール発酵乳 (FM) とし、もう 1 つはプロバイオティクス L. plantarum K25 を 2% (w/v) 接種してプロバイオティクス発酵乳 (PFM) を調製しました。混合物をポリスチレンカップに無菌的に注ぎ、37°C で培養しました。必要な pH 値 4.5 ± 0.5 に達するまで、1.5 ~ 3 時間ごとに pH の低下を監視し、その後サンプルを 4°C に冷却して酸性化を止めました。発酵乳サンプルは 4°C で 21 日間 (市販ヨーグルトの一般的な保存期間) 保存されました。すべてのサンプルは 1 日目、7 日目、14 日目、21 日目に採取され、以下で説明する化学分析と微生物学的分析が行われました。 |
| 2.3.生菌数の計測 |
| 発酵乳サンプル1グラムあたりの生菌数は、MRS寒天培地上で37℃、24時間培養してCFU(コロニー形成単位)として表した。L. plantarum K25は、L. plantarum選択培地上で37℃、72時間嫌気培養して計測した[22]。 |
| 2.4.pH変化の測定 |
| 発酵乳サンプルの保存中の酸の生成は、pHの変化を測定することによって表されました(pH-250L、ISTEK、Korea)[23]。 |
| 2.5. 固相マイクロ抽出-ガスクロマトグラフィー/質量分析プロファイリング |
| 発酵乳のヘッドスペース揮発性物質を固相マイクロ抽出-ガスクロマトグラフィー/質量分析(SPME-GC/MS)で評価しました。各発酵乳サンプル (30 ml) を、テフロン加工されたシリコンセプタム (Microliter Analytical、USA) を含むスチールスクリュートップの 20 ml オートサンプラーバイアルに 3 連でロードしました。内部標準溶液 (メタノール中の 2-メチル-3-ヘプタノン、Sigma-Aldrich、USA) を各バイアルに追加し、発酵乳サンプルを保管温度で 4 時間以上経過してからのみ分析することで変動を分析できるようにしました [24]。 |
| サンプルは、5973 不活性 質量分析(MS )検出器 (Agilent Technologies Inc.、USA) を備えた Agilent 6890N ガスクロマトグラフに接続された CombiPal オートサンプラー (CTC Analytics、Zwingen, Switzerland) を使用して注入されました。サンプルは、ファイバーにさらす前に 10°C に維持されました。サンプルは、250 rpm で 4 秒間パルス撹拌しながら、31 mm で 1 cm のジビニルベンゼン/カルボキシン/ポリジメチルシロキサン (DVB/CAR/PDMS) ファイバーに 30 分間ファイバーにさらす前に、40°C で 25 分間平衡化されました。ファイバーは、50 mm の深さで 5 分間注入されました。ガスクロマトグラフ(GC) メソッドは、初期温度 40°C で 5 分間実行され、8°C/分のランプ レートで 250°C まで上昇し、5 分間保持しました。すべての分析には、Rtx-5ms カラム (長さ 30 m × 内径 0.25 mm × 膜厚 0.25 μm、Restek、USA) を使用し、ヘリウム流量を 1 ml/分一定に保ちました。パージ時間は 1 分に設定しました。質量分析(MS)トランスファー ラインは 250 °C に維持され、Quad は 150 °C、Source は 250 °C に設定されました。 |
| 2.6.誘導体化 |
| L-ノルロイシン、1% トリメチルクロロシラン [BSTFA (1% TMCS)] を含む N,O-ビス (トリメチルシリル) トリフルオロアセトアミド、メトキシアミン塩酸塩、無水ピリジンは Sigma-Aldrich から購入しました。解凍したサンプル 20 μl と内部標準 (5 μg/ml L-ノルロイシン) を含む冷メタノール 80 μl を混合し、60 秒間ボルテックスし、-20°C で一晩保存しました。15 分間遠心分離 (14,000 ×g、4°C) した後、上清 30 μl を窒素気流下で蒸発乾固しました。残渣をピリジン中の 20 mg/ml メトキシアミン塩酸塩 40 μl で再構成し、得られた混合物を 37°C で 90 分間インキュベートしました。次に、40 μl の BSTFA (1% TMCS を含む) を混合物に加え、ガスクロマトグラフ質量分析計メタボロミクス分析の前に 70°C で 60 分間誘導体化しました。すべてのサンプルからプールされた品質管理 (QC) サンプルのアリコートを調製し、実験サンプルと同じ手順で分析しました。 |
| 2.7. ガスクロマトグラフ質量分析計分析 |
| メタボロミクス機器分析は、Agilent 5975C 不活性 MSD システム (Agilent Technologies Inc.) に接続された Agilent 7890A ガスクロマトグラフィー システムで実施しました。誘導体の分離には、OPTIMA 5 MS Accent フューズドシリカ キャピラリー カラム (30 m × 0.25 mm × 0.25 μm、MACHEREY-NAGEL、Germany) を使用しました。ヘリウム (>99.999%) をキャリア ガスとして使用し、カラムを 1 ml/分の一定流量で通過させました。注入量は 1 μl、溶媒遅延時間は 6 分でした。オーブンの初期温度は 70°C で 2 分間保持され、その後 6°C/分の速度で 160°C まで上昇し、10°C/分の速度で 240°C まで上昇し、20°C/分の速度で 300°C まで上昇し、最後に 300°C で 6 分間保持されました。インジェクター、トランスファー ライン、電子衝撃イオン源の温度は、それぞれ 250°C、260°C、230°C に設定されました。電子イオン化 (EI) エネルギーは 70 eV で、データはフルスキャン モード (m/z 50-600) で収集されました。 |
| 2.8. アンジオテンシン変換酵素阻害活性 |
| L. plantarum K25で作られたプロバイオティクス発酵乳サンプルを遠心分離(10,000 ×g、20分、4°C)して、ペプチド画分を含む上清を得た[25]。上清のpHを7.2に調整し、上清をリン酸緩衝生理食塩水(pH = 7.2)で100倍に希釈した後、Ronca-Testoni(1983)が報告したように、トリペプチド、2-フラナクリロイルフェニルアラニルグリシルグリシン(FAPGG)を基質として使用し、いくつかの修正を加えて分光光度計で上清のアンジオテンシン変換酵素阻害活性を測定した[26]。簡単に説明すると、100 μl の FAPGG 溶液 (100 mmol/l Tris HCl、0.6 mol/l NaCl、pH 7.2 を含む反応バッファー中 1.66 mmol/l) を、96 ウェルマイクロプレート内で、同じ反応バッファー 85 μl またはサンプル 85 μL と直接混合しました。溶液を 37°C で 3 分間保持した後、15 μL の アンジオテンシン変換酵素溶液を加えました。反応は 345 nm で 10 分間モニタリングしました。アンジオテンシン変換酵素阻害活性は阻害率 (ACEi%) として計算しました。ACEi 活性は次のように計算しました。 |
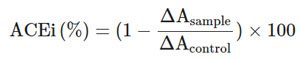 |
| ここで、Acontrolはネガティブコントロール(サンプルなし)の吸光度、Asampleはプロバイオティクスサンプルの吸光度です。 |
| 2.9.データ分析 |
| 各サンプルは5回繰り返し、3回繰り返し試験を実施した。ピークピッキング、アライメント、デコンボリューション、および生のガスクロマトグラフ質量分析計データのさらなる処理は、以前に公開されたプロトコル[27]を参照して実施した。正規化されたデータ分析は、SIMCAソフトウェア(バージョン14.1、Umetrics、Sweden)を使用して実施した。単変量統計分析では、正規化されたデータはエクセルでスチューデントのt検定によって計算された。AMDISソフトウェアは、生のガスクロマトグラフ質量分析計データから質量スペクトルをデコンボリューションするために適用された。二元配置分散分析(ANOVA)に続いてTukeyの事後検定を使用して、平均値間の有意差(p < 0.05)を判定した。すべての分析は、GraphPad Prismバージョン6.00(GraphPad software, USA)を使用して実施した。 AMDIS ソフトウェアを使用して、生のガスクロマトグラフ質量分析計データから質量スペクトルをデコンボリューションし、精製された質量スペクトルは、保持時間と質量スペクトル、Golm Metabolome Database、Agilent Fiehn GC/MS Metabolomics RTL ライブラリを含む社内標準ライブラリと自動的に照合されました。 |
| 3.結果と考察 |
| 3.1.発酵乳におけるプロバイオティクスの生存性と pH の変化 |
| 4°C で 21 日間保存した対照発酵乳 (FM)およびプロバイオティクス発酵乳 (PFM)サンプルの細菌生菌数の変化を図 1A に示します。保存初日には、対照発酵乳 (FM)およびプロバイオティクス発酵乳 (PFM) サンプルの生菌数は両方とも 9 log CFU/g を超え、後者のほうが高い数値を示しました。すべてのサンプルで生菌数の緩やかな減少が見られましたが、プロバイオティクス発酵乳 (PFM)サンプルは保存期間全体を通じて対照発酵乳 (FM)サンプルよりも大幅に高い数値を維持しました。保管終了時(21日目)の対照発酵乳 (FM)およびプロバイオティクス発酵乳 (PFM)サンプルの生菌数はそれぞれ6.4 ± 0.4 log CFU/gおよび7.6 ± 0.2 log CFU/gであったのに対し、プロバイオティクス発酵乳 (PFM)サンプル中のL. plantarum K25の生菌数は7.1 ± 0.1 log CFU/gであり、発酵乳中のプロバイオティクス株の良好な生存性を示唆している。他のプロバイオティクス株も発酵乳中で良好に生存することが示された。例えば、プロバイオティクスBifidobacterium animalis subsp. lactis BB12またはL. rhamnosus GGを共培養して作られたヨーグルトでは、両方のプロバイオティクス発酵乳サンプルの生菌数は冷蔵保存21日間を通して安定していた(8.0 log CFU/g以上)[23]。しかし、プロバイオティクス株L. delbrueckii ssp. bulgaricus 1932とL. rhamnosus PRA331の菌数は、冷蔵保存21日間でそれぞれ8.52±0.16 log CFU/gから6.50 log CFU/gに、9.08±0.09 log CFU/gから7.29±0.13 log CFU/gに減少することがわかった[25]。 |
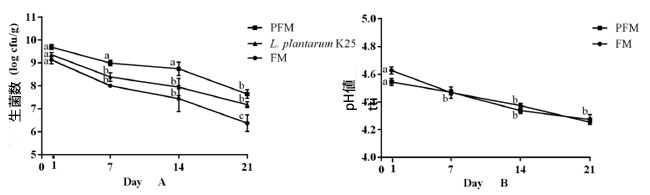 |
| 図 1 4°C で 21 日間保存した FM (ヨーグルトスターターで作った発酵乳) と PFM (ヨーグルトスターターとプロバイオティクス L. plantarum K25 で作った発酵乳) の生菌数 (A) と pH (B) の変化。 |
| 発酵乳サンプルの保存中のpHの変化をモニタリングしました(図1B)。保存終了時のpH値は対照発酵乳 (FM)サンプルで4.3、プロバイオティクス発酵乳 (PFM)サンプルで4.2と、同様のpH低下パターンが見られました。これは、プロバイオティクスのL. plantarum K25を添加しても、冷蔵保存中に発酵乳の後酸性化は起こらないことを示唆しています。これまでに、L. plantarum WCFS1、L. rhamnosus GG、Bifidobacterium animalis subsp. lactis BB12などのいくつかのプロバイオティクス株が、発酵中に発酵乳で同様のpH低下パターンを示し、冷蔵保存21日後に最終pH値が約4.1になることが示されています[28]。 |
| 3.2.ヘッドスペース固相マイクロ抽出-ガスクロマトグラフィー/質量分析で測定した揮発性代謝物プロファイル |
| 冷蔵保存 21 日間の対照発酵乳 (FM)およびプロバイオティクス発酵乳 (PFM)サンプルにおける揮発性代謝物プロファイルの変化を表 1 に示します。検出されたさまざまな揮発性化合物の中で、発酵乳の典型的な香りの原因となる C4 化合物として知られるアセトインと 2,3-ブタンジオールは、保存中に比較的高濃度で検出されました。これらの化合物は、 Lactococcus, Leuconostoc, やWeissella などのいくつかの乳酸菌の解糖またはクエン酸代謝によって生成される可能性があります。アセトインはジアセチルの刺激を軽減するのに重要であり、マイルドでクリーミーな風味に貢献しました [29]。2,3-ブタンジオールはアセトインの還元型であり、クリーミーまたはバターのような特性への貢献は限られていました [30]。 |
| 表 1 FM (ヨーグルトスターターで作った発酵乳) および PFM (ヨーグルトスターターとプロバイオティクス L. plantarum K25 で作った発酵乳) サンプルのガスクロマトグラフ質量分析計による揮発性代謝物の同定と冷蔵保存中のそれらの変化。 |
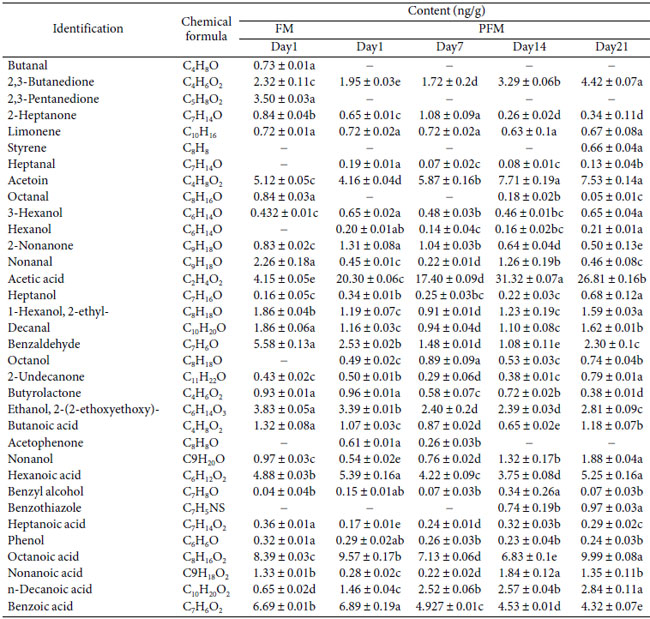 |
| 提示された値は平均 ± 標準偏差です。同じ行の後に異なる文字が続く平均値は有意に異なります (p < 0.05)。 |
| 表1は、プロバイオティクス発酵乳中にアルデヒド、酸、アルコール、フェノールなど、他の多くの揮発性化合物が検出されたことも示しています。これらの揮発性物質のうち、アルデヒド(ブタナール、ヘプタナール、オクタナール、ノナナール、デカナール、ベンズアルデヒド)、アルコール(3-ヘキサノール、ヘキサノール、オクタノール、ベンジルアルコール)、およびタンパク質分解によって生成された遊離アミノ酸に由来する可能性のあるフェノールは、ヨーグルトの風味に寄与している可能性があります[30]。以前の研究では、プロバイオティクスL. rhamnosus GGは発酵乳中の主要な芳香形成揮発性代謝物に大きな影響を与えませんでしたが、揮発性および非揮発性有機酸、および遊離アミノ酸の形成に寄与したことが示されています[32]。 L. caseiを含む発酵乳には酢酸、酪酸、カプロン酸、2-ペンタノン、2-ブタノンなどの揮発性物質が主に含まれていたが、ヨーグルトに典型的な揮発性化合物は含まれていなかった[33]。 |
| 3.3.発酵乳の保存前の異なる代謝産物の分析 |
| 保存前の L. plantarum K25 を含む対照発酵乳 (FM)と プロバイオティクス発酵乳 (PFM)のサンプル間の代謝産物の違いをメタボロミクス法で分析しました (図 2)。2 つのサンプル間には大きな違いが見られ、プロバイオティクス発酵乳 (PFM)サンプルでは γ-アミノ酪酸(GABA)、2-ヒドロキシカプロン酸、リンゴ酸、2-ヒドロキシグルタル酸、ミオイノシトール、リボース、ピルビン酸、グリセリン酸、キシルロース、2-ヒドロキシ酪酸のレベルが著しく高くなりました。対照発酵乳 (FM)サンプルでは、2-ヒドロキシイソカプロン酸、チロシン、N-アセチル-D-グルコサミンのレベルが高かったことがわかりました。これらには、糖代謝、アミノ酸代謝、アミノ糖およびヌクレオチド代謝、その他の微小分子代謝など、いくつかの代謝経路が関与している可能性があります。これらの代謝物のうち、プロバイオティクス発酵乳 (PFM)サンプルではγ-アミノ酪酸(GABA)のレベルが最も高く、L. plantarum K25がγ-アミノ酪酸(GABA)の形成に主な役割を果たしていることが示されています。チーズ、ヨーグルト、豆乳、発酵パンなど、γ-アミノ酪酸(GABA)を豊富に含む食品に関する報告が多数あります[34-36]。γ-アミノ酪酸(GABA)は神経伝達や降圧作用などの重要なプロセスで生理機能を持ち、不安、恐怖、うつ病を軽減するほか、がん細胞の浸潤を遅らせたり阻害したり、記憶力を改善したり、皮膚の傷を治癒したりする[20、37]。L. brevis DPC6108、L. brevis PM17、L. plantarum C48、L. paracasei PF6、L. lactis PU1などの多くの乳酸菌株は、グルタミン酸ナトリウムを添加した培地で増殖させたときにγ-アミノ酪酸(GABA)を合成することが示されている[35、38]。 |
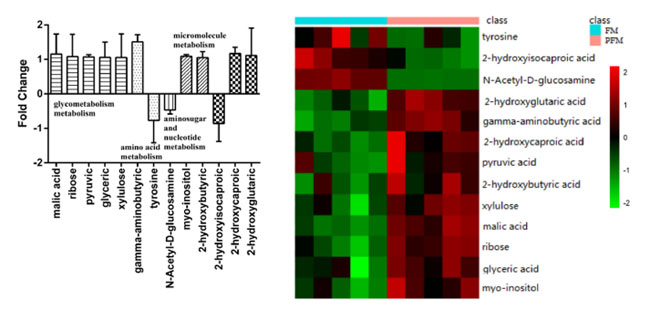 |
図 2 保存前の FM (ヨーグルトスターターで作った発酵乳) と PFM (ヨーグルトスターターとプロバイオティクス L. plantarum K25 で作った発酵乳) サンプル間の代謝物の違い。 正の軸は L. plantarum K25 を含む プロバイオティクス発酵乳 (PFM)サンプルでの代謝物の生成の増加を示し、負の軸は対照発酵乳 (FM)サンプルでの代謝物の生成の増加を示します。 |
| 3.4.発酵乳の保存中の代謝物の変化の分析 |
| 発酵乳中のプロバイオティクス L. plantarum K25 による代謝物の形成メカニズムをさらに理解するために、プロバイオティクス発酵乳 (PFM)サンプルのメタボロミクス分析により、冷蔵保存 21 日間の代謝変化をさらに調査しました。表 2 は、保存中のプロバイオティクス発酵乳 (PFM)サンプルの代謝物の変化を示しています。 |
| 表 2 L. plantarum K25 を含むプロバイオティクス発酵乳 (PFM) を 21 日間冷蔵保存した際の代謝物の変化と アンジオテンシン変換酵素阻害活性との相関関係のメタボロミクス分析。 |
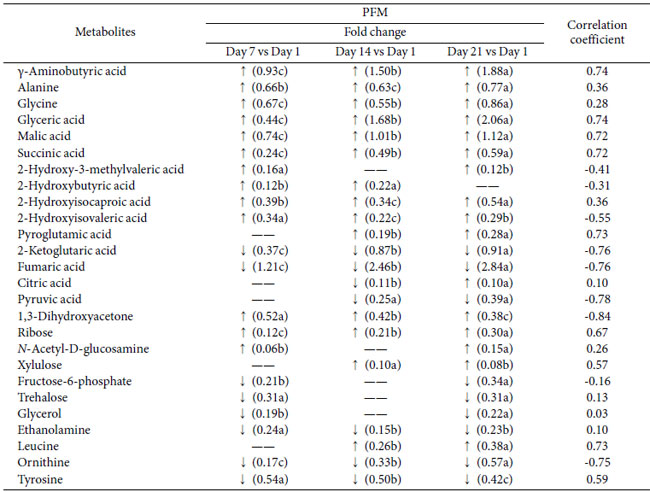 |
| 同じ行の後に異なる文字が続くデータは有意に異なります (p < 0.05)。 |
| 検出された代謝物のうち、プロバイオティクス発酵乳 (PFM)サンプル中の主な糖は 1,3-ジヒドロキシアセトン、リボース、キシルロースでした。1,3-ジヒドロキシアセトンとキシルロースの濃度は、おそらく細菌が生き残るためのエネルギーとして糖を利用したため、保存中に減少しました。主に RNA の加水分解で生成されるリボースは、リボースを利用できなかった L. amylovorus NCFB 2745 で以前に報告されたように、微生物によって利用されない可能性があります [39]。さらに、アミノ酸 (γ-アミノ酪酸(GABA)、グリシン、アラニン、オルニチン、チロシン、2-ケトグルタル酸、フマル酸) と有機酸 (リンゴ酸、2-ヒドロキシイソカプロン酸、2-ヒドロキシイソ吉草酸、グリセリン酸、コハク酸、クエン酸) の増加も、保存期間全体を通じて観察されました。多くの代謝物は、提案された経路とは無関係にタンパク質や他の大きな分子の分解によって直接生成されましたが、主要な機能性代謝物であるγ-アミノ酪酸(GABA) は、アミノ酸代謝経路に関与する L. plantarum K25 によって生成されました。さらに、貯蔵に使用されるいくつかの代謝物は、エネルギー、炭素、窒素源を獲得するために代謝経路を使用する可能性があります。本研究で発見された代謝物に基づいて、アミノ酸分解経路、クエン酸回路 (TCA 回路)、ペントースリン酸経路 (PPP)、尿素回路を含む、L. plantarum K25 の関連代謝経路が構築されました (図 3)。 |
| 有機酸、アミノ酸、糖は、発酵製品の味や風味の質、および機能特性に直接関係していることが知られています。本研究で観察されたこれらの代謝物の生成増加は、プロバイオティクスL. plantarum K25発酵乳の官能品質と機能性を変化させる可能性があります。以前にも、発酵食品の保存中にいくつかの有機酸の生成増加がガスクロマトグラフ質量分析計(GC-MS)によって検出されました[40-41]。グリセリン酸はフルクトース分解産物の代謝物であり、肝臓刺激作用とコレステロール分解作用がありました[42]。リンゴ酸は、フリーラジカルを捕捉する抗酸化作用や、抗がん剤やカルシウムの吸収促進など、多くの生理機能が報告されています[43]。コハク酸は、受動的および能動的な皮膚アレルギー反応を抑制し、動物血清中のIgE抗体の形成を減らすことができます[44]。プロバイオティクスL. plantarum WCFS1を含む発酵乳では、保存中にアラニン、ロイシン、グリシン、チロシンなどのアミノ酸の生成が著しく増加することも報告されています[45]。 L. plantarum K25を含むプロバイオティクス発酵乳 (PFM)サンプルではグリシンの含有量が比較的高いレベルに増加したことは興味深いことですが、これは他のプロバイオティクス発酵乳では報告されていません。 グリシンは、メチオニン、セリン、スレオニン、ビタミンB6、デオキシリボ核酸など多くの重要な物質の基本構造であると報告されており、パーキンソン病、慢性腸炎、胃酸過多を予防する機能があり、心血管疾患を治療する機能があるとされています[46-50]。 グリシン-アラニン複合体には抗腫瘍活性があることが示されています[51]。 アラニンは腎臓結石を予防し、グルコース代謝を助け、低血糖を緩和し、体力を向上させる可能性があります[52]。さらに、プロバイオティクスL. plantarum K25発酵乳中のリボース濃度の上昇は有益である可能性がある。なぜなら、リボースの経口投与は、筋肉のエネルギーを増強してそれを容易に利用できるようにすることで運動能力を向上させ、慢性疲労症候群、線維筋痛症、冠動脈疾患などの疾患の症状も改善すると報告されているからである[53]。最後に、1,3-ジヒドロキシアセトンは、運動能力を促進する解糖系の3炭素化合物であった[54]。 |
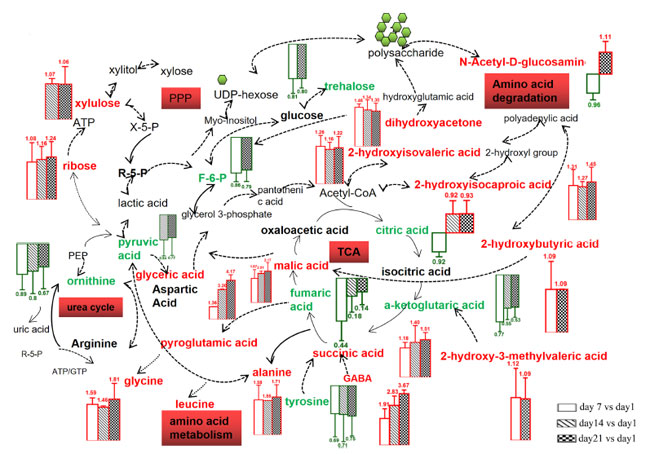 |
図 3 PFM (ヨーグルトスターターとプロバイオティクス L. plantarum K25 で作られた発酵乳) サンプルを 4°C で 21 日間保存した際に生成された代謝物の模式図。 UPLS-Q-TOF によって識別された代謝物は、赤と緑でマークされています。赤は代謝物の増加、緑は代謝物の減少を表します。 |
| 3.5.アンジオテンシン変換酵素阻害活性 |
| プロバイオティクス L. plantarum K25 は、アミノ酸の生成増加によって示されるように、発酵乳のタンパク質分解を促進する可能性があります (表 2)。Lactobacillus 株によって生成された発酵乳のタンパク質分解の程度は、アンジオテンシン変換酵素阻害(ACEi)活性と相関することが示されました [55]。L. casei YIT 9029 による発酵乳の加水分解の程度と アンジオテンシン変換酵素阻害(ACEi)活性の間には良好な相関関係があることも報告されています [56]。この研究では、L. plantarum K25 を含む発酵乳の生物活性をさらに分析し、乳タンパク質の抗高血圧加水分解物に関連することが多い アンジオテンシン変換酵素阻害(ACEi)活性を測定しました [57]。図 4 に示すように、L. plantarum K25 を含む プロバイオティクス発酵乳 (PFM)サンプルのアンジオテンシン変換酵素阻害(ACEi)活性は、対照発酵乳 (FM)サンプルよりも有意に高かった。 プロバイオティクス発酵乳 (PFM)サンプルでは、保存21日間でアンジオテンシン変換酵素阻害(ACEi)活性が22.3%から49.3%に徐々に増加することが観察され、保存中に発酵乳中に生理活性代謝物が形成されたことを示唆しています。そのため、保存中のプロバイオティクス発酵乳 (PFM)サンプルの代謝物とアンジオテンシン変換酵素阻害(ACEi)活性の相関関係をさらに分析しました。表2に示すように、γ-アミノ酪酸(GABA)、グリセリン酸、リンゴ酸、コハク酸、ピログルタミン酸、ロイシンなど、いくつかの代謝物はアンジオテンシン変換酵素阻害(ACEi)活性と比較的強い正の相関関係(係数> 0.70)を示しました。2-ケトグルタル酸、フマル酸、ピルビン酸、オルニチン、1,3-ジヒドロキシアセトンでは、アンジオテンシン変換酵素阻害(ACEi)活性と比較的強い負の相関関係(係数> - 0.70)が見られました。 |
| 以前、プロバイオティクス発酵乳を冷蔵保存すると、アンジオテンシン変換酵素阻害(ACEi)活性が徐々に増加することがわかっている[58]。プロバイオティクス発酵ヤギ乳の浸透物も高いアンジオテンシン変換酵素阻害(ACEi)活性を持つことが示されている[55]。L. casei ATCC 393は発酵豆乳で高いアンジオテンシン変換酵素阻害(ACEi)活性を示した[59]。この研究では、L. plantarum K25を含む発酵乳のアンジオテンシン変換酵素阻害(ACEi)活性は、L. casei L26およびLC279 [60]、およびL. casei FC113 [61]などの他のプロバイオティクスで報告されたものと同等であった。L-グルタミン酸由来のγ-アミノ酪酸(GABA)はアンジオテンシン変換酵素阻害(ACEi)活性を持つことが示された[62]。しかし、L. plantarum K25を含むプロバイオティクス発酵乳 (PFM)のアンジオテンシン変換酵素阻害(ACEi)活性に関連する上記の他の代謝物の役割については、さらに研究する必要がある。 |
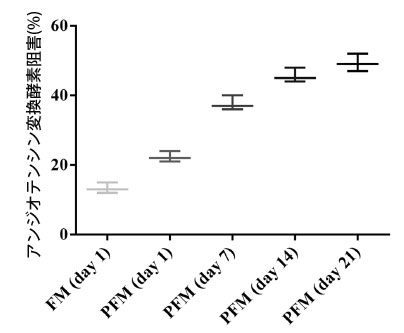 |
| 図4 4℃で21日間保存したFM(ヨーグルトスターターで作った発酵乳)およびPFM(ヨーグルトスターターとプロバイオティクスL. plantarum K25で作った発酵乳)サンプルのアンジオテンシン変換酵素阻害活性。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、J Microbiol Biotechnol. 2020 Jun 28; 30(6): 903–911.に掲載されたCharacterization and ACE Inhibitory Activity of Fermented Milk with Probiotic Lactobacillus plantarum K25 as Analyzed by GC-MS-Based Metabolomics Approach.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |