
Destynie Medeiros, et al., |
要約 |
| 認知障害に対する手頃で効果的な治療法がないため、神経変性の治療に対する代替アプローチの研究が促進されています。近年、腸と中枢神経系とのコミュニケーションを可能にする双方向経路が、腸-脳軸として認識されています。消化管に生息する数兆個の微生物の動的な集団である腸内細菌叢の変化は、アルツハイマー病 (AD) などの神経変性疾患を含むさまざまな病態に関係していると考えられています。しかし、アルツハイマー病における腸内細菌叢異常を是正するための手頃で利用しやすい補助療法としてのプロバイオティクス治療は、十分に研究されていません。ここでは、プロバイオティクスの補給によりアルツハイマー病マウスモデルの腸内細菌叢異常を是正し、病気の進行に対する効果を調査することを目指しました。トランスジェニック 3xTg-AD マウスに、対照群またはプロバイオティクス食 (Lactobacillus plantarum KY1032 および Lactobacillus curvatus HY7601) を 12 週間与えたところ、後者では Bacteroidetesの相対存在量が有意に増加しました。認知機能は バーンズ迷路試験で評価され、プロバイオティクス食を与えられたアルツハイマー病マウスで記憶力の改善が検出されました。10 か月齢の 3xTg-AD マウスの嗅内皮質と海馬の神経組織分析により、プロバイオティクス食を補給したアルツハイマー病マウスではアストロサイトとミクログリアの密度が減少し、プロバイオティクス食を与えられたメスのマウスでは変化がより顕著であることが示されました。さらに、プロバイオティクス食を与えられた 3xTg-AD マウスの海馬のニューロン数の増加は、プロバイオティクス補給によって神経保護が誘発されることを示唆しています。私たちの研究結果は、プロバイオティクスの補給が 3xTg-AD 動物モデルにおける神経変性の初期段階を遅らせたり緩和したりする効果があることを示唆しています。神経変性に対する緩和ケアの新たな可能性を探ることは極めて重要であり、プロバイオティクスの補給は アルツハイマー病に対する安価で簡単に実施できる補助的な臨床治療を提供できる可能性があります。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.材料と方法 |
| 2.1. 動物 |
| 2.2. プロバイオティクスの調製と投与 |
| 2.3. バーンズ迷路実験 |
| 2.4. 免疫組織化学 |
| 2.5. 組織データの定量化 |
| 2.6. マイクロバイオーム分析 |
| 2.6.1. PCR増幅 |
| 2.6.2. ライブラリの準備と MiSeq シーケンシング |
| 2.7. マイクロバイオームデータのバイオインフォマティクス処理 |
| 2.8. 統計分析 |
| 3.結果 |
| 3.1. プロバイオティクスの補給は記憶力を向上させる |
| 3.2. プロバイオティクスの補給は神経集団に影響を及ぼす |
| 3.3. プロバイオティクスは 3xTg-AD マウスのBacteroidetesの豊富さに影響する |
| 4.考察 |
| 本文 |
| 1.はじめに |
| 神経変性疾患は、神経組織に影響を及ぼし、最終的には認知機能の喪失につながる、ゆっくりと進行する不可逆的な疾患です。アルツハイマー病 (AD) は認知症の最も一般的な形態であり、空間ナビゲーション、記憶、認知の欠陥が進行するとともに、攻撃的な行動を含む性格の大きな変化を引き起こします (Knopman et al., 2021)。神経変性は、記憶形成に関与する領域 (嗅内皮質(訳者注:海馬と共に記憶に深く関わる脳領域)や海馬(訳者注:脳の中で記憶や学習に重要な役割を果たす部位)など) で発生し、皮質領域に広がり、アセチルコリンニューロンに影響を及ぼし、認知機能をますます低下させます (Ferreira-Vieira et al., 2016)。神経病理学的マーカーは、アミロイドβ(Aβ)タンパク質(プラーク)と過剰リン酸化タウ(神経原線維変化)の広範な凝集体で構成され、ニューロン間に広がり、シナプス損失、皮質萎縮、神経炎症の増加を引き起こします(Long and Holtzman、2019)。加齢はアルツハイマー病の主なリスク要因であり、世界の人口が高齢化するにつれて、効果的な治療法を発見する緊急性が高まっています。 |
| 現在、古典的な医薬品によるアルツハイマー病治療は効果がほとんどなく、神経伝達物質のシナプス利用能を高め、アミロイドβプラークを標的とすることに重点を置いています(Breijyeh and Karaman、2020)。しかし、炎症は脳の健康と神経変性に深く関係しており(Guzman-Martinez et al.、2019)、新しい治療法は神経炎症の抑制を通じて神経細胞の損傷を遅らせようとしています(Bronzuoli et al.、2016)。免疫系の炎症反応は、感染症と闘い、組織の損傷を修復するために不可欠です(Burda and Sofroniew、2014)。脳では、アストロサイト(訳者注:グリア細胞の一種であるアストロサイトは、神経細胞の形態と機能を支えるだけではなく、神経細胞の活動を主導的に制御する役割を果たす)やミクログリア(訳者注:グリア細胞の一種、主に中枢神経系の免疫を担っており、中枢神経系の中を移動しながらサイトカインの放出や異物・死細胞の貪食、シナプスの剪定などを行っています)などのグリア細胞が、ニューロンに足場と代謝サポートを提供し、有害なタンパク質や侵入微生物を貪食します(Aloisi、2001; Jäkel and Dimou、2017)。逆説的ですが、炎症は疾患の発症と進行を加速させる可能性があり (Liddelow et al., 2017; Sarlus and Heneka, 2017; Kwon and Koh, 2020)、脳内ではグリオーシス、つまりグリア細胞の活性化として現れます (Burda and Sofroniew, 2014; Frost and Li, 2017)。反応状態では、アストロサイトは肥大し、細胞間空間から アミロイドβプラークを除去しますが (Akiyama et al., 2000)、アミロイドβ負荷にも寄与します (Zhao et al., 2011)。ミクログリア細胞が慢性的に活性化すると、細胞はアメーバ状に再編成され、貪食機能に移行して炎症シグナルを放出し、シナプス刈り込みと神経炎症に寄与し、悪化させます (Lull and Block, 2010; Serrano-Pozo et al., 2013)。 |
| 腸内細菌叢(GM)は、消化管に生息する多数の微生物で構成されており、その構成は、年齢、食事、遺伝、環境などのさまざまな要因に依存します(Shreiner et al., 2015; Rinninella et al., 2019)。研究により、腸内細菌叢は宿主の健康にとって非常に重要であり、宿主の認知と複雑に関連していることがわかっています(Carabotti et al., 2015)。興味深いことに、不適切な食事と加齢は、腸内細菌叢異常(dysbiosis:腸内毒素症、腸内細菌叢の乱れ)、つまり腸内細菌叢の不均衡に寄与し、それが腸の炎症を引き起こし、全身の炎症を増強します。慢性炎症が低いと、加齢に伴う病状の中でも神経変性の一因となります(Ragonnaud and Biragyn, 2021)。いくつかの神経変性疾患は消化管合併症と関連しており(Vogt et al., 2017; Varesi et al., 2022)、パーキンソン病とアルツハイマー病の動物モデルに関する研究では、腸内細菌叢異常と神経変性の関係が強調されています(Sampson et al., 2016; Nair et al., 2018; Sun and Shen, 2018; Doifode et al., 2021)。神経疾患と腸内細菌叢異常を関連付ける最近の研究結果により、腸内細菌叢-脳軸が潜在的な治療標的であることが明らかになりました(Toledo et al., 2022)。 「腸-脳軸」という用語は、脳と腸の間の双方向のコミュニケーション経路(Doifode et al., 2021)を指し、その機能は細菌代謝物と神経調節分子に依存し(Yano et al., 2015)、神経系、内分泌系、免疫系が関与しています(Kowalski and Mula, 2019; Park and Kim, 2021)。たとえば、微生物は不安を調節する神経回路の発達と機能に影響を与え(Bravo et al., 2011; Heijtz et al., 2011)、神経伝達物質の生成を調節します(Yano et al., 2015)。さらに、腸内細菌叢の調節は酸化ストレス、酸化損傷 (Jones et al., 2012; Dumitrescu et al., 2018) に影響を及ぼし、神経炎症 (Park et al., 2020; Goyal et al., 2021) に影響を及ぼします。これらは神経変性と強く関連する 3 つの要因です。 |
| 研究によると、腸内細菌叢異常は、腸管上皮関門や血液脳関門の透過性を高めるなど、いくつかのメカニズムを介してアルツハイマー病の病理に寄与する可能性があり、直接的および間接的に全身性および神経性の炎症に寄与しています。腸管バリアが弱まると、細菌毒素や病原体が血流に入り、全身性炎症を引き起こします (Zhan et al., 2018)。さらに、Lactobacillus plantarum MB452 も腸管バリアの機能を高めることが示されています (Anderson et al., 2010)。腸内細菌叢異常は、血液-脳関門の透過性を高める可能性もあります。たとえば、腸内細菌による胆汁酸の代謝の変化は、認知障害と相関関係があり、血液-脳関門の破壊にも関連しています (Arora et al., 2020)。これらの弱体化したバリアにより、炎症性アゴニストが脳に移行し、ミクログリアが継続的に活性化され、続いて炎症性サイトカインが放出されます。Lactobacillus plantarum NCIMB 8826 などのプロバイオティクスは、抗酸化作用と抗炎症作用を持つ化合物であるフェルラ酸 (FA) を生成することが示されています (Westfall et al., 2017)。研究では、フェルラ酸がフリーラジカルを減らし、アミロイドβ の形成、沈着、成熟を減らす可能性があることが実証されています (Ono et al., 2005)。さらに、プロバイオティクスの補給により、アルツハイマー病トランスジェニックマウスモデルで SIRT1 (訳者注:サーチュイン遺伝子(Sirtuin)とは、老化や寿命の制御に重要な役割を果たすとされる遺伝子で、「長寿遺伝子」とも呼ばれている。SIRT1は血糖値を下げるインスリンの分泌を促し、糖や脂肪の代謝をよくしたり、神経細胞を守り記憶や行動を制御するなど、老化や寿命のコントロールに深く関与していると見られている)が増加し (Bonfili et al., 2018)、神経炎症が抑制されることが示されています (Chen et al., 2023)。 |
| 腸内細菌叢異常とアルツハイマー病の関係は確立されており (Zhang et al., 2017; Zhuang et al., 2018; Li et al., 2023)、腸内細菌叢の調節により脳内の アミロイドβ 負荷が減少し、ミクログリアの活性化が変化することが示されています (Minter et al., 2016, 2017; Harach et al., 2017; Dodiya et al., 2019; Kim et al., 2020)。ただし、神経変性疾患に対する有益な治療法としての 腸内細菌叢の直接調節については、さらなる調査が必要です。プロバイオティクス、プレバイオティクス、ポストバイオティクス、抗生物質治療、および糞便移植はすべて、腸内細菌叢の組成を変更する効果的な方法です (Ono et al., 2005)。プロバイオティクスという用語は、安全に摂取でき、宿主に健康上の利益をもたらす有益な微生物を指します (Fooks and Gibson, 2002)。単一株または複数株のプロバイオティクスによる介入が、アルツハイマー病動物モデルの認知障害および記憶障害にプラスの影響を与える可能性があることが示されています (Kobayashi et al., 2017; Nimgampalle and Kuna, 2017; Azm et al., 2018; Bonfili et al., 2018; Lee et al., 2019)。しかし、現在までに、アルツハイマー病患者の治療にプロバイオティクスを使用したランダム化試験は限られており (Naomi et al., 2021)、有益な効果を説明する細胞メカニズムは明らかにされていません。 |
| 本研究では、家族性アルツハイマー病に関連する変異PS1M146V、APPSwe、およびTauP301L(Oddo et al., 2003)を持つトランスジーンを有する3xTg-ADマウスモデルにおいて、プロバイオティクス投与がアルツハイマー病の進行に及ぼす影響を調査しました。本研究で使用したプロバイオティクス、Lactobacillus plantarum KY1032およびLactobacillus curvatus HY7601は、これまでにラットの加齢性記憶障害を改善すること(Jeong et al., 2015)、肥満マウスの炎症を軽減すること(Park et al., 2013)が示されており、最近では腸内細菌叢の調節による抗肥満効果の臨床試験で使用されています(Mo et al., 2022)。私たちは、同じ種類のプロバイオティクスが、腸管の変化によって神経炎症や神経細胞の喪失に影響を及ぼす可能性があり、アルツハイマー病マウスの記憶機能を改善するのではないかと仮説を立てました。私たちは、組織変性を遅らせるツールとしてプロバイオティクスを研究し、アルツハイマー病の簡単に利用できる補助療法としての応用を強化することを目指しました。 |
| 2.材料と方法 |
| 2.1. 動物 |
| この実験では、トリプルトランスジェニック 3xTg-AD (ストック番号 034830-JAX、ジャクソン研究所東、Bar Harbor, Maine) と野生型 B6129SF2/J 系統マウス (ストック番号 101045、ジャクソン研究所東) を使用しました。メスのマウスは 1 ケージあたり 3~4 匹のグループで飼育し、オスは 1 日 1 時間のプロバイオティクス治療を除き、1 ケージで飼育しました。プロバイオティクス治療のときは、各動物に同等のプロバイオティクス投与量を確保するために、すべての動物を別々のケージで飼育しました。食事と水は自由に摂取でき、12 時間明期/12 時間暗期のサイクルで飼育しました。各実験の開始時に、各グループに 5 匹のマウスを割り当てました。実験 1 では、野生型コントロール (WTC)、アルツハイマー病コントロール (ADC)、および アルツハイマー病プロバイオティクス (ADP) は、3~6.5 か月齢のオスおよびメスのマウス (n = 15、平均年齢 4.7 か月) で構成され、実験 2 では、オスおよびメスのマウスへのプロバイオティクスの補給は 7 か月齢から開始されました (n = 15)。3 つのグループ (WTC、ADC、ADP) の解析分散の粗自由度法に基づく推定適正サンプル サイズは 12 で、15 に増加されました。すべての実験は、国立衛生研究所の実験動物の管理および使用に関するガイドおよびハートフォード大学動物管理および使用委員会 (IACUC) によって記載されたガイドラインに厳密に従って実施されました。 |
| 2.2.プロバイオティクスの調製と投与 |
| プロバイオティクス菌株 Lactobacillus plantarum KY1032 および Lactobacillus curvatus HY7601 は、韓国のヤクルト韓社株式会社から入手しました。これらの菌株は、もともと韓国の伝統的な発酵キャベツであるキムチから分離されました (Chang et al., 2010)。プロバイオティクスは、同社の指示に従って -20°C で保存されました。プロバイオティクス菌株の生存率は、1 グラムあたりのコロニー形成単位 (CFU) で報告され、すべての菌株生存率データはヤクルト株式会社から提供されました。細菌は、菌株ごとに 5 × 1010 CFU/ml の濃度で滅菌 10 mM リン酸緩衝生理食塩水 (PBS)に懸濁されました。各プロバイオティクス治療では、個々のマウスにLactobacillus plantarum KY1032 1010 CFU とLactobacillus curvatus HY7601 1010 CFU を投与し、合計で 1 日あたり 2 × 1010 CFU のプロバイオティクスを投与しました。 |
| プロバイオティクス投与初日の前に、すべてのグループのマウスをプロバイオティクス投与の条件に慣れさせ、バニラウエハースクッキー0.75 gを摂取するように訓練しました。プロバイオティクス補給は、研究期間の12週間全体にわたってADPグループにバニラウエハースで毎日提供され、対照群(ADC、WTC)にはリン酸緩衝生理食塩水入りのバニラウエハースが提供されました。すべてのマウスが完全な用量を受け取り、消費したことを確認するために、ウエハース全体が消費されるまでマウスを一時的に個別のケージに分けました。ウエハースが消費されたことは視覚的に確認され、いずれの場合もウエハースは2分以内に消費されました。 |
| 2.3. バーンズ迷路実験 |
| バーンズ迷路 (BM) 実験は、プロバイオティクス補給の 7 週目に開始するトレーニング フェーズと実験フェーズで構成されました。トレーニング フェーズは、最初の記録された迷路試験の 1 週間前に行われ、3 日間連続で続き、1 日間の慣れと 2 日間のトレーニングで構成されました。1 日目には、迷路内の視覚的な手がかりや脱出室がない状態でマウスを バーンズ迷路環境に慣れさせました。各マウスを迷路の中央に配置し、2 分間迷路とやりとりさせました。2 日目には、迷路内の手がかりと脱出室がパラダイムに追加され、マウスは脱出室の位置を訓練されました。実験フェーズ中、すべてのマウスは毎週 1 回テストされ、各グループ内でランダム化されたテスト順序が毎週生成されました。迷路プラットフォームは、環境からの嗅覚刺激を除去するために、各試験の前に 70% エタノールで徹底的に殺菌されました。すべての行動テストは、天井に取り付けられたビデオカメラで録画され、後で分析できるようにデジタル形式で保存されました。 |
| 総脱出潜時は、マウスが4本の前足すべてを脱出チャンバーに入れるまで、または最大割り当て時間である120秒に達するまで、マウスと迷路との相互作用を計測することによって決定されました。エラーの総数を決定するために、研究者は、マウスが本当の脱出穴を発見するまで、偽の脱出穴への頭突きを手動で数えました。マウスの鼻が脱出穴の障壁を物理的に越えた場合、頭突きは有効であるとみなされました。毎週のバーンズ迷路トライアルごとに、各グループ(WTC、ADC、ADP、n = 5)の脱出潜時の平均と平均エラー率を決定して、週ごとのグループのパフォーマンスを表し、実験フェーズ全体のグループ平均を計算しました。 |
| 2.4. 免疫組織化学 |
| マウスは、ガーゼパッドに塗布した 50% イソフルラン 1.0 ml を使用してガラス瓶で麻酔し、つま先をつまんでも反応がなくなったら、0.9% 生理食塩水で経心灌流し、続いて 0.1 M リン酸緩衝生理食塩水中の 4% (v/v) パラホルムアルデヒド (PFA) で灌流しました。脳を摘出し、4% パラホルムアルデヒドで 48 時間 4°C で後固定した後、1% アジ化ナトリウムを添加した 30% スクロースに浸しました。脳は、クライオスタットを使用して 20 μm 冠状切片に、または Vibratome Series 1000 (TPI) 1,000 を使用して 50 μm 冠状切片に切断しました。海馬のCA1領域と嗅内皮質の層IVと層Vをカバーする、−0.82 mmから−4.5 mmのブレグマにわたる領域が収集されました。 |
| 切片(1染色あたり動物1匹あたりn = 2~3)を、室温でウシ血清アルブミン(BSA)を添加した1倍濃度PBS中で30分間ブロッキングし、抗体NeuN(Abcam [1:1000]、カタログ番号EPR12763)、GFAP(Immunostar [1:500]、カタログ番号22522)およびIba1(Wako [1:500]、カタログ番号S-2000)を使用して4°Cで一晩染色した。適切な二次抗体(Alexafluor [1:1000])を1倍濃度リン酸緩衝生理食塩水で希釈し、室温で2時間適用した。切片を4′,6-ジアミジノ-2-フェニルインドール(DAPI)で対比染色し、カバーガラスをかけて分析まで+4°Cで保存した。 |
| 2.5. 組織データの定量化 |
| 組織は Zeiss Axiostar Plus 顕微鏡を使用して観察され、画像は QCapture カメラ ソフトウェアと 12 ビット深度機能を備えた QImaging カメラを使用して撮影されました。すべての画像後処理と分析は、ImageJ オープンソース ソフトウェアを使用して行われました。両方の実験では、各グループのすべての動物 (n = 5) の各関心領域 (領域あたり n = 2~3 セクション) について、ImageJ のマルチポイント機能を使用して手動で細胞をカウントし (セクションあたり n = 3 フィールド)、各関心領域の絶対および相対集団を決定するために使用しました。染色手順中の技術的な問題により、セクションはデータ ポイントから除外されました。 |
| 2.6. マイクロバイオーム分析 |
| 実験中の 2 つの時点 (0 週目と 12 週目) で、各マウスから糞便サンプルを採取しました。プロバイオティクス治療前の 0 週目のサンプルを使用して、各グループの腸内微生物叢のベースライン評価を確立しました。糞便サンプルはマウスごとに別のチューブに保存し、採取後すぐに -80oC で保存しました。0 週目と 12 週目のサンプルから、DNeasy PowerSoil Pro キット (Qiagen) を使用して、製造元の指示に従って DNA を抽出しました。 |
| 2.6.1. PCR増幅 |
| 各サンプルについて、インデックス用のデュアルエンドアダプターを含む以前に検証されたプライマーを使用して、16S rRNA遺伝子のV4超可変領域の増幅を実施した(Nelson et al., 2014; Benjamino et al., 2018)。PCR反応は、3μlのBSA(New England Biosciences(NEB)、Ipswich、MA、USA)と41.7μlのPhusion 2× Master Mix(NEB)と2.5μlの10μMプライマーミックス(Illumina MiSeqアダプター付き515Fフォワードプライマーと806RリバースrRNA遺伝子V4プライマー)と30ngのサンプルDNAから成り、合計83.4μlの容量で調製した。正確性を確保するため、各サンプルは Bio-Rad C1000 Touch Thermocycler (Bio-Rad Laboratories Inc.、Hercules, CA, USA) を使用して、以下のサイクルパラメータで 3 回のアッセイを実施しました: 94°C で 3 分間の初期変性、続いて 94°C で 45 秒、50°C で 60 秒、72°C で 90 秒を 30 サイクル実行。最終伸長ステップは 72°C で 10 分間実行してプロセスを終了しました。 |
| 2.6.2. ライブラリの準備と MiSeq シーケンシング |
| 3 回の反応を組み合わせ、QIAxcel システム (Qiagen) で分析して、増幅産物のサイズを確認し、DNA 濃度を測定しました。その後、サンプルをプールして GeneRead Size Selection Kit (Qiagen、カタログ番号 180514) を使用して精製し、Illumina MiSeq 機器 (Illumina、San Diego, CA, USA) にロードする準備として約 4 nM に希釈しました。すべてのライブラリのペアエンド シーケンシングは、Illumina 500 サイクル MiSeq Reagent Kit v2 (Illumina、カタログ番号 MS-102-2003) を使用して実行しました。配列は、NCBI データベースでアクセッション番号 PRJNA1061566 で見つけることができます。 |
| 2.7. マイクロバイオームデータのバイオインフォマティクス処理 |
| Illumina MiSeq は 16S rRNA V4 遺伝子配列データを生成し、BaseSpace1 を使用してデマルチプレックス化しました。その後、ペアエンドデータは QIIME 2 (バージョン 2018.82) にインポートされ、さらに分析されました (Testerman et al., 2022)。リードは、DADA2 ノイズ除去ペアプラグイン (Callahan et al., 2016) を使用してフィルタリング、ノイズ除去、および複製解除されました。分類分類と配列のコンパイルは、feature-classifier (Bokulich et al., 2018) および taxa3 プラグインを使用して実行されました。分類の割り当てには、GreenGenes 13_8 99% OTU データベースに基づく事前トレーニング済みの Naïve Bayes 分類器が使用され、リードは 515F/806R プライマーペアで区切られた領域のみを含むようにトリミングされました。特定の対象分類群の読み取り数は、CSV ダウンロード機能を使用して QIIME 2 の棒グラフ視覚化から取得されました。特に指定がない限り、ワークフロー全体で QIIME 2 のデフォルトの処理パラメータが採用されました。ASV 数、分類情報、系統樹は、qiime2R パッケージ (バージョン 0.99.6) (Bisanz、2018) を使用して QIIME 2 から RStudio (バージョン 2022.07.02) (R Core Team、2017) にインポートされました。その後、Phyloseq(バージョン1.36.0)(McMurdie and Holmes、2013)、ggplot2(バージョン3.3.6)(Wickham、2016)、microViz(バージョン0.7.6)(Barnett、2021)、およびANCOM-BC(バイアス補正によるマイクロバイオームの構成分析)(バージョン1.2.0)(Lin and Peddada、2020)が、アルファ多様性とベータ多様性の計算、棒グラフ、箱ひげ図、順位付けの視覚化の生成に使用されました。統計テストは主にveganパッケージ(バージョン2.6–2、Oksanen、2020)を使用して実施されました。コマンドとパラメータの詳細な概要については、GitHubリポジトリ(https://github.com/joerggraflab/Code-for-Medeiros-2023)を参照してください。 |
| 2.8. 統計分析 |
| すべての行動および組織の統計分析とグラフは、Prism ソフトウェア (GraphPad Software、USA) を使用して作成されました。行動テストの場合、データは 95% 信頼区間で計算された平均 ± 標準偏差 (SD) として表示されます。グループ間の脱出潜伏時間とエラー率の差を比較するために一元配置分散分析が実行され、有意差が見つかった場合は Tukey 事後検定が行われました。秒単位で報告された脱出潜伏時間は、すべての迷路試験 (n = 20) にわたって各グループ (WTC、ADC、ADP) の平均脱出潜伏時間として計算されました。7 週目の脱出潜伏時間と頭突きの結果は、グループ試験の 1 つで技術的な問題が発生したため破棄されました。頭突きの数として報告されたエラー試行の平均合計数は、すべての迷路試験 (n = 20) にわたって各グループ (WTC、ADC、ADP) で計算されました。有意差が見つかった場合はTukey多重比較検定を実施し、以下のように報告しました:**p < 0.01、****p < 0.0001。 |
| 組織分析では、データは平均値±平均値の標準誤差(SEM)として提示されています。相対的な集団統計分析のために、グループ間の差を測定するためにノンパラメトリック検定(Kruskal–Wallis および Mann–Whitney)が実行されました。各染色について、切片あたり(切片あたり n = 3 フィールド)の平均値、動物あたり(動物あたり n = 2~3 切片)が計算され、グループ間で平均値が比較されました(ADC 対 ADP、n = 5)。地域特異性と性別を分析する際、分析したパラメータに適合する各グループのすべての切片がプールされ、グループあたりの平均値が計算されました。有意差が見つかった場合は、次のように報告されました:*p < 0.05、**p < 0.01。 |
| マイクロバイオームデータについては、各グループの分布の正規性を評価するためにシャピロ・ウィルク正規性検定が使用され、3 つのグループ (ベースライン、コントロール、プロバイオティクス) 間の有意差を評価するために t 検定が使用されました。多重比較を考慮するために、すべての p 値にボンフェローニ補正が適用されました。 |
| 3.結果 |
| 本研究の目的は、アルツハイマー病病態における神経変性および軽度認知障害の進行を抑制するための早期補助療法としてのプロバイオティクスの有効性を評価することであった。 |
| 3.1. プロバイオティクスの補給は記憶力を向上させる |
| 私たちは、マウスのアルツハイマー病モデルである 3xTg-AD マウス系統 (PS1M146VA、PPSwe、TauP301L) において、Lactobacillus curvatus HY7601 と Lactobacillus plantarum KY1032 を毎日投与した場合の空間学習と記憶に対する効果を評価しました。アルツハイマー病マウスは 12 週間毎日プロバイオティクス (ADP) または媒体 (ADC) を投与され、7 週目から毎週 Barnes Maze (BM) を使用してテストされました。マイクロバイオームの構成の変化は健康な個体でも行動に影響を与える可能性があるため、バーンズ迷路での比較には未治療の野生型マウス (WTC) のみを使用しました。これらの試験を通じて、全体的な逃避潜時は ADC で最も高く、これらのマウスの空間記憶力が低いことが示されました (図 1A)。 WTCマウスの平均逃避潜時が最も短く(27.25 ± 17.24 s)、次いでADPマウス(52.05 ± 37.05 s)であったのに対し、ADCマウスの平均逃避潜時が全グループの中で最も長かった(86.80 ± 42.91 s)。3つの条件において、p < 0.0001レベルで認知能力に対するグループの有意な影響があった[F(2,57) = 15.29, p < 0.0001]。Tukey HSD検定を用いた事後比較では、WTCグループはADCグループ(p < 0.0001)より有意に優れていたが、ADPグループ(p = 0.0650)ではそうではなかった。一方、ADPグループはADCと比較して有意に速いパフォーマンスを示した(p = 0.0060)ことから、プロバイオティクス治療による有益な認知効果が示唆された。 |
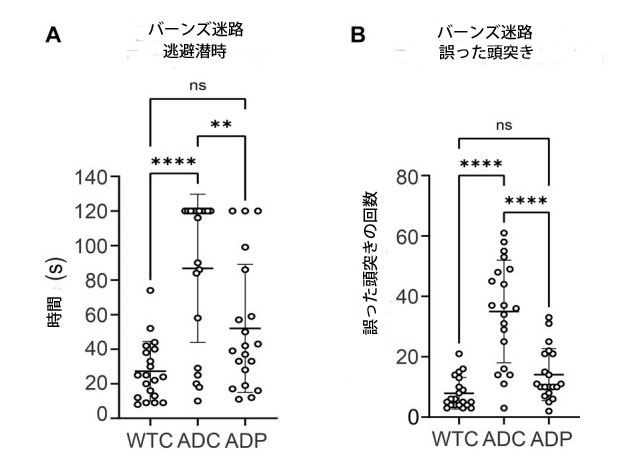 |
図 1 プロバイオティクスを投与された 3xTg マウスでは、空間認識力と記憶力が改善しました。 WTC:野生型コントロール、ADC:アルツハイマー病コントロール、ADP:アルツハイマー病プロバイオティクス、 各データ ポイントは、1 回の試験から得た個々のマウスを表します。 各グループは、逃避潜時と頭突きについて、それぞれグループあたり各動物 (n = 5) の 4 週間の試験で表されます。 (A) 全体の逃避潜時は、すべての迷路試験における各グループの平均逃避潜時 ± SD を表します。データは、各グループの平均潜時として秒単位で報告されています。 (B)頭突きの数は、すべての迷路試験における各グループの誤った試行の平均合計数 ± SD を表します。 グループ間の統計的に有意な差は、Tukey の多重比較事後検定を使用して、95% 信頼区間で一元配置分散分析によって分析されました。**p < 0.01、****p < 0.0001。 |
| さらに、ADCマウスは、WTCマウス(7.90 ± 5.24)およびADPマウス(14.10 ± 8.60)と比較して、頭突きの回数が多く(35 ± 16.98)、迷路からの脱出を誤って試みた回数が多いことを示しました(図1B)。緊張は記憶力に有意な影響を及ぼしました(p < 0.0001)[F(2,57) = 31.03、p < 0.0001]。WTCマウスは、ADCよりも平均誤った試みが有意に低かった(p < 0.0001)が、ADPとは比較できませんでした(p = 0.2067)。一方、ADPマウスは、ADCマウスと比較して誤った試みが有意に少なかった(p < 0.0001)(図1B)。 |
| 3.2. プロバイオティクスの補給は神経集団に影響を及ぼす |
| プロバイオティクス治療後に観察された行動改善が脳環境の改善に関連しているかどうかを判断するために、3 つのマウス グループの脳組織を分析しました。空間ナビゲーションは嗅内皮質 (EC) に関連しており、アルツハイマー病拡散の出発点であると考えられています (Igarashi、2023)。そのため、ADC マウスと ADP マウスの神経細胞とグリア細胞集団を免疫組織化学法で評価し、WTC マウスと比較しました。 |
| ニューロン集団を調べるために、嗅内皮質組織、特に皮質層4と5のNeuN +細胞と全細胞(DAPI +)を染色しました(図2A)。嗅内皮質のNeuN +細胞(NeuN + / DAPI +)の割合は、WTCマウス(66.67 ± 13.65%)、ADCマウス(69.04 ± 4.76%)、およびADPマウス(85.55 ± 6.25%)間で変化しませんでした(図2B)。 |
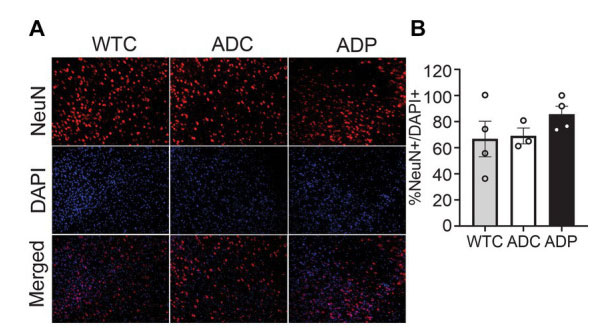 |
図 2 プロバイオティクスによる治療後、皮質ニューロン集団に変化なし。 WTC:野生型コントロール、ADC:アルツハイマー病コントロール、ADP:アルツハイマー病プロバイオティクス、 (A) 7 か月齢の嗅内皮質の層 4/5 における代表的な免疫蛍光染色。ニューロンのタグ付けには NeuN+ 抗体を使用し (上段パネル)、総細胞を検出するには DAPI 核染色を使用 (中段パネル)。合成画像は下段パネルに表示。 (B) 嗅内皮質の層 4/5 では、WTC、ADC、ADP で治療したマウスのニューロンの相対数 (NeuN+/DAPI+) に有意差はありません。 各データ ポイントは、5 匹の動物からなる各グループで染色された切片あたりの総細胞数に対するニューロンの平均 (切片あたり n = 3 フィールド) パーセンテージを表します。データは各グループの平均パーセンテージ ± SEM として報告され、Kruskal–Wallis 検定によって分析されました。 |
| 皮質アストロサイト集団は、嗅内皮質サブフィールドの GFAP+(訳者注:グリア原線維性酸性タンパク質は、ヒトの GFAP 遺伝子によってコードされるタンパク質、アストロサイトの形態を確立して維持し、有糸分裂だけでなくニューロン-アストロサイト間の連絡にも重要です)細胞と全細胞を染色することによって調査されました (図 3A)。嗅内皮質に存在するアストロサイトの割合は、WTC (7.89 ± 1.87%、p = 0.018) と比較して ADC (18.26 ± 4.25%) で有意に増加しており、これは アルツハイマー病マウスの炎症反応の高まりを示している可能性があります。興味深いことに、ADP マウスは ADC と比較して GFAP+ 細胞の割合が減少し (9.94 ± 3.19%)、WTC マウスと同等の結果を示しました (図 3B)。 |
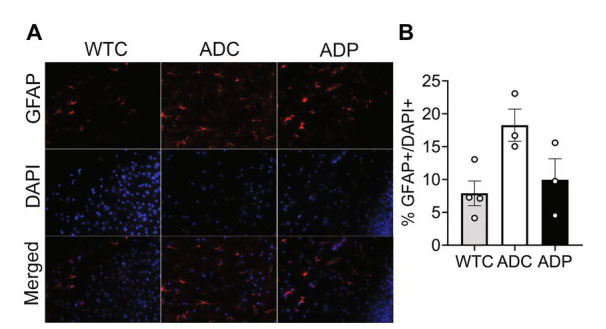 |
図 3 プロバイオティクス治療は、アルツハイマー病マウスの皮質アストロサイト集団に影響を与えました。 WTC:野生型コントロール、ADC:アルツハイマー病コントロール、ADP:アルツハイマー病プロバイオティクス、 (A) 10 か月齢の嗅内皮質の層 4/5 における代表的な免疫蛍光染色。GFAP 抗体を使用してアストロサイトをタグ付けし (上のパネル)、DAPI 核染色を使用して総細胞を検出しました (中央のパネル)。下のパネルに、結合した画像を示します。 (B) ADC マウスの嗅内皮質には WTC マウスと比較して高い割合のアストロサイトが存在しましたが、ADP % アストロサイトは WTC マウスと同等でした。 各データ ポイントは、5 匹の動物からなる各グループで染色された切片あたりの総細胞に対する GFAP の平均 (n = 3 フィールド/切片) 割合を表します。データは各グループの平均割合 ± SEM として報告され、Kruskal–Wallis 検定によって分析されました。 |
| 分析を進めるために、7ヶ月齢のアルツハイマー病マウスの第2コホートにプロバイオティクスまたは媒体を12週間投与し、再び嗅内皮質と海馬CA1領域の神経集団を調べました。私たちの関心は、病気の進行を遅らせるツールとしてのプロバイオティクスにあるため、組織分析は治療済みおよび未治療のアルツハイマー病マウスのみに焦点を当てました。第1コホートと同様に、皮質ニューロンの割合はADCマウスとADPマウスで同様でしたが(図4A)、皮質アストロサイト(GFAP +)は、10ヶ月齢のADPマウスではADCと比較して減少しました(差3.07%、p = 0.044、図4B)。 |
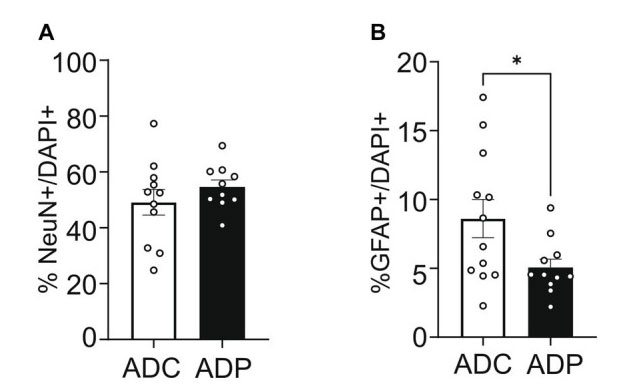 |
図 4 プロバイオティクス治療は、アルツハイマー病マウスの皮質アストロサイトのみを変化させました。 ADC:アルツハイマー病コントロール、ADP:アルツハイマー病プロバイオティクス、 各データ ポイントは、染色された切片あたりにカウントされた全細胞のうちのニューロンまたはアストロサイトの平均パーセンテージ (n = 3 フィールド/切片) を表します。各マウス (n = 5/群) について、2~3 の切片が染色され、1 群 (n = 10~12) あたりにまとめられました。 (A) ADC と ADP では皮質ニューロン (NeuN+) に変化は見られませんでしたが、(B) 12 週間のプロバイオティクス ダイエットを与えられた 10 か月齢の ADP マウスの嗅内皮質では、ADC マウスと比較してアストロサイト (GFAP+) の有意な減少が見られました。 データは、1 群あたりの平均パーセンテージ ± SEM として報告され、Mann–Whitney 検定によって分析されました。*p < 0.05。 |
| 病気は嗅内皮質から海馬に広がるため、私たちは海馬神経集団に対するプロバイオティクス治療の効果を評価したいと考えました。海馬は拡張した構造であり、病気の進行中に前部と後部の海馬サブフィールドは異なる影響を受ける可能性があります(Maruszack and Thuret、2014)。そのため、Bregma -2.0を基準マークとして使用して、前部と後部の海馬の神経集団を分析しました。前部海馬(Bregma -2.00~-1.01 mm)では、ADCマウス(16.85 ± 2.57%、p = 0.007)と比較して、ADPマウス(37.43 ± 5.66%)で有意に高いNeuN +細胞数(図5A)が観察されました。減少傾向にあるものの、2 つのグループ間でグリア細胞集団 (GFAP+ および Iba1+) の割合に有意な変化は観察されませんでした。図 5B に示すように、後部海馬 (-2.01 ~ -3.0 mm ブレグマ) における陽性ニューロン (NeuN+) の割合に ADC と ADP の間に差は観察されませんでした (22.08 ± 5.73% 対 28.77 ± 6.35%)。同様に、アストロサイト (GFAP+、32.57 ± 2.62% 対 27.26 ± 2.30%) およびミクログリア細胞 (Iba1+、33.73 ± 6.66% 対 35.88 ± 4.16%) の割合も、未治療動物と治療動物の間で変化しませんでした (図 5B)。 |
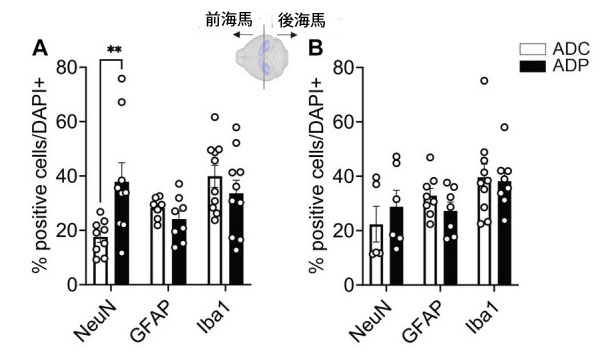 |
図 5 プロバイオティクス治療は、アルツハイマー病マウスの前海馬の神経細胞を保護しました。 ADC:アルツハイマー病コントロール、ADP:アルツハイマー病プロバイオティクス、 各データ ポイントは、各グループで染色された切片あたりの全細胞のうち陽性細胞の平均パーセンテージ (n = 3 フィールド/切片) を表します。各グループでは、5 匹のマウスを評価しました。ブレグマの位置に基づいて、結果は前部領域と後部領域に細分化されました (領域あたり n = 6~10)。ADC マウスと ADP マウスの (A) 前部海馬と (B) 後部海馬で、NeuN+、GFAP+、および Iba1+ 細胞をカウントしました。前部海馬では、ニューロンに有意差が見られましたが、グリアには有意差が見られませんでした。データは、グループあたりの平均パーセンテージ ± SEM として報告され、Mann–Whitney 検定によって分析されました。**p < 0.01。 |
| しかし、アルツハイマー病は主に女性に発症するため、私たちはプロバイオティクスが男女に及ぼす可能性のある異なる効果に興味がありました。さらに分析したところ、プロバイオティクス治療の影響はメスのマウスの方がオスのマウスよりも大きいことがわかりました。嗅内皮質では、GFAP+ 細胞の割合は ADC メスと比較して ADP メスで有意に低いままでした (差 3.69 ± 1.64%、p = 0.0296、データ未掲載)。重要なのは、前海馬 (図 6) ではメスが GFAP+ と Iba1+ 細胞集団で有意な差を示したことです。 ADP雌マウスでは、NeuN+/DAPI+の上昇(17.28 ± 2.30% vs. 31.41 ± 9.59%、p = 0.171)およびIba1+/DAPI+細胞数の有意な減少(43.49 ± 4.08% vs. 25.79 ± 4.83%、p = 0.043)が検出されました。さらに、ADCと比較してADPではGFAP+/DAPI+細胞数の減少が検出され(20.64 ± 2.44% vs. 29.23 ± 1.25%)、有意差(p = 0.019)をもたらしました。 |
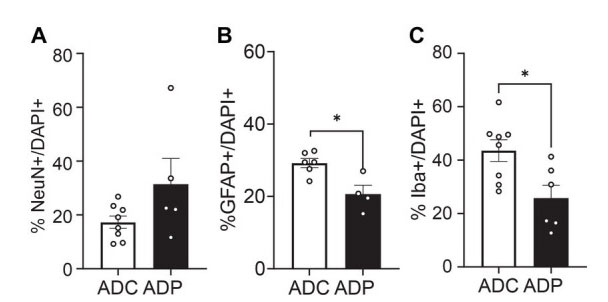 |
図 6 メスのマウスの神経細胞集団は、前部海馬におけるプロバイオティクス治療によって有意に影響を受けています。 ADC:アルツハイマー病コントロール、ADP:アルツハイマー病プロバイオティクス、 10 か月齢のメスのアルツハイマー病マウスで、(A) ニューロン (NeuN+)、(B) アストロサイト (GFAP+)、(C) ミクログリア (Iba1+) の割合を評価しました。各グループのメスの数が少ない (n = 3 ADP、n = 4 ADC) ため、各データ ポイントは 1 切片あたり 3 視野の平均カウントを表します。グループ内の各動物のすべての染色切片がグループに表されます。データはグループあたりの平均割合として報告され、Mann–Whitney 検定によって分析されました。*p < 0.05。 |
| 3.3. プロバイオティクスは 3xTg-AD マウスのBacteroidetesの豊富さに影響する |
| 次に、アルツハイマー病マウスにおけるプロバイオティクス治療の神経保護効果が腸内細菌叢の変化と相関しているかどうかを調べたいと考えました。そこで、プロバイオティクスで治療した アルツハイマー病マウスの腸内微生物組成の変化を評価するために、16S rRNA 遺伝子の V4 領域を介して糞便細菌叢を分析しました。16S rRNA 遺伝子の V4 領域を使用したため、Lactobacillus は属レベルまでしか分析できませんでした。プロバイオティクスを投与された アルツハイマー病マウスと アルツハイマー病対照群とで、ベータ多様性 (補足図 S1) またはアルファ多様性 (補足図 S2) に有意な差は見られませんでした。また、すべての分類レベル (門から属まで) でこれらのデータに対して ANCOM-BC テストを実行したときに、有意に増加した細菌群も見られませんでした。しかし、プロバイオティクス治療によって、腸内の2つの主要な門であるFirmicutes門とBacteroidetes門の1つに有意な変化が生じたことが観察されました。プロバイオティクスを投与してから12週間後のADPマウスでは、治療前と比較してBacteroidetes門の数が有意に増加しました(調整p = 0.046)(図7)。これらの変化は、未治療のアルツハイマー病マウスでは観察されませんでした(図7)。 |
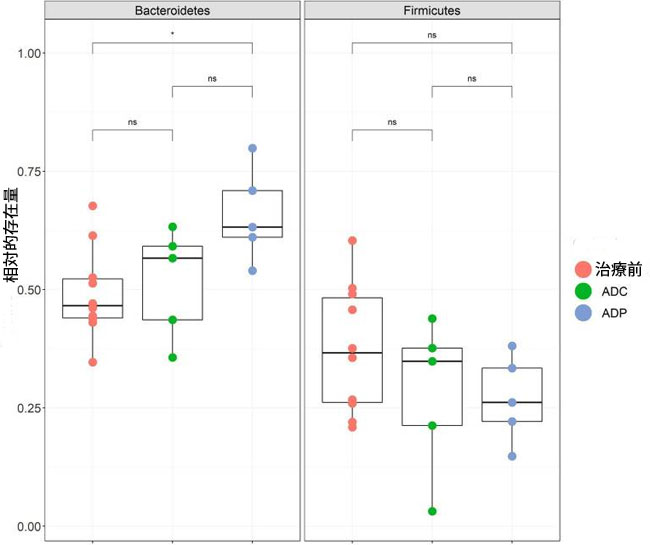 |
図 7 Bacteroidetes門とFirmicutes門の相対存在量のボックスプロット。 門レベルの相対存在量はグループ別にプロットされており、治療前(赤) は治療前 (0 週目) の 10 匹すべてのマウスのサンプル、コントロール (緑) はプロバイオティクス サプリメントを摂取しなかった 5 匹のマウス (12 週目)、プロバイオティクス治療を受けたプロバイオティクス (青) グループ (12 週目) を示しています。治療前サンプルとプロバイオティクス サンプルを比較すると、Bacteroidetes門の存在量に有意差が見られました (p < 0.05)。ボックス プロットは Tukey スタイルで示されています。これらのサンプルの最小シーケンス深度は 14,112 リードでした。 |
| 4.考察 |
| 過去 10 年間、腸内細菌叢が人間の健康に果たす役割に関する研究が活発化しており、特に脳の健康に重点が置かれています (Shreiner et al.,2015 年、Rinninella et al.,2019 年)。今回の研究では、3xTg-AD マウスの食事に 2 種類の乳酸菌株を補給し、アルツハイマー病疾患の進行に対するその効果を評価しました。微生物多様性の減少、特定の属の有無、および2つの主要な門であるFirmicutes門とBacteroidetes門の相対的存在量の変化という形での腸内細菌叢の乱れは、臨床研究および前臨床研究においてアルツハイマー病病理の悪化と関連付けられています(Brandscheid et al., 2017; Harach et al., 2017; Vogt et al., 2017; Zhuang et al., 2018; Sun et al., 2019; Chen et al., 2020; Hung et al., 2022)。抗生物質治療、糞便微生物移植、およびプロバイオティクス治療による腸内細菌叢の乱れを是正する取り組みは、アルツハイマー病病理を軽減することが示されています(Minter et al., 2016; Bonfili et al., 2017; Sun et al., 2019)。ここでは、プロバイオティクスを投与されたアルツハイマー病マウスとアルツハイマー病マウス対照群とで微生物の多様性や属レベルの相対的存在量に有意な差は見られませんでしたが、これは本研究のサンプルサイズが比較的小さいことが原因である可能性があります。しかし、 Lactobacillusを投与された生後10ヶ月のアルツハイマー病マウスでは、Bacteroidetes門の存在量の有意な増加が検出されました。Firmicutes門とBacteroidetes門の比率は腸内細菌叢異常の指標として使用されており、その変動はアルツハイマー病以外にも、ヒトの肥満や炎症性腸疾患などの疾患と相関していることがよくあります。Firmicutes門/Bacteroidetes門の比率の減少またはBacteroidetes門の増加は、幼若げっ歯類の健康改善と相関していました(Stojanov et al.、2020)。それでも、個人間で「健康的」とされる Firmicutes と Bacteroidetes の比率には大きなばらつきがあり、比率は時間の経過とともに変化する可能性があります (Duncan et al., 2008; Mariat et al., 2009; Huttenhower et al., 2012)。アルツハイマー病マウス モデルでは、Firmicutes と Bacteroidetes の相対的な存在量も時間の経過とともに変化する可能性があることが明らかになっています (Brandscheid et al., 2017; Harach et al., 2017)。多数の研究でアルツハイマー病マウスモデルの腸内微生物組成が調査され、アルツハイマー病と野生型マウスを比較すると門レベルでさまざまな結果が報告されています。これらの研究では、野生型の対照群と比較した場合、BacteroidetesおよびFirmicutesのレベルの両方で一貫性のない変化が報告されており、特定の分類群ではなく、腸内細菌叢の一般的な混乱がアルツハイマー病病理に寄与していることを示唆しています(van Olst et al.、2021)。さまざまな外因性(例:食事)および内因性(例:遺伝的背景、性別、年齢)要因がこれらの研究間の矛盾を説明する可能性があり、門比が脳の健康に与える影響を解明するにはさらなる研究が必要になるでしょう。 |
| ここでは、3xTg-ADマウスは、12週間のプロバイオティクス治療後に記憶力に観察された肯定的な効果によって実証されるように、Bacteroidetesの増加から恩恵を受けました。通常の食事を与えられたアルツハイマー病マウスは健康なマウスと比較して記憶力が低下しましたが、プロバイオティクス治療はアルツハイマー病マウスがバーンズ迷路でスピードと正確性を回復するのに役立ちました(図1)。興味深いことに、Lactobacillus plantarum KY1032は以前、年齢依存性ラットモデルで空間記憶を強化することが示されており(Jeong et al.、2015)、これは現在の研究で得られた認知データと一致しています。さらに、L. curvatus HY7601とL. plantarum KY1032は、高脂肪食を与えられたマウス(Choi et al.、2016)と肥満のヒト(Mo et al.、2022)に対する潜在的な利点を評価するために使用されました。 L. curvatus HY7601 と L. plantarum KY1032 を摂取したグループは、体重増加を最小限に抑えただけでなく、認知能力や神経炎症制御(炎症誘発性サイトカインや活性化ミクログリアなど)に関連する代謝調節因子である血中アディポネクチンのレベルが有意に上昇しました(Polito et al., 2020)。追加の研究を行う必要があるものの、L. plantarum KY1032 と L. curvatus HY7601 が 腸内細菌叢を調節し、潜在的にアディポネクチン レベルの上昇につながり、その後の有益な認知効果が ADP グループで観察されたのではないかと推測するのは興味深いことです。代謝障害と認知機能低下の重要な相互作用を考えると、両方の症状に有益な食事介入は非常に貴重です(Kouvari et al., 2022)。 |
| 現在の組織分析によって裏付けられた私たちの仮説は、Lactobacilliによって誘発される腸内細菌叢の変化が、おそらく局所的に減少したアストロサイトやミクログリアによって分泌される循環炎症誘発マーカーの調整を介して、脳に影響を及ぼすというものです。神経炎症を抑えるとニューロン集団にプラスの影響を与え (Chitnis and Weiner, 2017; Kaur et al., 2019; Huffels et al., 2022)、より健康なニューロン経路 (嗅内皮質-海馬など) をもたらし、その後記憶力が向上することは十分に立証されています。私たちの研究では、通常の食事を与えられた3xTg-ADマウスは、嗅内皮質 (図3、4) と海馬 (図6) の両方でグリア細胞数が一貫して増加しており、過形成と反応性グリオーシスの初期段階を示唆しています。プロバイオティクスの補給により、嗅内皮質のアストロサイトが大幅に減少し、有意ではないものの、ADC マウスの前部海馬のミクログリア数も変化しました (図 5A)。これらの結果は、反応性グリオーシスが 嗅内皮質で始まり、海馬に広がり、プロバイオティクスの補給によって調整できるという考えを裏付けています。グリアの反応性を減らすことで、プロバイオティクスはニューロン死のプロセスを変えることができます。実際、ADP では ADC と比較してグリア数が減少したため、10 か月齢の 3xTg-ADP マウスの前部海馬の CA1/CA2 サブフィールドのニューロンがより豊富でした (図 5A)。AD マウスの 2 つのコホートは同様の結果を示しましたが、各実験のグループのサイズが限られていたため、ここで行った比較の一部の感度が制限された可能性があります。ミクログリアとアストロサイトの構造変化を特徴付けて反応状態を確認し、これらの結果を拡張することが重要になります。 |
| 驚くべきことに、これらの影響は性別に依存して悪化し、ミクログリア症と神経萎縮の減少は ADP メスの海馬でより顕著でした。興味深いことに、メスの 3xTgAD マウスはオスよりも神経炎症の影響を受けやすく、認知機能低下の症例がより多く報告されています。以前の研究では、炎症を高める高脂肪食を与えられたメスはオスよりも空間記憶と獲得記憶の障害を示すことが実証されています (Clinton ら、2007 年、Blázquez ら、2014 年、Gannon ら、2022 年)。証拠によれば、微生物叢の構成には性別による違いがあり (Elderman et al., 2018)、それが免疫反応にも影響を及ぼす可能性があり (Markle et al., 2013; Fischinger et al., 2019)、腸内微生物叢の変化は老化の過程で顕著に現れる (Falony et al., 2016; DeJong et al., 2020) ことが示唆されています。実際、最近の研究では、微生物叢とサイトカインのプロファイルは性別に依存して老化の影響を受けることが実証されています (Webster et al., 2022)。性別、年齢、免疫、腸内微生物構成の相互関係を考えると、本研究の高齢のメスマウスはグリア反応が悪化しており (ADC グループ)、プロバイオティクスによる腸内構成の変化 (ADP グループ) に対してより反応しやすいと考えられます。さらに、3xTg-AD のメスマウスはオスマウスよりも アミロイドβ の負荷が高いことを示唆する研究もあるが (Carroll et al., 2010; Hu et al., 2023)、そうでない研究もある (Clinton et al., 2007)。アミロイドβ 負荷は炎症と関連付けられており、その結果、ADC のメスマウスでは反応性神経膠症が増加すると考えられる。アルツハイマー病マウスの海馬で細胞内 アミロイドβ 蓄積を検出したが、予備的な結果ではプロバイオティクス補給による アミロイドβ 負荷への有益な効果は観察されなかった (データ未掲載)。ただし、組織分析は 4~6 ヶ月齢ではなく 10 ヶ月齢で実施しており (Hu et al., 2023)、このマウスモデルにおける アミロイドβ 沈着の初期段階であり、海馬組織のみを対象としており、皮質領域は対象としていない (Carroll et al., 2010)。したがって、ADP マウスでは 10 か月齢までに毒性タンパク質凝集体が臨界蓄積点を超え、その変化は検出されなかったと考えられます。コホート内のオスマウスの数が限られているため、性別を直接比較することはできませんでした。しかし、プロバイオティクスがメスや病気の進行段階が進んだマウスでより効果的であるという推測を裏付けるには、両性の循環炎症マーカーの状態を確認することが重要になります。 |
| 神経変性疾患が高齢化社会にますます影響を及ぼすようになるにつれ、症状を緩和し患者の生活を改善する治療法の特定が重要になります。私たちの現在の研究では、プロバイオティクスの補給が局所グリア細胞集団に作用し、ニューロンの萎縮を防ぐことで、アルツハイマー病に関連する神経病理と認知機能低下を軽減できることが実証されています。アルツハイマー病の従来の薬物治療と比較すると、プロバイオティクス療法は安価で実施しやすく、有害な副作用も抑えられます。性別に依存する結果を考えると、個人や性別にわたる腸内細菌叢の多様性により、最適な個別化治療が可能になることを強調することが重要です。FDAに承認されているプロバイオティクスはごくわずかであり(Bhadoria and Mahapatra、2011)、アルツハイマー病の治療薬または予防薬として承認されているものはありません(Ayichew et al.、2017)。興味深いことに、本研究で使用した 2 つのプロバイオティクスは、肥満に関連する腸内細菌叢の異常を治療するための臨床試験で最近使用されたものです (Mo et al., 2022)。さまざまなプロバイオティクス株の潜在的な影響を調べた研究は数多くあり、そのいくつかはさまざまな組み合わせやさまざまな用量で使用されています。マイクロバイオームは人それぞれ異なるため、有効性を最大化し、潜在的な有害な結果を制限するには、個人に合わせた処方が必要になる場合があります。ただし、治療薬として使用する前にプロバイオティクスの最適な構成 (株や用量など) を確保するには、腸内細菌叢と アルツハイマー病病理を結び付ける分子メカニズムを解明するためのさらなる研究が必要です。腸内細菌叢の探索は アルツハイマー病の新しい治療法につながるため、私たちの研究は、シンプルな食事ベースの介入が緩和神経変性療法の実行可能な治療オプションを提供できることを示すことを目指しています。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Front Neurosci. 2024; 18: 1309075.に掲載されたSlowing Alzheimer's disease progression through probiotic supplementation.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |