
Oana Budu , Alexandra Mioc et al., |
要約 |
| 過去 10 年間に医療および健康研究の分野で顕著な進歩が見られたにもかかわらず、がんは依然として世界中で死亡率の大きな原因となっています。さらに、この病気と闘うために採用されている従来の治療法は、その重篤な副作用のために患者の生活の質を著しく損なうことが判明しています。最近の in vitro 研究では、抗がん療法の補助剤として、さらにはさまざまなタイプの悪性腫瘍の予防および治療の可能性のある薬剤として、プロバイオティクスの潜在的な有益な効果に関する有望な知見が明らかになりました。この観点から、本研究の主な目的は、Lactiplantibacillus plantarumの抗がん特性を調査し、その根本的な作用機序を解明することでした。この問題を調査するために、黒色腫細胞株および乳がん細胞株に関連して、Lactiplantibacillus plantarumのいくつかの用量 (105 ~ 1010 CFU/mL の範囲) を調べました。形態学的調査とアネキシン V/PI アッセイによって実証された細胞生存率の調査結果から、Lactiplantibacillus plantarumは細胞活動に阻害効果を発揮し、アポトーシスを誘発することが示されました。さらに、そのメカニズムをさらに調査したところ、アポトーシス アッセイとウェスタン ブロット分析により、Lactiplantibacillus plantarumの投与によってプロアポトーシス BAX タンパク質レベルの上昇と、切断ポリ ADP リボース ポリメラーゼ (PARP) タンパク質発現の上方制御が起こることが観察されました。逆に、抗アポトーシス Bcl-2 タンパク質のレベルは、黒色腫細胞株および 乳がん細胞株で減少することがわかりました。これらの調査結果は、これらの特定の細胞株における Lactiplantibacillus plantarumのプロアポトーシス作用メカニズムに関する洞察を提供します。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. 細菌と細胞株 |
| 2.2. 細胞生存率評価 |
| 2.3. クロマチン凝縮 |
| 2.4. アネキシンV-FITC/ヨウ化プロピジウム(PI)染色 |
| 2.5. BAX および Bcl-2 の検出 |
| 2.6. ウェスタンブロット |
| 2.7. 統計分析 |
| 3. 結果 |
| 3.1. Lactiplantibacillus plantarum細胞毒性活性の評価 |
| 3.2. 免疫蛍光染色によるアポトーシスの特徴の評価 |
| 3.3. アネキシン V/PI 分析 |
| 3.4. アポトーシスアッセイ - BAX および Bcl-2 タンパク質レベルに対するLactiplantibacillus plantarumの効果 |
| 3.5. ウエスタンブロット分析 |
| 4. 考察 |
| 5. 結論 |
| 本文 |
| 1.はじめに |
| プロバイオティクスは、重大な副作用を誘発することなく、がんなどの重篤な慢性疾患の予防と治療をサポートする有益な効果により、医学的に重要な薬剤として認識されています [1]。乳酸菌を豊富に含む食事と大腸がんの発生率低下との直接的な関係は 1980 年代に報告され、大腸環境の物理化学的パラメータの維持、したがって恒常性、および発がん性化合物を生成することが知られている腐敗細菌との種間競争など、いくつかのメカニズムが仮説として立てられました [2]。臨床現場で効果的なプロバイオティクス株が発見されれば、生活の質の低下の原因となる重大な副作用があり、薬剤耐性を生み出す抗がん剤の補助治療を提供できる可能性があります。 |
| プロバイオティクスは、十分な量を投与すると宿主に健康上の利益をもたらすことができる、病原性を持たず生きた微生物と定義されます [3]。通常、細菌株と酵母に分類されます。Lactobacillus spp.などの乳酸生成細菌は、食品産業、特に発酵乳製品で長年使用されており、最終的な品質と保存性を向上させるとともに、安全に使用できることが国際的に認められています [4]。その健康上の利益は、宿主との相互作用の結果としての直接的なプロバイオティクス効果、または発酵代謝物を介した間接的な生体効果によるものです。Lactobacillus spp.は、代謝および酵素プロセスに大きな影響を与えるヒトの腸内細菌叢の一部であり、正常な消化だけでなく免疫システムの適切な機能にも不可欠です [5]。最も明らかな有益な効果は胃腸レベルで見られ、乳酸菌は前がん病変 [6] とがん病変 [7] の両方を著しく抑制し、潰瘍性大腸炎 [8] などの炎症性病変に対する保護効果を発揮します。これらの発見は、短鎖脂肪酸や細胞外タンパク質などのプロバイオティクスの代謝物によるいくつかのシグナル伝達経路の活性化を介して誘導される免疫調節効果を強調することを伴い、その結果、腫瘍プロセスに関連する遺伝子の阻害が起こります [9]。 |
| 乳がん細胞では、プロバイオティクスは腸内細菌と免疫系に対する調節作用があるため、予防または治療に使用できる可能性がある[10]。Lactiplantibacillus plantarum 5BLは、健康な細胞を傷つけずに乳がん細胞の増殖に直接作用することも示されている[10]。 |
| Aspergillus oryzae などのヘプテリジン酸生成プロバイオティクスは、B16F10 黒色腫細胞中のグリセルアルデヒド-3-リン酸デヒドロゲナーゼの酵素活性を阻害する能力があり、用量依存的にその増殖を阻害します。Lactiplantibacillus plantarumから抽出されたリポテコ酸は、用量依存的にチロシナーゼ酵素の活性と発現を低下させることで、B16F10 細胞におけるメラニン形成を阻害することができました [11]。L. reuteri によって合成されたトリプトファン分解産物 I3A は黒色腫内で転座して持続することができ、CD8 細胞の増殖とそれに続くインターフェロン-γ の産生を誘導します。その結果、分解産物は黒色腫患者の抗腫瘍免疫を促進し、生存期間を延長しました [12]。さらに、L. reuteri FLRE5K1はマウスモデルの免疫系を刺激して抗がんサイトカインを産生し、黒色腫B16F10細胞の遊走を阻害して黒色腫の発症を防ぎ、マウスの生存期間を延ばすことができた[13]。 |
| しかし、プロバイオティクスのサプリメントは腸内細菌叢の多様性の低下と関連付けられており、これがチェックポイント阻害薬による免疫療法の効果低下と関連していることから [14]、当然のことながら物議を醸す報告もあった。一方で、細菌に富む黒色腫患者の腸内細菌叢は、抗 PD-1 治療に対する反応がより強かった [15]。別の研究では、プロバイオティクスが、対照群と比較して有意に大きい腫瘍を発症した黒色腫担がんマウスにおける抗 PD-L1 治療の抗腫瘍効果を損なったことが明らかになった [16]。同じ研究では、免疫チェックポイント阻害治療を受けている個人間でプロバイオティクスの利用が転帰に変化を示すかどうかを判断するための評価が行われ、プロバイオティクス摂取を報告した患者と報告しなかった患者の間で無増悪生存率に関して統計的に有意な差は認められなかった [16]。したがって、副作用のない将来の抗がん療法の可能性に関する知識をさらに広げるために、プロバイオティクスの有益な効果を研究する必要性が依然として存在する。 |
| 本研究は、黒色腫細胞株および乳がん細胞株に対するLactiplantibacillus plantarumの抗腫瘍効果を評価し、その基礎となるメカニズムをさらに明らかにすることを目的としました。この研究には、MTTアッセイ、免疫蛍光染色、アポトーシス、ウェスタンブロットアッセイなどのin vitro研究が含まれていました。 |
| 2. 材料と方法 |
| 2.1. 細菌と細胞株 |
| 細菌株 Lactiplantibacillus plantarumは、American Type Culture Collection (ATCC 8014、Łomianki, Poland) から購入し、ATCC Medium 416: Lactobacilli MRS Agar/Broth で培養し、5% CO2 の雰囲気で 37 °C の好気条件で増殖させました。細菌株懸濁液を 3500 rpm で 10 分間遠心分離し、光学密度を 600 nm (OD600) で調整して、2 × 1010 CFU/mL (コロニー形成単位/ミリリットル) を得ました (Microbiology Reader LogPhase 600、BioTek Instruments Inc.、Winooski, VT, USA)。 |
| この研究で使用した細胞株は以下のとおりです。 HaCaT(訳者注: HaCaTは、成人の皮膚から自発的に形質転換された異数性の不死化ケラチノサイト細胞株であり、科学研究で広く使用されています。 HaCaT細胞は、invitroで分化および増殖する高い能力のために利用されます)は CLS Cell Lines ServiceGmbH (Eppelheim, Germany) から購入しました。A375 ヒト悪性黒色腫 (ATCC® CRL-1619TM) および MCF-7 ヒト乳腺がん (ATCC® HTB-22™) 細胞株は ATTC American Type Culture Collection (Łomianki, Poland) から購入しました。 HaCaT および A375 ヒト悪性黒色腫細胞株はダルベッコ改変イーグル培地 (DMEM) で培養し、MCF-7 細胞株はイーグル最小必須培地 (EMEM) で培養しました。すべての培地には 10% FBS (Thermo Fisher Scientific、Boston, MA, USA) および 1% ペニシリン/ストレプトマイシン混合物 (10,000 IU/mL) (Thermo Fisher Scientific) が添加されていました。 細胞は、5% CO2雰囲気、37℃の加湿インキュベーター内で標準条件下で培養され、80~85%の集密度に達した後に実験に使用されました。 |
| 2.2. 細胞生存率評価 |
| 細胞生存率は、MTT(3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド)アッセイ(Roche、Mannheim, Germany)によって評価されました。細胞は、1×104細胞/ウェルの密度で96ウェルプレートで培養されました。適切なコンフルエンスに達した後、細胞培養培地を廃棄し、抗生物質を含まない細胞培地とMRSブロスの混合物に交換して、細胞と細菌の両方の増殖をサポートする環境を確立しました。次に、細胞を6つの異なる濃度のLactiplantibacillus plantarum(105~1010 CFU/mL)で処理しました。対照として、Lactiplantibacillus plantarum培地のみの細胞への影響を調べ、5-FU(訳者注:フルオロウラシル、フッ化ピリミジン系の代謝拮抗剤で、抗悪性腫瘍薬。胃がんや大腸がん(結腸・直腸がん)など消化器がんに広く用いられるほか、乳がんに対する適応もあります)(10 μΜ)を陽性対照として使用しました。処理された細胞は、生理学的環境を模倣し、強力な細胞成長をサポートするために、37°Cで5%CO2雰囲気の好気条件で維持されました。処理期間(48時間)後、プレートを10 μL/ウェルのMTT試薬で37℃で3時間インキュベートしました。この後、100 μL/ウェルのMTT緩衝液を加え、室温、暗所で30分間インキュベートしました。吸光度は、xMark™マイクロプレート分光光度計(Bio-Rad Laboratories, Inc.、Hercules, CA, USA)を使用して570 nmで測定しました。 |
| 2.3. クロマチン凝縮 |
| さまざまな試験化合物で処理した後の細胞形態の評価は、誘発された細胞毒性(すなわち、細胞死)の種類を識別するための信頼性の高い方法です。免疫蛍光アッセイは、最高濃度の Lactiplantibacillus plantarum(1010 CFU/mL)で 48 時間処理した HaCaT、黒色腫細胞株、および 乳がん細胞株で実施しました。選択は細胞生存率の結果に基づいていました。細胞は、Hoechst 33342 核染色アッセイ(Thermo Fisher Scientific)およびベータアクチンマウスモノクローナル抗体(製品 MA5-15739、Thermo Fisher Scientific)[17] によって標識されました。免疫蛍光染色に適用されたプロトコルは、製造元の推奨事項に従って確立され、次のように当研究室の条件に合わせて調整されました。(i)培養細胞を 1010 CFU/mL Lactiplantibacillus plantarumで 48 時間処理する。(ii)4% パラホルムアルデヒドで 15 分間細胞を固定する。 (iii) 0.25% Triton™ X-100 で 10 分間細胞透過処理し、5% BSA で室温で 1 時間ブロッキングする。(iv) 0.1% BSA 中の 2 µg/mL ベータアクチン抗体で室温で 3 時間インキュベートする。(v) 1:2000 Alexa Fluor 488 ヤギ抗マウス二次抗体 (製品 A28175、Thermo Fisher Scientific) で室温で 45 分間一次抗体標識する。(vi) Hoechst 染色溶液 (5 µg/mL) を添加し、室温および暗所で 10 分間インキュベートする。(vii) PBS で 3 回洗浄する。画像は、CellSens Entry ソフトウェア バージョン 3.0 (Olympus, Tokyo, Japan)、DP28-CU カメラ (Olympus)、および倒立蛍光顕微鏡 Optika IM-3FL4 (Optika, Ponteranica, Italy) を使用して取得されました。 |
| 2.4. アネキシンV-FITC/ヨウ化プロピジウム(PI)染色 |
| 黒色腫細胞株および乳がん細胞株におけるLactiplantibacillus plantarum 1010 CFU/mL)誘導細胞死の評価は、アネキシンV/PI法[18]によって行われた。(訳者注:アネキシンVはフローサイトメトリーでアポトーシス細胞を検出するために広く利用されている)。 黒色腫細胞株および乳がん細胞株を6ウェルプレートで1×106細胞/ウェルの密度で培養し、24時間接着させた。その後、培養培地を最終濃度(1010 CFU/mL)のサンプルを含む新鮮な培地に交換した。未処理細胞は対照として使用した。48時間の培養後、細胞をトリプシン処理し、アネキシンV-FITCキット(Invitrogen、ThermoFisher、Vienna, Austria)のPIと組み合わせたアネキシンV-FITCを使用して、細胞死(アポトーシスおよび壊死)のフローサイトメトリー分析を行った。剥離後、細胞を緩衝液 1 × アネキシンV 結合緩衝液で 2 回洗浄し、195 μL 結合緩衝液に再懸濁し、アネキシン V-FITC とともに暗所で 15 分間インキュベートしました。インキュベーション後、細胞を再度洗浄し、190 μL 結合緩衝液に再懸濁し、フローサイトメトリー分析の 10 分前に PI 溶液を加えました。データは、FACSCalibur フローサイトメーター (Becton Dickinson、Franklin Lakes、NJ、USA) を使用して取得しました。 |
| 2.5. BAX および Bcl-2 の検出 |
| プロアポトーシス BAX および抗アポトーシス Bcl-2 タンパク質の活性は、比色アッセイキット (ab199080 および ab119506、Abcam plc、Cambridge, UK) で測定しました。HaCaT、黒色腫細胞株、および乳がん細胞株を 6 ウェルプレートで培養し、1010 CFU/mL Lactiplantibacillus plantarumで 48 時間処理しました。BAX および Bcl-2 のレベルは、製造元の説明書 [19] に記載されているアッセイ手順に従って測定しました。総タンパク質濃度は、Pierce™ Rapid Gold BCA タンパク質アッセイキット (Thermo Fisher Scientific) を使用して測定しました。吸光度は、xMark™ マイクロプレート分光光度計 (Bio-Rad、Hercules, CA, USA) を使用して 450 nm で読み取りました。 |
| 2.6. ウェスタンブロット |
| HaCaT、黒色腫細胞株、乳がん細胞株を6ウェルプレートで1×106細胞/ウェルの密度で培養した。24時間後、細胞をLactiplantibacillus plantarum 1010 CFU/mLで処理し、さらに48時間37℃でインキュベートした。ウェスタンブロットのワークフローは、Pillai-Kastooriらの推奨に従って実施した[20]。処理後、細胞を取り出し、RIPAバッファー(Thermo Fisher Scientific)で溶解した。タンパク質濃度は、Pierce™ Rapid Gold BCAタンパク質アッセイキット(Thermo Fisher Scientific)[21]を使用して、製造元のプロトコルに従って測定した。ウェスタンブロット分析は、Novex® NuPAGE® 4~12%ビストリスゲル(NP0321BOX、Thermo Fisher Scientific)の各レーンに等量のタンパク質(20μg)をロードして実施した。分離後 (Mini Gel Tank-A25977、Thermo Fisher Scientific)、タンパク質を iBlot® 2 ドライブロッティングシステム (IB23001、Thermo Fisher Scientific) でニトロセルロース膜に転写し、得られた膜を 5% スキムミルクでブロックしました。ブロットは、ブロッキングバッファー中の 1:1000 抗 PARP1 (切断された Asp214) モノクローナル抗体 (14-6668-82、Thermo Fisher Scientific) で 4 °C で一晩プローブしました。ヤギ抗マウス IgG (H+L) Superclonal™ 組換え二次抗体、HRP (1:2000 希釈、Thermo Fisher Scientific) を二次抗体として使用し、β-チューブリンマウスモノクローナル抗体 1:1000 希釈 (製品番号 32-2600、Thermo Fisher Scientific) をローディングコントロールとして使用しました。化学発光検出は、ChemiDoc MP イメージング システム (170-8280) で Pierce™ ECL ウェスタン ブロッティング 基質 (Thermo Fisher Scientific) を使用して実行されました。画像の取得と分析は、Image Lab ソフトウェア バージョン 6.1 (BioRad) を使用して実行されました。 |
| 2.7. 統計分析 |
| 統計分析は、一元配置分散分析とそれに続く Bonferroni の多重比較事後検定 (GraphPad Prism バージョン 6.0.0、GraphPad Software、San Diego, CA, USA) を使用して実施しました。グループ間の差は、p < 0.05 の場合に統計的に有意であるとみなされました。* p < 0.05、** p < 0.01、*** p < 0.001。 |
| 3. 結果 |
| 3.1. Lactiplantibacillus plantarum細胞毒性活性の評価 |
| Lactiplantibacillus plantarum (105~1010 CFU/mL) の非悪性 HaCaT 不死化ヒトケラチノサイト、悪性黒色腫、および乳腺がん細胞株に対する細胞毒性効果を MTT アッセイで評価しました。Lactiplantibacillus plantarum培地は、本研究で使用したどの細胞株でも細胞生存率に影響を与えませんでした (図 1)。105~1010 CFU/mL Lactiplantibacillus plantarumで処理した正常 HaCaT 細胞株と対照群を比較した場合、細胞生存率に有意な変化は認められませんでした (図 1A)。1010 および 109 CFU/mL Lactiplantibacillus plantarumで処理した A375 悪性黒色腫細胞では、対照群 (100%) と比較して細胞生存率が有意に低下しました (70.86 ± 6.91 および 85.68 ± 2.60)。陽性対照の 5-FU (10 μM) は、対照と比較して細胞生存率を 72.13 ± 7.07 に低下させました (図 1B)。乳腺がんに対する Lactiplantibacillus plantarum処理は、対照 (100%) と比較して 1010 および 109 CFU/mL (77.34 ± 3.44 および 82.11 ± 2.31) で試験した場合にのみ、細胞生存率を低下させることができました (65.83 ± 1.35) (図 1C)。 |
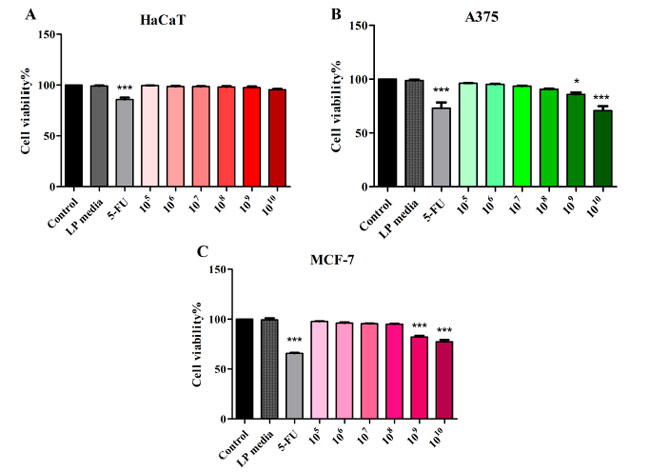 |
図 1 Lactiplantibacillus plantarum 105~1010 CFU/mL および 5-FU (10 μΜ) で 48 時間処理した後の HaCaT (A)、黒色腫細胞株 (B)、および 乳がん細胞株 (C) 細胞の細胞生存率。 HaCaT:不死化ヒトケラチノサイト、A375:黒色腫細胞株、MCF-7:乳がん細胞株、LP: Lactiplantibacillus plantarum。 結果は、コントロール グループを 100% とした場合の生存率のパーセンテージとして表されます (* p < 0.05、*** p < 0.001)。データは、3 回繰り返して実行された 3 つの独立した実験の平均値 ± SD を表します。 |
| 非悪性 HaCaT細胞株では、コンフルエンスに関して、コントロール グループと Lactiplantibacillus plantarum 108~1010 CFU/mL 処理細胞との間に有意な形態学的変化は観察されませんでした。Lactiplantibacillus plantarum 1010 および 109 CFU/mL 処理細胞では剥離細胞がわずかに観察されましたが、細胞生存率に有意な影響はありませんでした。5-FU は陽性コントロールとして使用されました。5-FU およびコントロールと比較して、Lactiplantibacillus plantarum処理は正常 HaCaT細胞の細胞形態に有意な影響を与えません (図 S1)。黒色腫細胞株細胞形態の評価では、Lactiplantibacillus plantarum 処理により接着細胞数が減少し、細胞剥離が生じ、使用濃度に正比例した効果が得られました (図 S2)。 |
| 乳がん細胞株に 109 および 1010 CFU/mL のLactiplantibacillus plantarum処理を施すと、細胞数が減少し、細胞の形態が変化して細胞が剥離しました。Lactiplantibacillus plantarum 108 CFU/mL 処理したがん細胞の形態と形状は、対照細胞、つまり接着細胞と合流細胞と類似していました (図 S3)。 |
| 3.2. 免疫蛍光染色によるアポトーシスの特徴の評価 |
| Lactiplantibacillus plantarum (1010 CFU/mL) が HaCaT、黒色腫細胞株、乳がん細胞株細胞の形態に与える影響についても、Hoechst およびベータアクチン/Alexa Fluor 488 免疫蛍光染色を使用して調査しました (図 2)。HaCaT細胞に対する最高濃度の Lactiplantibacillus plantarum 処理では、顕著な形態変化は見られませんでした (図 2)。しかし、黒色腫細胞株では、同じ濃度のLactiplantibacillus plantarum処理により、細胞骨格が破壊され、核の断片化と凝縮が見られました。これは、アポトーシスによる細胞死と一致する特徴です (図 2)。1010 CFU/mL Lactiplantibacillus plantarumで処理した乳がん細胞株細胞では、アポトーシスによる細胞死と一致する細胞形態の同様の変化が見られました。具体的には、処理した乳がん細胞株細胞では、核の凝縮、断片化、膜のブレブ形成、細胞骨格の崩壊が見られました (図 2)。各がん細胞株のコントロール群と処理群のアクチンフィラメントの分布を比較すると、β-アクチンは比例しており、細胞分散液の細胞体全体に集中しているのに対し、処理されたがん細胞では、その分布は主に細胞膜の下にある皮質リングに集中していることがわかります(図2)。 |
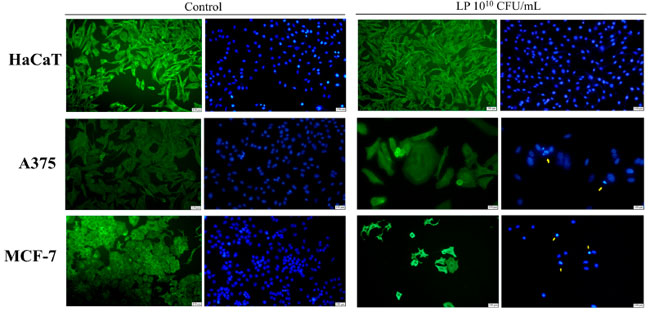 |
図 2 1010 CFU/mL Lactiplantibacillus plantarumによる 48 時間処理が HaCaT、黒色腫細胞株、乳がん細胞株に及ぼす影響。 HaCaT:不死化ヒトケラチノサイト、A375:黒色腫細胞株、MCF-7:乳がん細胞株、LP: Lactiplantibacillus plantarum。 ベータアクチンは緑色に染色され、核は青色に染色されています。黄色の矢印はアポトーシスの兆候を示しています。 |
| 3.3. アネキシン V/PI 分析 |
| 図 3 と図 4 は、黒色腫細胞と乳がん細胞株細胞に対するアネキシンV/PI 分析の結果を示しています。Lactiplantibacillus plantarum (1010 CFU/mL) は、黒色腫細胞株(図 3) と 乳がん細胞株細胞 (図 4) の両方でアポトーシスを誘導したことがわかります。黒色腫細胞株細胞の場合、未処理細胞の初期アポトーシス細胞の割合は 7.69 ± 4.23% でしたが、Lactiplantibacillus plantarumで 48 時間処理した細胞の初期アポトーシス細胞の割合は 20.03 ± 8.76% でした。乳がん細胞株細胞の場合、初期アポトーシス細胞の割合は 8.36 ± 1.58% (未処理細胞) から 40.43 ± 4.81% (Lactiplantibacillus plantarum処理細胞) に増加しました。 |
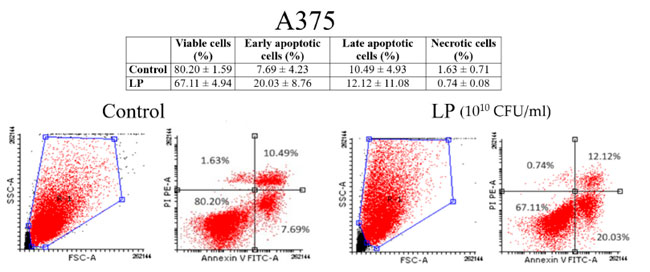 |
| 図 3 アネキシン V/PI 二重染色による (Lactiplantibacillus plantarum 1010 CFU/mL) 後の 黒色腫細胞株(A375)細胞のアポトーシスの識別: 生細胞 (左下)、初期アポトーシス細胞 (右下)、後期アポトーシス細胞 (右上)、壊死細胞 (左上)。 LP: Lactiplantibacillus plantarum |
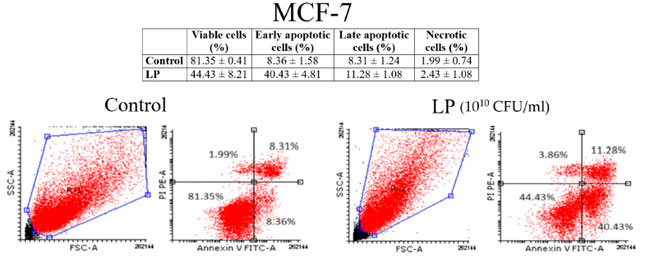 |
| 図 4 アネキシン V/PI 二重染色による (Lactiplantibacillus plantarum1010 CFU/mL) 後の 乳がん細胞株(MCF-7)細胞におけるアポトーシスの識別: 生細胞 (左下)、初期アポトーシス細胞 (右下)、後期アポトーシス細胞 (右上)、壊死細胞 (左上)。 LP: Lactiplantibacillus plantarum |
| 3.4. アポトーシスアッセイ- BAX および Bcl-2 タンパク質レベルに対するLactiplantibacillus plantarumの効果 |
| Lactiplantibacillus plantarum処理が HaCaT、黒色腫細胞株(A375)、および 乳がん細胞株細胞でアポトーシス細胞死を誘発するかどうかを決定するために、in vitro 酵素結合免疫吸着測定法 (ELISA) を使用して、プロアポトーシス BAX および抗アポトーシス Bcl-2 レベルを定量的に測定しました。結果は、Lactiplantibacillus plantarum処理により、すべてのがん細胞株でプロアポトーシス BAX タンパク質レベルが増加し、抗アポトーシス Bcl-2 タンパク質レベルが減少することを示しています (図 5)。正常細胞では、Lactiplantibacillus plantarum処理により BAX および Bcl-2 タンパク質レベルが同様に変化する傾向がありましたが、これらの効果は統計的に有意ではありませんでした (図 5)。 |
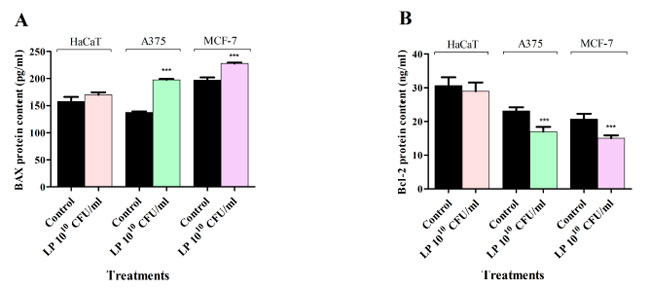 |
| 図 5 1010 CFU/mLLactiplantibacillus plantarum が 48 時間処理後の HaCaT、黒色腫細胞株、乳がん細胞株の BAX (A) および Bcl-2 (B) タンパク質レベルに及ぼす影響。 HaCaT:不死化ヒトケラチノサイト、A375:黒色腫細胞株、MCF-7:乳がん細胞株、LP: Lactiplantibacillus plantarum。 結果は、それぞれのコントロールと比較した場合の平均値 ± SD で報告され、p < 0.001 (***) でした。すべての実験は 3 回繰り返して実施しました。 |
| 3.5. ウエスタンブロット分析 |
| Lactiplantibacillus plantarumの細胞毒性メカニズムを明確に確立するために、アポトーシス細胞死のマーカーである切断された PARP のタンパク質発現レベルをウエスタンブロットで測定しました (図 6)。Lactiplantibacillus plantarum1010 CFU/mL で処理すると、切断された PARP の発現はすべてのがん細胞株でアップレギュレーションされました (図 6)。Lactiplantibacillus plantarum処理後の正常な HaCaT細胞では、切断された PARP レベルの統計的に有意な増加は検出されませんでした (図 6)。 |
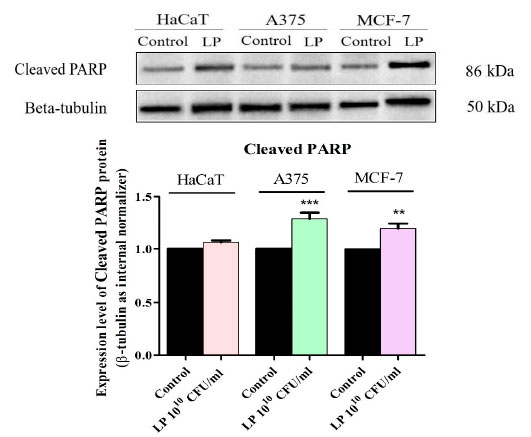 |
図 6 HaCaT、黒色腫細胞株、および 乳がん細胞株細胞における切断された PARP タンパク質発現の測定。 HaCaT:不死化ヒトケラチノサイト、A375:黒色腫細胞株、MCF-7:乳がん細胞株、LP: Lactiplantibacillus plantarum。 結果は、β-チューブリン負荷コントロールおよびコントロール グループに対して正規化されました。コントロールとの統計的差異は、一元配置分散分析とそれに続く Tukey の多重比較事後検定を使用して決定されました (** p < 0.01、*** p < 0.001)。 |
| 4. 考察 |
| がんは世界中で死亡の主な原因であり、体のどの臓器にも影響を及ぼす可能性があります。WHOによると、乳がんは2020年に226万件の症例があり、最も一般的ながんでした[22]。また、皮膚黒色腫は世界のがん症例の1.7%を占め、2020年には約325,000件の新規症例がありました[23]。従来の治療法には、生活の質を低下させたり、薬剤耐性を引き起こして患者の生存を損なう重篤な副作用が伴います。したがって、選択的で効果的な抗がん治療を補助または提供する新しい補助薬や代替薬は、がん患者と医療専門家の両方にとって魅力的です。 |
| プロバイオティクスは長い間健康上の利点と関連付けられており、過去10年間は腫瘍性病変に対する補助剤としても使用されています。Lactiplantibacillus plantarumは、アポトーシス、抗変異原性、抗転移能を持つさまざまな代謝産物を生成することができる、広く使用されている乳酸菌に属しています[24]。 |
| Lactiplantibacillus plantarumは、副作用が弱い、または副作用のない将来の治療オプションを可能にする潜在的な抗がんメカニズムを特定するために、乳がん細胞と黒色腫細胞に対してテストされました。テストされたLactiplantibacillus plantarum濃度の範囲は、以前に発表された研究に従って選択されました。例として、B16F10 黒色腫細胞に対する L. reuterii の in vitro および in vivo 研究は、107 CFU 細菌懸濁液を使用して実施されました。著者らは、プロバイオティクス活性には 106 CFU/mL 生菌の最小濃度が必要であることを示しました [13]。さらに、プロバイオティクス効果を宣伝する市販製品では、108~109 CFU/用量以上の濃度が見られます [25]。 Molska と Regula は、がん治療または予防に推奨されるプロバイオティクスの最適濃度はまだ明確に確立されていないが、宿主生物への効果的な影響が期待される場合は、その濃度が低くてはならないと報告しました。 著者らは、大腸がん予防には1日あたり1010~1011 CFUのLactobacillus spp. が必要であると述べている[26]。 |
| Lactiplantibacillus plantarumを1010および109 CFU/mLの濃度で使用した場合、黒色腫細胞に対する細胞毒性活性は、抗がんの従来の薬である5-FUで記録されたものと同等でした。同様の濃度のL. rhamnosusは、濃度依存的にA375黒色腫細胞の生存率を選択的に低下させました[27]。5-FUは通常、粘膜炎、下痢、骨髄抑制、心臓毒性および神経毒性を伴い、がん患者の全身治療を困難にします。したがって、Lactiplantibacillus plantarumの使用は、治療を受けた患者の生活の質の点で、毒性の高い抗がん療法をより受け入れやすいものに置き換える可能性があります。私たちの結果は、2020年にParkらがA375黒色腫細胞で報告した結果と一致しており、Lactiplantibacillus plantarum抽出物は、特に抗移動効果を伴う高転移性黒色腫細胞で強力な抗増殖活性を発揮しました[28]。 Lactiplantibacillus plantarumの抗黒色腫潜在的効果は生体内で確認されており、血管新生VEGFの血清レベルの有意な減少と免疫刺激性IL-12の血清レベルの有意な増加が記録されている[29]。 乳がん細胞において、Lactiplantibacillus plantarum抽出物は、黒色腫細胞に対して記録されたものと同様の抗増殖活性を示し、従来の 5-FU に匹敵しました。これは、Lactiplantibacillus plantarumを従来の薬剤と組み合わせて補助療法として投与された乳がん患者において、特に WBC レベルにおいて臨床的および臨床検査プロファイルの改善が示されたことから予想されたことです [30]。実際、さまざまな Lactiplantibacillus plantarum株が、乳がん細胞を含むさまざまながん細胞株に対して細胞毒性効果を誘発しました。乳がん細胞では、UL4 株が最低の IC50 値とがん細胞に対する高い選択性を示しました。著者らは、Lactiplantibacillus plantarum抽出物が株特異的およびがん細胞タイプ特異的に選択的な抗増殖効果を発揮すると結論付けました [31]。生体内のプロバイオティクス細菌は乳がん細胞と直接接触しませんが、腫瘍頻度を低下させる有益な効果は議論の余地なく明らかにされ、腫瘍組織におけるLactiplantibacillus plantarumによって誘発される全身免疫調節効果、たとえば CD4+T 細胞および CD8+T 細胞のレベルの上昇や血清 TNF 濃度の低下に起因することが示されました [32]。試験管内研究では、MCF-7乳がん細胞に対するLactiplantibacillus plantarumの細胞毒性活性は、時間と用量依存的に作用するタンパク質性ポストバイオティクス代謝物に起因する可能性があることが強調されています[33]。試験管内および生体内のデータを裏付けると、そのような代謝物やその他の代謝物はプロバイオティクスの経口投与後に吸収され、生体内で腫瘍細胞に到達し、免疫調節全身活性と相まって全体的な抗がん効果を生み出すメカニズムであるとしか考えられません。 もうひとつの可能性はごく最近、Benderらによって発表された。彼らは、生存L. reuteriが腸から黒色腫腫瘍に移行し、そこでトリプトファン分解産物インドール-3-アルデヒドの産生を介して抗腫瘍Tc1免疫を誘発できることを示した。抗腫瘍効果は、生存細菌を黒色腫腫瘍に注入した後にも報告されており、著者らは、生存L. reuteriの腫瘍内存在が免疫調節効果を促進し、腫瘍増殖を抑制するために必要であり、そのような効果はその代謝活性に大きく依存すると結論付けた[12]。これらの知見に照らして、古い考えに反して、乳房組織(正常および悪性の両方)もまた特定の微生物叢を有していることを言及する価値がある。正常な微生物叢は、常在免疫細胞の刺激を介して乳房組織の健康維持に関与しているだけでなく、潜在的な発がん物質を分解する能力を介しても関与している[34]。乳がんの悪性乳房組織は、乳がんの種類ごとに細菌量と多様性が異なり、明確な微生物パターンを特徴としています。さらに、乳がんでは、腸内細菌叢は構成細菌量と微生物代謝物の点で大きな変化を示します[35]。 |
| Lactiplantibacillus plantarumの細胞毒性活性の重要な側面は、その選択性です。これは、MTT アッセイを HaCaT 細胞 (不死化非悪性ケラチノサイト) で実施したときに、適用濃度に関係なく細胞死が見られなかったことから明らかです。HaCaT 細胞は、ヒト細胞におけるがんの多段階的発達や表皮の病態生理学および恒常性を研究するために広く使用されている細胞株です。細胞生存率の結果は、両方のがん細胞株で付着細胞数が用量依存的に減少し、同時に HaCaTでは顕著な形態変化が見られなかったことを示す形態学的研究によって確認されました。 |
| Lactiplantibacillus plantarum細胞毒性効果の根底にある分子メカニズムを免疫蛍光染色法で研究したところ、細胞骨格の破壊によって細胞の正常な構造が変化するとともに、核の断片化と凝縮が起こることが明らかになりました。ベータアクチンは細胞骨格の重要な構成要素であり、細胞の要求に応じてフィラメントを素早く形成または解体する能力を持っています。さらに、研究により、ベータアクチンは細胞骨格の足場であるだけでなく、アポトーシス調節因子でもあることが明らかになりました。血管平滑筋細胞では、ベータアクチン細胞骨格の破壊によって Bmf プロアポトーシスマーカーが放出され、結果としてアポトーシスが起こりました [36]。細胞内の重要な細胞構成要素の正しい位置は、細胞骨格フィラメントの方向と完全性に依存します [37]。したがって、細胞骨格の崩壊と核の収縮は細胞死を誘発することができ、これはアポトーシスの兆候とみなされています。実際、Lactiplantibacillus plantarumの代謝によって生成されるリノール酸は乳がん細胞でアポトーシスを誘導することが示されており[24]、Lactiplantibacillus plantarum抽出物はA375黒色腫細胞で内因性アポトーシスを誘導し、同時にその細胞の移動能力を阻害することが示されています[28]。 研究によると、腫瘍微生物叢はアクチン細胞骨格を再編成し、それによって流体せん断応力に対する抵抗力を高めることにより、さまざまな種類の転移性腫瘍細胞の生存に重要な役割を果たしていることが示されています [38]。したがって、細胞骨格の破壊を引き起こす能力を持つプロバイオティクスの投与は、腫瘍微生物叢を変化させるだけでなく、遠隔転移の原因となる循環腫瘍細胞の生存を低下させる可能性があります。一例として、ケフィアに含まれるプロバイオティクスは、マウスの乳がん細胞において抗転移作用と抗血管新生作用を示しました [39]。免疫蛍光染色の結果は、黒色腫および乳がん細胞のアポトーシス状態を評価するために使用されたデュアルアネキシンV / PI染色フローサイトメトリーによって確認されました。結果は、Lactiplantibacillus plantarum治療が対照と比較して早期アポトーシス細胞の割合を増加させることができることを示しました。すべてのアポトーシス試験は、用量依存的な抗増殖効果に基づき、アポトーシス効果と、その濃度で存在する高密度の細菌集団によってがん細胞に物理的に誘発される可能性のある壊死効果を明確に識別するために、最も効果的な濃度である 1010 CFU/mL を使用して実施されました。結果は、細菌密度が減少し、アポトーシス効果が明らかに優勢になるより低い濃度に外挿できます。 |
| がん細胞におけるアポトーシスの誘導は、がんを治療する最も効率的な方法です。私たちの研究は、プロアポトーシス(BAX)および抗アポトーシス(Bcl-2)タンパク質レベルのより詳細な調査を継続しました。Bcl-2タンパク質ファミリーは、アポトーシス促進または抗アポトーシス特性を持つメンバーで構成されており、アポトーシス、発がん、抗がん治療に対する細胞応答の調節における役割について広範囲に研究されてきました。Bcl-2タンパク質ファミリーとそのエフェクターカスパーゼによって制御されるミトコンドリア媒介性内因性アポトーシスは、細胞構造の破壊、核凝縮、DNA断片化、膜ブレブ形成を含む、上記のアポトーシスの分解段階を誘導します[40]。私たちの研究では、Lactiplantibacillus plantarum1010 CFU/mLで処理すると、3つのがん細胞株すべてでBcl-2のタンパク質レベルが減少し、BAXレベルが増加したため、テストしたがん細胞のアポトーシスの1つの分子メカニズムが明らかになりました。これらの実験結果は、これまでの文献報告によって確認されています。Ardestaniらは、Lactobacillus brevisがHT-29大腸がん細胞の増殖を抑制し、BAX、カスパーゼ-3、カスパーゼ-9 mRNAの発現を増加させ、Bcl-2タンパク質レベルの発現を低下させることでアポトーシスを誘導することを明らかにしました[41]。実際、Lactiplantibacillus plantarum抽出物は以前に、抗アポトーシスBcl-2タンパク質のレベルを低下させ、アポトーシスBAXタンパク質を増加させ、同時にカスパーゼ-3と-9を活性化することが報告されており[28]、したがって内因性アポトーシス誘導剤として適格です。同様に、Senturkらは、Lactiplantibacillus plantarum二次代謝物によってMCF-7乳がん細胞におけるBcl-2のダウンレギュレーションを明らかにしました[42]。 議論の余地はあるものの、2015年にKimらは逆の効果が報告しており、Lactiplantibacillus plantarum抽出物はカスパーゼ9と3の生成を抑制し、Bcl-2の発現を活性化することでHT-29大腸がん細胞のアポトーシスを阻害することが明らかになった[43]。しかし、彼らの実験では、他の細胞に拡散するために細胞アポトーシスを誘導できるS. aureus に事前に感染した大腸がん細胞にLactiplantibacillus plantarum抽出物を投与した。さらに、この研究では、Lactiplantibacillus plantarum抽出物処理細胞はS. aureus のみの細胞と比較してBcl-2の発現が増加し、Lactiplantibacillus plantarumのペプチドグリカンとリポテイコ酸はS. aureusによるアポトーシスを阻害することが明らかになった[43]。別の研究では、ラットを全身ガンマ線照射に曝露し、1×1010 Lactobacillus sppを0.2mL経口投与した。 4週間にわたってガンマ線照射を受け、その後、精巣組織を定量的リアルタイムポリメラーゼ連鎖反応(qRT-PCR)を用いて分析した。同様に、この研究では、ガンマ線照射が健康な動物組織中のBcl-2を阻害し、BAXおよびカスパーゼ-3遺伝子を活性化し、Lactiplantibacillus spp.による治療がそのような影響を逆転させ、天然の放射線防護剤として作用することが明らかになった[44]。 一方、Lactiplantibacillus plantarum06CC2抽出物は、JNK/p38 MAPKシグナル伝達系を介してアポトーシスを誘導することにより、Caco2大腸がん細胞の細胞生存率を著しく抑制した[45]。さらに、Caco2大腸がん細胞は、比較的短い処理期間(6~24時間)の後、さらには10%希釈でも大腸がん細胞の生存率を著しく低下させることができたLactiplantibacillus plantarum代謝物に敏感であった。しかし、著者らは、Lactiplantibacillus plantarum代謝物の細胞毒性メカニズムはアポトーシスではなく細胞のオートファジーに関与していると報告した。Lactiplantibacillus plantarum代謝物はファゴフォアとオートファゴソームの形成プロセスを阻害し、オートファジータンパク質Atg9A、LC3 I/II、Atg5、Atg16L1、およびBeclin-1の発現を減少させた[46]。すべてのデータを考慮すると、健康な細胞だけでなく、S. aureus 感染などの以前の攻撃にさらされた細胞でも、Lactiplantibacillus plantarumはアポトーシス抑制剤として作用するのに対し、がん細胞ではその効果が逆転するという結論に達する可能性があります。これらの反対の効果は、アポトーシス関連遺伝子の阻害または活性化という同じメカニズムに基づいて発生し、細胞の種類に応じて反対方向に進化します。 |
| 前述のように、Bcl-2 ファミリータンパク質とカスパーゼエフェクター、特にカスパーゼ 3 は、アポトーシス細胞死を制御します。カスパーゼ 3、そして暗黙的に Bcl-2 ファミリータンパク質の主なターゲットの 1 つは、DNA 修復に関与するタンパク質である核ポリ (ADP-リボース) ポリメラーゼ (PARP) です [47,48]。カスパーゼ 3 による PARP の切断は、DNA 修復を防ぐためのアポトーシスプログラム中に発生するため、切断された PARP は、アポトーシスを起こしている細胞のマーカーとして機能します [47,48]。核形態学的評価後に得られた結果とアポトーシスアッセイの結果を考慮して、ウェスタンブロット分析によって切断された PARP タンパク質の発現を評価することにより、Lactiplantibacillus plantarumのアポトーシス作用機序を確認するためのより詳細な分析が行われました。結果は、Lactiplantibacillus plantarum処理がすべてのがん細胞株で切断された PARP の発現レベルを増加させることを明確に示しています。同様の結果が Kim らによって報告されています。彼らは、Lactobacillus rhamnosus由来のタンパク質(p8)が、切断されたPARP1の発現を増加させ、大腸がんのマウス異種移植モデルで細胞のアポトーシスを誘導したと報告した[49]。さらに、Bacillus coagulans のCOLO205結腸腺がん細胞株に対する細胞傷害性およびアポトーシス促進効果も、BAX/Bcl-2比の増加、カスパーゼ-3レベルの増加、およびPARP切断に起因することが示されている[50]。私たちの研究では、Lactiplantibacillus plantarumはBAX/Bcl-2比やHaCaT細胞における切断されたPARP発現レベルを有意に変化させなかったため、がん細胞に対する選択的な活性が明らかになった。がんに対するLactiplantibacillus plantarum抽出物の治療可能性を適切に評価するには、さらなる研究が必要である。 |
| 乳がんや悪性黒色腫に対するプロバイオティクスの投与による治療効果の生体内側面を明らかにするには、今後の研究が必要ですが、以前の論文で非常に効果的な生体内結果が報告されているため、有望な結果が期待できます。一例として、2020年にEslamiらが発表したレビューでは、マイクロバイオームは乳がんの危険因子であり、治療への反応に不可欠であると述べられています[51]。著者らはまた、早期乳がんの発生を抑制し、腫瘍の縮小を誘導できるLactobacillusのさまざまな種を報告しています。同様に、Thuらは、乳がん患者と生存者におけるプロバイオティクスの使用に関するランダム化臨床試験のデータを収集しました。彼らの系統的レビューとメタアナリシスにより、プロバイオティクスはがんの重症度と症状の両方を軽減し、予後を改善することが明らかになりました[52]。Lactiplantibacillus plantarumは実験的黒色腫担がんマウスに投与され、免疫系の刺激と血管新生抑制を通じて抗がん剤として作用しました[29]。別の種であるL. reuteriは、B16F10黒色腫細胞の生体内での移動を阻害し、黒色腫の発症を防ぎ、マウスの生存期間を延長しました[13]。これらの知見を踏まえて、今後の生体内研究により、プロバイオティクス全般およびLactiplantibacillus plantarum、特に黒色腫と乳がんに対する治療効果の全体像が明らかになるでしょう。 |
| 5. 結論 |
| 本研究では、2 つの黒色腫細胞株と 1 つの乳がん細胞株に対するLactiplantibacillus plantarumの抗増殖活性について調査し、従来の抗がん剤 5-FU に匹敵する顕著な細胞毒性活性が明らかになりました。これらの知見を受けてさらに調査が進められ、Lactiplantibacillus plantarumには細胞骨格を破壊し、核の形態を変え、アポトーシスを誘導する能力があることがわかりました。ウエスタンブロット分析では、切断された PARP のレベルが上昇していることが明らかになりました。これは BAX の増加と Bcl-2 タンパク質レベルの減少と関連しており、アポトーシス促進作用のメカニズムを裏付けています。さらに、Lactiplantibacillus plantarumは正常な HaCaT 細胞に対して最小限の効果しか示さず、選択的活性を示唆している可能性があります。抗がん治療における補助剤としての可能性を完全に確立するには、さらなる研究が必要です。多数の研究で、プロバイオティクス投与ががんを予防し、抗がん治療を強化する潜在的な利点が実証されています。さらに、プロバイオティクスには抗がん効果があることを示唆する有望な知見も出ています。しかし、報告された研究結果は、プロバイオティクスががん予防策として、または従来の抗がん化学療法と併用する補助療法として有用であることを裏付けているに過ぎません。プロバイオティクスとがん治療に関する将来の展望として、この分野でのプロバイオティクスの可能性を明確に確認するには、特定のプロバイオティクス株の抗がん作用メカニズムに関するさらなる研究と臨床調査が必須であり、医学界の承認を得て、がん治療の可能性のある選択肢としてのプロバイオティクスの有効性を確認することが必要です。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Microorganisms. 2024 Jan; 12(1): 182.に掲載されたLactiplantibacillus plantarum Induces Apoptosis in Melanoma and Breast Cancer Cells.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |