
Teresa Padro et al., |
要約 |
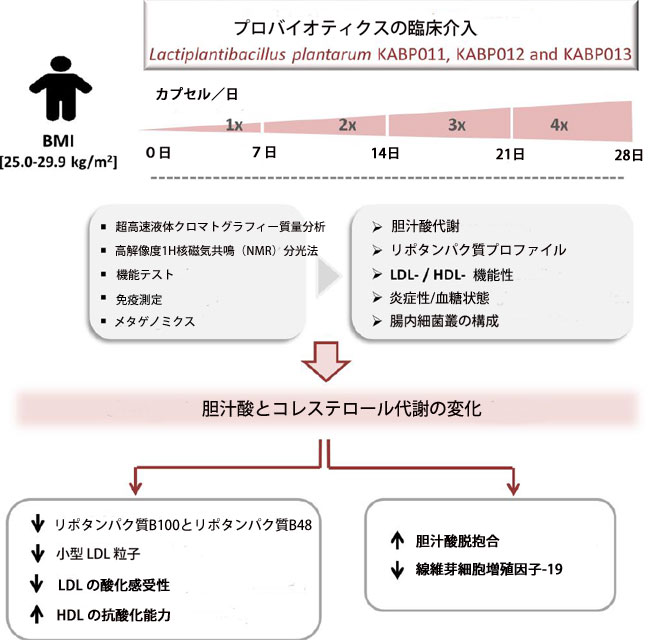
| 目的 :胆汁酸塩加水分解酵素 (BSH) 活性の高いプロバイオティクスは、心臓血管の健康を促進することが示されています。しかし、その作用機序は十分に解明されていません。ここでは、Lactiplantibacillus plantarum 株 KABP011、KABP012、および KABP013 を含む 胆汁酸塩加水分解酵素活性配合剤の用量を段階的に増やしながら 4 週間介入した場合の、胆汁酸 (BA)、脂質プロファイル、およびリポタンパク質機能への影響を調べるためのパイロット探索研究を実施しました。 |
| 方法と結果:この研究には、健康な太りすぎの個人が含まれました。プロバイオティクスの摂取は、タウロ結合型および糖結合型の減少により、血清中の結合型胆汁酸の漸進的な減少と関連していました。線維芽細胞増殖因子-19の血漿レベルは大幅に減少し、胆汁酸の変化と相関していました。プロバイオティクスは血清脂質の大幅な変化を引き起こし、非HDLコレステロール(非HDLc)およびLDLコレステロール(LDLc)レベルを減少させました。最大の減少は、ベースラインLDLコレステロールレベルが高いサブグループ(LDLコレステロール> 130 mg/dL)で実証されました。循環アポリポタンパク質(Apo)B100およびアポリポタンパク質B48の空腹時レベルは大幅に減少しました。重要なことに、非HDLコレステロールレベルの減少は、小さなLDL粒子の大幅な減少と関連していました。機能テストでは、プロバイオティクス摂取後に LDL 粒子の酸化に対する感受性が大幅に低下し、HDL 粒子の抗酸化能力が高まったことが示されました。研究終了時に収集された糞便中の微生物叢プロファイルには、タウリンを消費する細菌である Desulfovibrio属の細菌が多く含まれていましたが、これはプロバイオティクスの胆汁酸塩加水分解酵素活性により腸内の遊離タウリンが増加したためと考えられます。 |
| 結論:L. plantarum 株による介入は、胆汁酸シグネチャーとリポタンパク質プロファイルに有益な効果をもたらします。 アポリポタンパク質B と小型 LDL レベル、および LDL の酸化に対する感受性を低下させ、HDL の抗酸化能力を高めます。これらの代謝プロファイルの変化は、アテローム性動脈硬化性疾患に対する保護が強化されることを示唆しています。 |
| 要約の図解 |
 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 方法 |
| 2.1 被験者 |
| 2.2 研究デザイン |
| 2.3 生物学的サンプル |
| 2.4 人体計測データ、血圧、血清脂質プロファイル、その他の生化学測定 |
| 2.5 血清および糞便中の胆汁酸プロファイルの分析 |
| 2.61H核磁気共鳴法によるリポタンパク質、糖タンパク質、脂質、低分子量代謝物の代謝プロファイル |
| 2.7 リポタンパク質の機能性 |
| 2.8 免疫測定 |
| 2.9 トリメチルアミン N-オキシド |
| 2.10 微生物叢分析 |
| 2.11 AB-LIFE 株の胆汁酸塩加水分解酵素活性の特性 |
| 2.12 統計分析 |
| 3. 結果 |
| 3.1 ベースラインおよびプロバイオティクス介入後の臨床的および生化学的特徴 |
| 3.2 プロバイオティクス介入による 胆汁酸への影響 |
| 3.3 プロバイオティクス介入による 線維芽細胞増殖因子-19血漿レベルへの影響 |
| 3.4 4 週間のプロバイオティクス介入による血清脂質プロファイルへの影響 |
| 3.5 背景 LDLコレステロールレベルに対するプロバイオティクスへの反応の違い |
| 3.6 プロバイオティクス介入による血清リポタンパク質の組成、直径、量への影響 |
| 3.7 プロバイオティクス介入によるリポタンパク質機能への影響 |
| 3.8 プロバイオティクス介入によるグルコース代謝マーカーとインスリン感受性指数への影響 |
| 3.9 プロバイオティクス介入による炎症マーカーへの影響 |
| 3.10 プロバイオティクスの甲状腺ホルモンおよびトリメチルアミンN-オキシドレベルへの影響 |
| 3.11 プロバイオティクスの糞便中の短鎖脂肪酸および 低分子量代謝物への影響 |
| 3.12 プロバイオティクスが腸内細菌叢の構成に与える影響 |
| 4. 考察 |
| 本文 |
| 1.はじめに |
| 動脈硬化性心血管疾患 (ACVD) は、世界中で死亡原因の第 1 位です。心血管リスク因子 (CVRF) のうち、LDLによって運ばれるコレステロール (LDLコレステロール) は、動脈硬化性心血管疾患 の進行防止に重要な影響を与える変更可能な因子の 1 つです。量に加えて、LDL 粒子のサイズも動脈硬化性心血管疾患の進行の重要な決定要因です(1)。小さくて密度の高い LDL 粒子は、大きくて浮力のある粒子と比較して、動脈壁を貫通する能力が高く、酸化されやすいため(2)、 アテローム性プラークの進行に寄与します。さまざまな研究により、低密度 LDL (sdLDL) の量が多い人は、アテローム性心血管疾患および心筋梗塞のリスクが高いことが示されています(3)。 |
| 高コレステロール血症の治療では、食事や生活習慣に関する推奨事項が第一の処理としてよく使用されます(4,5)。既存のガイドラインに従って薬物療法の対象となる人の場合、スタチンは高血漿LDLコレステロールレベルを下げ、心血管疾患のリスクを下げるための標準的な治療法です(6 )。ただし、個人が健康的な食事や全体的な生活習慣を守っているにもかかわらず、高コレステロール血症の管理では非薬物療法が第一段階として推奨されます。 |
| 脂質代謝の調節と制御におけるプロバイオティクスの潜在的な役割は、近年大きな関心を集めています(7,8)。プロバイオティクスは、適切な量を投与すると宿主に健康上の利益をもたらす生きた微生物として定義されています(9)。しかし、異なるプロバイオティクス株は独自の特性を示すため、治療特性を持つサプリメントとして投与するための特定の適応症を探す際には、株固有の効果を考慮する必要があります(10)。 |
| プロバイオティクスのコレステロール低下効果は、腸内の胆汁酸代謝の調節によって媒介されるようです(11,12)。ただし、コレステロール低下に関与するメカニズムと株固有のプロバイオティクスの効果についてさらに理解を深めることは、人間の健康保護におけるプロバイオティクスの正当な使用を推進するために必要です。 |
| 胆汁酸はコレステロールの異化作用から得られる分子生成物です。これらは肝臓で合成され (一次胆汁酸)、通常は脂質吸収を促進するために十二指腸に分泌される前にアミノ酸のグリシンまたはタウリン (一次抱合胆汁酸) と結合します(13)。抱合胆汁酸は、トリグリセリド、コレステロール、場合によってはグルコースの恒常性を含む全身の内分泌機能を制御するシグナル伝達分子として機能し、直接的な抗菌作用があります(11,14)。胆汁酸は、腸肝循環によって通常の条件下で効率的に保存されます。一次 胆汁酸は腸内細菌叢によって改変され、脱水酸化、脱水素化、硫酸化によって二次および三次形態を生成します(11)。重要なことに、健康な腸内細菌叢のメンバーは、細菌の胆汁酸塩加水分解酵素によって触媒される普遍的な反応を介して 胆汁酸の異化を開始し(15)、最終的に非抱合胆汁酸が生成されます。 |
| 特定のプロバイオティクス、特にLactobacillus属(広義)は、胆汁酸塩加水分解酵素活性を示しています(16 )。この活性は、特定のシグナル伝達経路の活性化を通じて、宿主の脂質代謝とコレステロール値に影響を及ぼす可能性があります(14,17)。胆汁酸塩加水分解酵素は胆汁酸塩を脱抱合して吸収されにくくし、肝臓での胆汁酸塩の de novo(訳者注:「新たに」という意味のラテン語) 合成の活性化を誘発して、コレステロール貯蔵の動員を高め、血漿コレステロール値の低下を促進します(17 )。このプロセスは、ヒトの核ファルネソイド X 受容体(FXR)/線維芽細胞増殖因子-19(FGF-19)フィードバック ループ(マウスでは FXR/FGF-15)など、エネルギーと脂質代謝の重要な調節因子のダウンレギュレーションを意味します(17)。 |
| Lactiplantibacillus plantarum (L. plantarum) 株 KABP011、KABP012、および KABP013 は、動物実験で総コレステロール (TC) と LDLコレステロールを低下させることが示されているプロバイオティクス処方 AB-LIFE® (訳者注:AB-LIFEは臨床試験にて、LDL−コレステロールと中性脂肪の両方を下げる働きが報告されています)に適合しています(18)。二次性高コレステロール血症の成人を対象としたこのプロバイオティクスの予備研究では、12 週間の介入後に 総コレステロールレベルの低下が示されました(19)。これらの L. plantarum 株 (KABP011、KABP012、および KABP013) の組み合わせは、以前に他の参照株と比較して高い胆汁酸塩加水分解酵素活性を示し、胆汁酸塩存在下での in vitro 研究で培地からコレステロールを除去する高い能力を示しました(20)。これらの調査結果から、コレステロール低下に対する AB-LIFE® の効果は、プロバイオティクスの定期的な経口摂取によって生じる 胆汁酸プロファイルの変化によって誘発される可能性があるという仮説が導き出されました。 |
| この証拠に基づいて、私たちは、KABP011、KABP012、および KABP013 株 (AB-LIFE®) を含む L. plantarum 製剤による 4 週間の介入が、健康だが体重過多のボランティアに投与された場合に胆汁酸プールを調整し、循環リポタンパク質や炎症性分子などの全身パラメータを調節するかどうかを調査するためのメカニズム研究を設計しました。 |
| 2. 方法 |
| 詳細については、オンラインの補足資料「材料と方法」を参照してください。 |
| 2.1 被験者 |
| 25~60歳の太りすぎ(BMI 25.0~29.9 kg/m2)の健康なボランティア(N = 20、男性10名、女性10名)が研究に参加しました。慢性疾患のある被験者、脂質低下薬、ベータ遮断薬、利尿薬、抗生物質による治療を受けている被験者、心血管疾患の病歴のある被験者は除外しました(詳細についてはオンライン補足資料をご覧ください)。 |
| 2.2 研究デザイン |
| 介入試験は、2 週間の慣らし期間の後に 4 週間の介入期間を設けた、単一施設、単一群、用量漸増縦断研究で構成されていました (オンライン補足資料、図 S1 を参照)。したがって、すべての被験者は、市販製品 (AB-LIFE®) を参照する 3 つの L. plantarum 株 KABP011 (CECT 7527)、KABP012 (CECT 7528)、および KABP013 (CECT 7529) の組み合わせの用量を漸増しながら、7 日間の治療を 4 回受けました。 各カプセルには 1.2 × 109 コロニー形成単位 (CFU) が含まれています。プロバイオティクス ミックスの最低用量は、最初の 1 週間は 1 日 1 カプセルで、高コレステロール血症の被験者を対象とした以前のランダム化臨床試験研究に基づいて選択されました。この研究では、L. plantarum KABP011、KABP012、および KABP013 のこの用量を 6 週間および 12 週間投与した後、血漿コレステロール値の低下に有効であることが示されました(19)。最初の週から、用量依存効果が確認できるかどうかを調べるために、用量は最初の用量の 2 倍、3 倍、4 倍の割合で毎週増加されました。 この研究は、Hospital Santa Creu i Sant Pau の倫理委員会 (コード IIBSP-PRO-2019-122) によって承認され、Clinicaltrials. gov (NCT05378230) に登録されました。研究に参加する前に、すべての参加者から書面によるインフォームド コンセントを得ました。 |
| 2.3 生物学的サンプル |
| 空腹時の血液サンプルは、ベースライン(0 日目)と各介入期間の終了時(7、14、21、28 日目)の午前 8 時から 11 時まで、抗凝固剤を使用せず、クエン酸とエチレンジアミン四酢酸(EDTA)を含む真空チューブを使用して採取されました。各個人のスポット便サンプルは、提供者の指示に従って、0 日目(-1 日目)の 24 時間前と 28 日目(研究の最終日)の 24 時間前に、OMNIgene-GUT チューブ(微生物叢分析)に直接採取されました。 |
| 2.4 人体計測データ、血圧、血清脂質プロファイル、その他の生化学測定 |
| 人体計測、血圧、血清脂質プロファイル、および生化学測定は、ベースラインと 7、14、21、28 日目に測定されました(オンラインの補足資料、図 S1 を参照)。血清生化学測定は、サンパウ病院の中央分析研究所で、グルコース、総胆汁酸、肝臓および腎臓マーカー、C反応性タンパク質(CRP)、および標準血清脂質プロファイル(トリグリセリド、総コレステロール、およびHDLコレステロール)の市販の日常的なアッセイを使用して実施されました。LDLコレステロールおよび超LDLコレステロール(VLDL)は、フリードワルドの式を使用して計算されました。甲状腺ホルモンは化学発光免疫測定法で、リポタンパク質A [Lp(a)] は免疫比濁法で測定されました。 |
| 2.5 血清および糞便中の胆汁酸プロファイルの分析 |
| 血清および糞便サンプル中の 胆汁酸プロファイル (一次/二次および非結合型/結合型胆汁酸) は、代謝物をメタノールで抽出した後、超高速液体クロマトグラフィー質量分析 (UHPLC-MS) によって分析され(21 )、TargetLynx アプリケーションマネージャー (Waters Corp.) を使用してデータが処理されました(22 )。オンライン補足資料の図 S2 にまとめられています。 |
| 2.6 1H核磁気共鳴法によるリポタンパク質、糖タンパク質、脂質、低分子量代謝物の代謝プロファイル |
| 循環する超低密度、低密度、高密度のリポタンパク質(VLDL、LDL、HDL)、糖タンパク質(Glyc)、低分子量代謝物(LMWM)、短鎖脂肪酸(SCFA)の数とサイズを、Mallolら(24)が以前に説明した縦方向渦電流遅延(LED)パルススペクトルを備えたLiposcale®テスト(Biosfer Teslab)(23)を使用して高解像度1H核磁気共鳴(NMR)分光法で測定した。 |
| 2.7 リポタンパク質の機能性 |
| LDL(密度範囲 1.019~1.063 g/mL)および HDL(密度範囲 1.063~1.210 g/mL)の精製画分は、前述のように、プロバイオティクス介入中のベースラインおよび 14 日目と 28 日目に、連続超遠心分離によって血漿 EDTA(訳者注:エチレンジアミン四酢酸) から取得されました(25)。 総ラジカル捕捉能(TRAP)アッセイで使用する LDL は、正脂肪血症の被験者から得られた血漿プールから分離され、上記のように取得されました。 LDL の酸化感受性は、血漿精製 LDL を銅イオンとともに in vitro でインキュベートして評価し、生成された共役ジエンの最大量 (CDmax) と半最大値酸化値に達するまでの時間 (半最大値までの時間) として表しました(25 )。HDL の抗酸化能は、前述のように、HDL 存在下での LDL の酸化感受性の変化 (LDL 粒子の酸化率) を測定する TRAP テストを実施することで評価しました(25,26)。 HDLコレステロール排出能力は、前述のように、コレステロールを負荷したマウスマクロファージで in vitro で測定しました(26,27)。 |
| 2.8 免疫測定 |
| 市販のサンドイッチベースの酵素結合免疫吸着測定 (ELISA) キットを使用して、アポリポタンパク質 B-48 (ApoB48) および B-100 (ApoB100) (Cloud-Clone Corp.)、アディポネクチン、インスリン、インターロイキン (IL) IL-1β および IL-6 (R&D Systems)、レプチン、線維芽細胞増殖因子-19((ABCAM) の血清レベルを測定しました。 IL-8、IL-12、IL-17A、および腫瘍壊死因子アルファ(TNF-α)の血漿レベルは、ミリポアのMILLIPLEX MAP高感度ヒトサイトカインキット(Millipore Corporation, Billerica)を使用して定量化されました。すべての手順は製造元の指示に従って実行されました。 |
| 2.9 トリメチルアミン N-オキシド |
| トリメチルアミンN-オキシド (TMAO) 分析は、ポジティブモードで動作するエレクトロスプレーイオン源 (LC-ESI-QqQ) を備えたトリプル四重極質量分析計と超高速液体クロマトグラフィーを組み合わせて実施しました。EDTA 血漿サンプルは、分析前にアセトニトリル/メタノールで抽出されました。 |
| 2.10 微生物叢分析 |
| 0 日目と 28 日目に、MoBio の土壌 DNA 分離キット (Qiagen) を使用して糞便サンプルから DNA を抽出しました。細菌の 16S rRNA 遺伝子は、V3-V4 領域 (515F および 806R) で増幅され、MiSeq (Illumina) で配列決定されました。Fastq ファイルは、QIIME2 ソフトウェア パッケージを使用して品質フィルタリングされ、操作分類単位 (OTU) にクラスター化され、Silva データベース v.138 でトレーニングされたベイジアン分類器を使用して分類されました。いくつかの多様性指標が計算されました。アルファ多様性の場合は OTU の数と Shannon 指数、ベータ多様性の場合は Bray–Curtis 指数と Jaccard 指数です。0 日目と 28 日目の間のアルファ多様性の変化は、ペアサンプルの Wilcoxon テストで評価され、ベータ多様性の変化は主座標分析 (PCoA) と PERMANOVA で評価されました。最後に、各分類レベルでの分析の多重性を補正するために、偽発見率 (FDR) しきい値 0.128 を使用して、ペアサンプルのウィルコクソン検定によって分類群の差異的存在量が評価されました。 |
| 2.11 AB-LIFE 株の胆汁酸塩加水分解酵素活性の特性 |
| L. plantarum フォーミュラ (株 KABP011、KABP012、および KABP013; 1:1:1) の胆汁酸塩加水分解酵素活性を in vitro で測定しました。簡単に説明すると、グリココール酸 (GCA)、タウロコール酸 (TCA)、グリコケノデオキシコール酸 (GCDCA)、およびタウロケノデオキシコール酸 (TCDCA) を含むグリコ結合およびタウロ結合胆汁酸(5 mM) を、MRS 培地 0.5× で 1 × 108 CFU の細菌懸濁液 (L. plantarum 株) の存在下で嫌気状態で 90 分間培養しました。胆汁酸塩加水分解酵素活性は、市販のキット (Abcam) を使用して、製造元の指示に従って、培養期間の終了時に遊離タウリンおよびグリシンのレベルを測定することで決定しました。陰性対照懸濁液には、MRS 0.5×、MRS 0.5× + BS(5 mM)、およびMRS 0.5× + 細菌(1 × 108 CFU)が含まれ、それらの吸光度値は試験懸濁液から差し引かれました。陽性対照懸濁液には、MRS 0.5× + タウリンまたはグリシン(5 mM)が含まれ、それらの吸光度値は100%脱抱合活性とみなされました。 |
| 2.12 統計分析 |
| データは、定量的変数の中央値と四分位範囲 (IQR) として表されます。個々の平均変化は、各介入期間の終了時に各変数と被験者の変化をベースラインと比較した平均値として計算されました。 差異の統計分析は、独立グループのノンパラメトリック検定、一対比較、多重反復測定、またはパラメトリック 1 サンプル t 検定によって実施されました。連続変数間の相関は、示されているように、スピアマン係数またはピアソン係数によって評価されました。統計分析は、STATA 15 および StatView 5.0.1 ソフトウェアを使用して実施されました。P 値 (両側) < 0.05 は有意であるとみなされました。 |
| 3. 結果 |
| 3.1 ベースラインおよびプロバイオティクス介入後の臨床的および生化学的特徴 |
| 研究のために募集された 20 人の被験者 (男性 10 人、女性 10 人) は、年齢の中央値 (Q1、Q3) が 44 (37.5、47.5) 歳で、4 週間の介入期間を完了し、分析に含められました。オンラインの補足資料である表 S1 には、ベースライン、慣らし期間後 (0 日目)、および 4 週間の介入期間中の各研究フェーズ終了時 (7、14、21、28 日目) の研究対象集団の特徴 (人体計測値、血行動態、肝臓、腎臓の変数) が示されています。 |
| 研究対象者は太りすぎで、BMIの中央値は26.5(25.4~29.7)kg/m2、ウエスト周囲径の中央値は男性で97.5(86.0、106.0)cm、女性で89.5(78.0、92.0)cmでした。参加者には慢性疾患や心血管リスク因子を持つ者も、薬物治療を受けている者もいませんでした(除外理由)。 |
| プロバイオティクス製品の摂取は忍容性が高く、介入期間中に重大な健康問題を訴えた参加者はいませんでした。参加者の毎週の電話によるコントロールへの回答と、返却された個人日記とカプセル容器によると、各介入期間の遵守率は 99% 以上と判断されました。 |
| プロバイオティクス介入による人体測定パラメータへの影響は、臨床的に関連性がないようです。介入期間中、BMI は過体重範囲 (25.0~29.9 kg/m2) 内で安定していましたが、ウエスト周囲径は有意に減少傾向を示しました (P = 0.025)。 |
| 収縮期血圧および拡張期血圧(mmHg)や心拍数(拍/分)などの血行動態パラメータは、介入期間中、正常な生理学的範囲内にとどまりました。さらに、Lactiplantibacillus spp.混合物による4週間の介入では、肝臓(アラニンアミノトランスフェラーゼ(ALT)、アスパラギン酸アミノトランスフェラーゼ(AST)、GGT(訳者注:γ-グルタミルトランスペプチダーゼ)、腎臓(尿素、尿酸)、および筋肉(クレアチンキナーゼ)機能の生化学的マーカーに大きな変化は見られず、正常な生理学的範囲内にとどまりました。介入期間中、正常範囲内でグルコースおよびクレアチニンレベルにわずかな変化が見られました(P < 0.05)。ただし、これらはプロバイオティクスの投与量や介入期間の長さ/投与量と一貫して関連していませんでした。 |
| 3.2 プロバイオティクス介入による 胆汁酸への影響 |
| 血清中の胆汁酸の総レベルは、各介入期間の終了時に比色酵素アッセイによって測定されました (オンライン補足資料、図 S1 を参照)。胆汁酸含有量の個々の縦断的変化を分析すると、介入の 7 日目から一貫した減少が見られ、プロバイオティクス摂取の 2 週目以降に統計的に有意な減少が見られました (図 1A)。 |
| 血清中の胆汁酸の超高速液体クロマトグラフィー質量分析により、非結合型およびタウリン結合型およびグリシン結合型の種が検出されました(オンライン補足資料、表S2を参照)。非結合型胆汁酸の血清レベルは変化しませんでしたが、結合型胆汁酸はプロバイオティクス摂取に応じて大幅に減少し(図1Bおよびオンライン補足資料、表S2)、介入期間中に徐々に減少しました(14日目、ベースラインと比較して1.4倍の減少、P = 0.007、28日目、ベースラインと比較して1.7倍の減少、P = 0.006)。結合型胆汁酸のうち、一次および二次形態はプロバイオティクス介入に対して同様の反応を示し(それぞれP = 0.011およびP = 0.008)、被験者の75%以上で両方の胆汁酸サブタイプの中央値の減少を示しました(図1C)。 |
| 非結合型胆汁酸と結合型胆汁酸の比率は、14 日目と 28 日目にそれぞれ 1.5 倍 (P = 0.057) と 2 倍 (P = 0.033) 増加しました (図 1D)。一方、一次胆汁酸と二次胆汁酸の比率を計算した場合には、有意な変化は認められませんでした (図 1E)。一次胆汁酸の循環血中濃度は二次胆汁酸の循環血中濃度と有意に相関していました (Rho: 0.875、P < 0.001)。非結合型 胆汁酸と結合型胆汁酸を個別に分析した場合も、同様の相関が認められました (Rho: それぞれ 0.800 と 0.750、P < 0.001)。 |
| 胆汁酸の糞便中への排泄は、ベースライン (0 日目) と介入期間終了時の 28 日目に比較分析されました。糞便中の非結合型 胆汁酸の量 (相対強度/mg 乾燥組織) は、結合型 胆汁酸 の量よりも有意に高く (P = 0.048)、ベースラインと介入期間終了時の比率は同様でした (それぞれ 2.3 倍と 2.2 倍、オンライン補足資料、表 S3)。非結合型二次胆汁酸は糞便中に最も多く含まれており、一次胆汁酸と比較して 2 ~ 3 倍の量でした。血清では検出されなかったリトコール酸と 12-オキシリトコール酸は、糞便中の非結合型二次胆汁酸のそれぞれ 32.7% と 33.1% (中央値) を占めました。対照的に、血清中に最も多く含まれる二次胆汁酸であるデオキシコール酸は、糞便中の非結合型二次胆汁酸のわずか3.7%を占めるに過ぎませんでした。 |
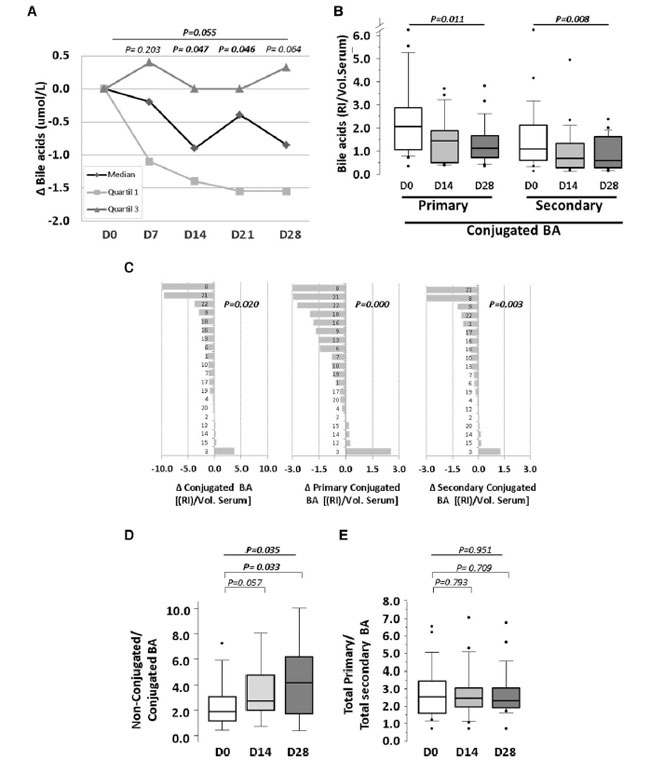 |
図 1 4 週間のプロバイオティクス介入による血清胆汁酸レベルへの影響。 (A) 比色酵素アッセイで測定した総胆汁酸の中央値、四分位数 1、四分位数 3 のセルライン チャート。 (B) 超高速液体クロマトグラフィー質量分析で測定した結合胆汁酸のボックス プロット。 (C) 総結合 胆汁酸および一次および二次結合 胆汁酸の個々の平均変化。 (D) 非結合/結合 胆汁酸の比率のボックス プロットと (E) 総一次/総二次胆汁酸の比率。 P 値: (A) Wilcoxon の符号順位検定。(B) 反復測定の Friedman のノンパラメトリック検定。(C) 1 つのサンプルの Student t 検定。(D および E) 反復測定の Wilcoxon の符号順位検定と Friedman のノンパラメトリック検定。統計的有意性: P < 0.05。各パネルのすべての時点で N = 20。 D:日、RI:相対強度、Vol:血清、血清の量、Δ:変化。 |
| プロバイオティクス介入後、糞便1mgあたりの胆汁酸量に大きな変化はなく、28日目に減少傾向を示した唯一の胆汁酸代謝物は12-オキシリトコール酸でした(ベースラインと比較してP = 0.052)。 |
| プロバイオティクス配合物の 4 つの主要なヒト 胆汁酸に対する 胆汁酸塩加水分解酵素活性を in vitro で分析しました (オンライン補足資料、図 S3 を参照)。プロバイオティクス混合物は、グリココール酸、グリコケノデオキシコール酸、タウロコール酸、およびタウロケノデオキシコール酸に対してそれぞれ 22%、20%、2%、および 3% の脱抱合活性を示しました。 |
| 3.3 プロバイオティクス介入による 線維芽細胞増殖因子-19血漿レベルへの影響 |
| 全身レベルでの血漿線維芽細胞増殖因子-19の定量分析 (ELISA アッセイ) では、プロバイオティクス介入中に減少傾向が見られ、介入期間終了時の線維芽細胞増殖因子-19レベルはベースライン (P = 0.011) および 14 日目 (P = 0.040) のレベルと比較して大幅に減少しました (図 2A および B)。血漿ベースライン 線維芽細胞増殖因子-19値は 胆汁酸と相関しませんでしたが、プロバイオティクス介入に対する 胆汁酸と 線維芽細胞増殖因子-19の変化の間には有意な相関が見られました (図 2C)。 |
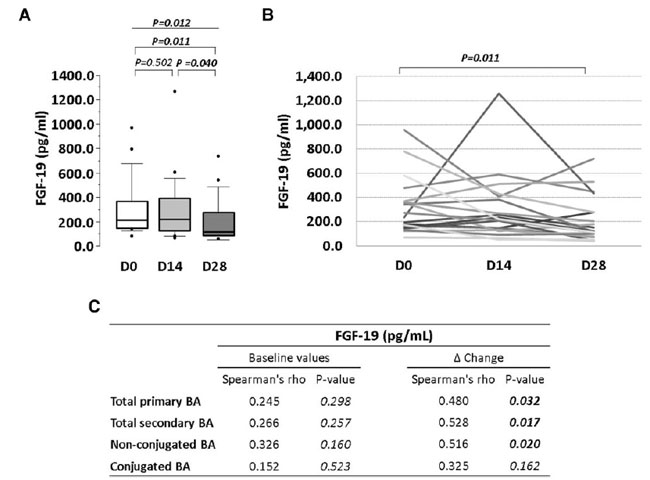 |
図 2 4 週間のプロバイオティクス介入による血漿中の FGF-19 レベルへの影響。 (A) 介入期間中の FGF-19 レベルのボックス プロット。(B) 各個人の FGF-19 レベルの細胞線グラフ。(C) FGF-19 平均変化と、総一次胆汁酸、総二次胆汁酸、非結合型胆汁酸、結合型 胆汁酸 の平均変化とのスピアマン相関表。P 値: (A) 反復測定のフリードマン ノンパラメトリック検定、(A および B) ウィルコクソン符号順位検定、(C) スピアマンの順位相関係数検定。統計的有意性: P < 0.05。各パネルのすべての時点で N = 20。 FGF:線維芽細胞増殖因子、BA:胆汁酸、D:日。 |
| 3.4 4 週間のプロバイオティクス介入による血清脂質プロファイルへの影響 |
| 血清脂質濃度の中央値は、ベースラインと各介入期間 (7 日目、14 日目、21 日目、28 日目) について、オンライン補足資料の表 S4 にまとめられています。 |
| 介入期間中、非 HDLコレステロール および LDLコレステロール レベルの個々の変化は減少傾向を示しました。ベースラインと比較すると、脂質値の最大の低下は、プロバイオティクスを 1 日 1 カプセル投与した 1 週間の介入後に確認され (図 3)、非 HDLコレステロール で有意な変化が見られました [−6.2 (−13.9; 2.9; P = 0.033) mg/dL]。 |
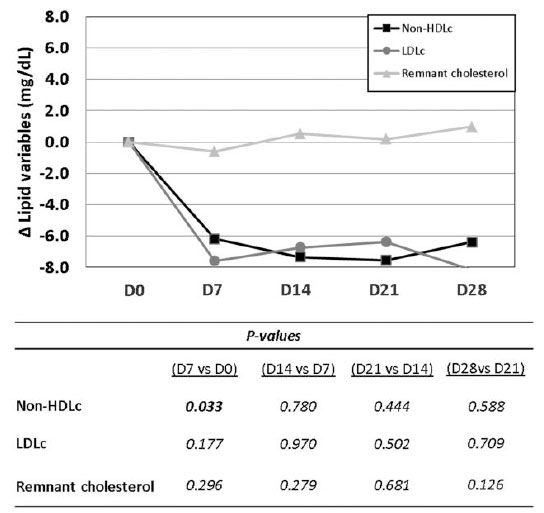 |
図 3 4 週間のプロバイオティクス介入による脂質レベルへの影響。 プロバイオティクス介入期間中の血清非 HDLコレステロール、LDLコレステロール、および残留コレステロールのベースラインに対する中央値の変化を表すセルラインチャート。 表の P 値は、ベースラインに対する 1 つのポイントでの変化と、ベースラインに対する前のポイントでの変化、つまり (D14–D0) レベルと (D7–D0) レベルとの間の Wilcoxon 符号付き順位検定に対応します。統計的有意性: P < 0.05。すべての時点で N = 20。 Δ:変化、D:日、HDLc:高密度リポタンパク質コレステロール、LDLc:低密度リポタンパク質コレステロール。 |
| 空腹時血漿中の アポリポタンパク質B100 および アポリポタンパク質B48 レベルは、プロバイオティクスによる最初の 1 週間の介入後に大幅に減少し、介入期間全体を通じて投与されたプロバイオティクスの用量とは無関係に、レベルは低下したまま維持されました (図 4A および B)。プロバイオティクスに関連したアポリポタンパク質B48 の減少は、介入期間の 14 日目と 28 日目に 20 人の被験者のうち 19 人で確認されました (図 4C および D)。 |
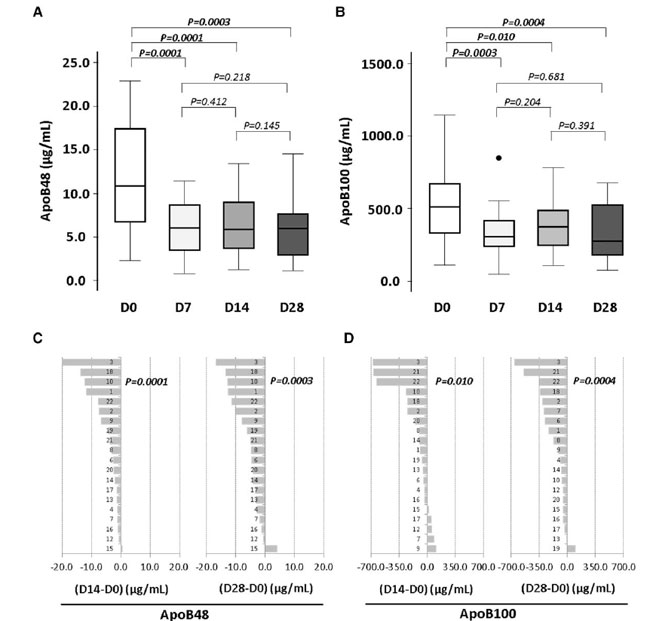 |
図 4 プロバイオティクスによる 4 週間の介入が アポリポタンパク質B レベルに及ぼす影響。 ボックス プロットは (A) アポリポタンパク質B48 と (B) アポリポタンパク質B100 のレベルを表します。プロバイオティクス介入中の (C) アポリポタンパク質B48 と (D) アポリポタンパク質B100 の個々の平均変化。P 値: Wilcoxon 符号付き順位検定。統計的有意性: P < 0.05。各パネルのすべての時点の N = 20。 Apo:アポリポタンパク質、D:日。 |
| 研究対象集団のリポタンパク質Aレベルの中央値(Q1~Q3)は15.2(8.1~37.9)mg/dLでした。プロバイオティクスによる4週間の介入中にリポタンパク質Aレベルの有意な変化は認められませんでした(オンライン補足資料、表S4を参照)。 |
| 3.5 背景 LDLコレステロールレベルに対するプロバイオティクスへの反応の違い |
| ベースラインで LDLコレステロールレベルが高かった患者のサブグループでプロバイオティクスの効果をテストしました。ベースラインでの低 LDL および高 LDL グループの BMI と脂質プロファイルは、オンライン補足資料の表 S5A に示されています。プロバイオティクス摂取後、高 LDLコレステロールグループ [中央値 144.6 (139.6; 152.4) mg/dL] は、低 LDLコレステロールグループ [中央値 96.5 (80.9; 119.4) mg/dL] よりも非 HDLコレステロール および LDLコレステロールレベルの低下が大きく見られました。効果は 7 日目にすでに明らかで、介入期間全体を通じて安定していました (オンライン補足資料の図 S4 を参照)。 |
| ベースラインでは、背景 LDLコレステロールレベルが低い被験者と高い被験者の間で 胆汁酸 サブタイプと 線維芽細胞増殖因子 に差は見られませんでした (オンライン補足資料、表 S5B を参照)。総抱合型 胆汁酸とその一次および二次サブタイプは、低 LDLコレステロールグループと高 LDLコレステロール グループの両方で減少傾向を示しましたが、後者でのみ統計的に有意でした (オンライン補足資料、表 S6A を参照)。線維芽細胞増殖因子の変化は、減少傾向ではあるものの、2 つの LDLコレステロール サブグループで個別に分析すると、より高い変動性を示し、LDLコレステロールが 130 mg/dL 未満の被験者で差は統計的に有意でした (P = 0.045、オンライン補足資料、表 S6B および C)。 |
| 3.6 プロバイオティクス介入による血清リポタンパク質の組成、直径、量への影響 |
| リポタンパク質のサイズ(直径、nm)と量(nmol/L)は、ベースライン、介入開始2週間後、介入開始4週間後にNMRで測定されました(オンライン補足資料、表S7AおよびBを参照)。介入期間終了時にはLDL粒子の中央直径が有意に大きくなっていました(P = 0.036)(図5A)が、介入期間中、HDL粒子とVLDL粒子の直径は有意に変化しませんでした。 |
| リポタンパク質をサイズ(小、中、大)ごとにサブグループ分けすると、4週間の介入期間後に小サイズ(直径:17.5~20.5 nm)のLDL数の大幅な減少が観察されました(図5Bおよびオンライン補足資料、表S7B)。この減少は、介入14日目に研究対象集団の70%以上で明らかでした(P = 0.019)(図5CおよびD)。中サイズおよび大サイズのLDLサブグループ(オンライン補足資料、表S7Bを参照)では、VLDLでもHDLでも変化は検出されませんでした。 |
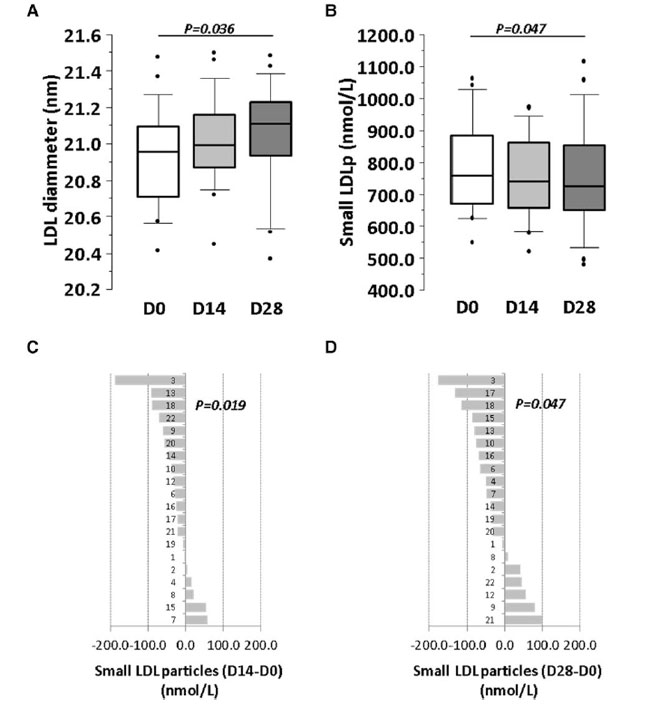 |
図 5 プロバイオティクスによる 4 週間の介入が LDL リポタンパク質に与える影響。 ベースラインと 14 日目および 28 日目の (A) LDL 直径と (B) 小型 LDL 粒子濃度を表すボックス プロット。(C および D) 0 日目と比較した (B) 14 日目と (C) 28 日目の小型 LDL 粒子数の個人差。P 値: (A および B) 反復測定のフリードマン ノンパラメトリック検定。(C および D) 1 サンプルのスチューデント t 検定。統計的有意性: P < 0.05。各パネルのすべての時点で N = 20。 LDL:低密度リポタンパク質、D:日。 |
| 3.7 プロバイオティクス介入によるリポタンパク質機能への影響 |
| プロバイオティクス介入により、LDL の酸化感受性が有意に低下したことがわかりました (P < 0.001) (図 6A)。重要なことに、参加者の 85% において、L. plantarum 混合物の摂取により、LDL 酸化の半分に達するのに必要な時間が徐々に長くなりました (D14、P = 0.019、および D28、P < 0.001、両方ともベースラインと比較) (P < 0.001) (図 6B)。 |
| 酸化に対する LDL 感受性 (CDmax) の低下は、LDL 粒子数 (nmol/L) の減少と有意に相関していました (図 6C および D)。つまり、LDL 粒子数は、ベースライン (Rho: 0.541、P = 0.014) およびプロバイオティクス介入の 14 日目 (Rho = 0.590、P = 0.006) の CDmax と相関していました。28 日目にも正の相関が見られましたが、有意には達しませんでした (Rho: 0.394、P = 0.086)。 |
| LDL粒子の酸化に対するHDLの抗酸化能を、ベースラインと介入14日後および28日後に評価した。したがって、HDLが存在する場合、ベースラインでのLDL酸化は52.5%(43.8; 55.1)に減少した。この割合は、プロバイオティクスによる介入2週間後および4週間後にさらに48.6%(42.8; 53.0)および46.7%(40.7; 49.9−(P = 0.035))に減少し、28日目の差はベースラインと比較して統計的に有意であった(P = 0.028)(図6E)。 |
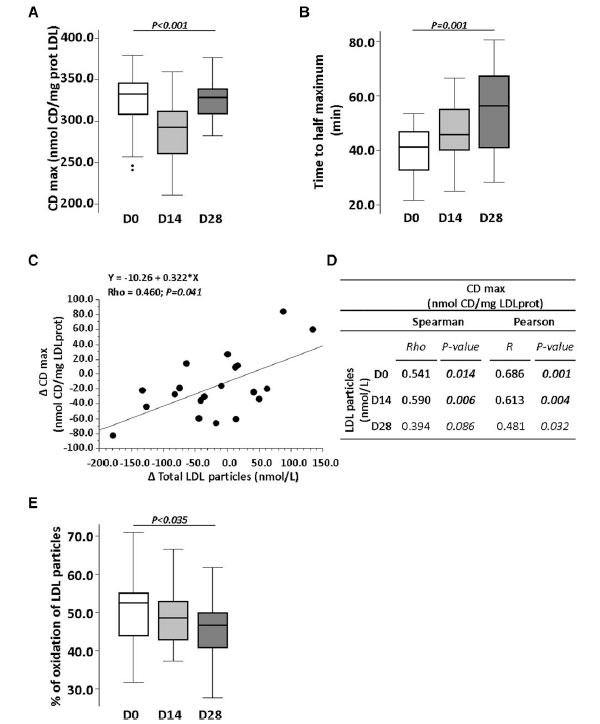 |
図 6 プロバイオティクスによる 4 週間の介入がリポタンパク質の機能性に与える影響。 ボックス プロットは、ベースラインと 14 日目および 28 日目に (A) 共役ジエン (CDmax) と (B) 半最大値酸化値に達するまでの時間 (半最大値までの時間) を表しています。 (C) 二変量散布図およびスピアマン係数とピアソン係数で表された共役ジエンの平均変化と LDL リポタンパク質の平均変化の相関。 (D) ベースラインと 14 日目および 28 日目に共役ジエンと LDL リポタンパク質レベル間のピアソン係数とスピアマン相関係数を示す表。 (E) LDL 粒子の酸化率を表すボックス プロット。P 値: (A および D) 反復測定に対するフリードマンのノンパラメトリック検定およびウィルコクソンの符号付き順位検定。 (B および C) スピアマンの順位およびピアソンの相関係数検定。統計的有意性: P < 0.05。各パネルのすべての時点で N = 20。 LDL:低密度リポタンパク質、D:日、Δ:変化。 |
| アポリポタンパク質B 除去血清が in vitro でマクロファージからのコレステロール流出を誘導する能力は、ベースラインでの アポリポタンパク質A 含有量および HDL 粒子数と直接相関していました (コレステロール流出率 vs. アポリポタンパク質A、Rho = 0.599、P = 0.005、コレステロール流出率 vs. HDL 粒子、Rho = 0.496、P = 0.026)。プロバイオティクスによる 4 週間の介入では、アポリポタンパク質B 除去血清を介したコレステロール流出率に有意な変化はありませんでした [D0、23.5% (20.2; 34.5); D14、25.1% (20.2; 30.6); D28、23.2% (20.5; 20.9)]。 |
| 3.8 プロバイオティクス介入によるグルコース代謝マーカーとインスリン感受性指数への影響 |
| インスリン、アディポネクチン、レプチンをベースライン時とプロバイオティクス介入中に定量的に分析した(表1)。 |
| 表1 プロバイオティクスによる4週間の介入中のグルコース代謝マーカーとインスリン感受性指数の変化 |
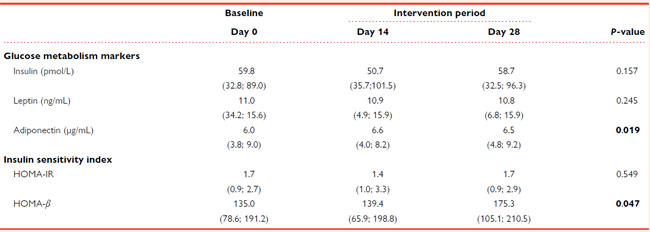 |
値は中央値 (IQR) として表されます。P 値: 反復測定のフリードマン非パラメトリック検定。統計的有意性: P < 0.05 は太字で示されます。すべての時点で N = 20。 HOMA:恒常性モデル評価、IR:インスリン抵抗性。 |
| すべての変数は、ベースラインで正常範囲内の値を示しました。プロバイオティクスの投与により、介入期間の終了時にアディポネクチン血漿レベルが有意に上昇しました (P = 0.019)。対照的に、プロバイオティクス介入による血漿インスリンおよびレプチンレベルへの影響は認められませんでした。 |
| インスリン抵抗性(HOMA-IR)を決定するために2つの標準的な恒常性モデル評価指数が計算され、プロバイオティクス介入の14日目と28日目の膵臓ベータ細胞機能(HOMA-β)とレベルがベースラインと比較されました(表1を参照)。研究対象集団のベースラインでのHOMA-IRの中央値は1.7(0.9〜2.7)、HOMA-βの中央値は135.0(78.6〜191.2)でした。HOMA-βの値はプロバイオティクス介入終了時に有意に増加し[175.3(105.1〜210.5)、ベースラインと比較してP = 0.047]、ベータ細胞機能の改善を示唆しています。 |
| 3.9 プロバイオティクス介入による炎症マーカーへの影響 |
| ベースラインおよびプロバイオティクス介入中の C反応性タンパク質の血漿レベル、サイトカイン IL-1β、IL-6、IL-8、IL-12、IL-17、TNF-α、糖タンパク質、 糖タンパク質A、糖タンパク質B の血漿レベルを表 2 に示します。研究対象集団は炎症プロファイルが低く、プロバイオティクスによる 4 週間の介入期間による影響は大きくありませんでした。この研究対象集団では、炎症関連マーカーの血漿レベルは BMI および年齢とは無関係でした。 |
| 表2 プロバイオティクスによる4週間の介入中の炎症マーカーの血漿レベル |
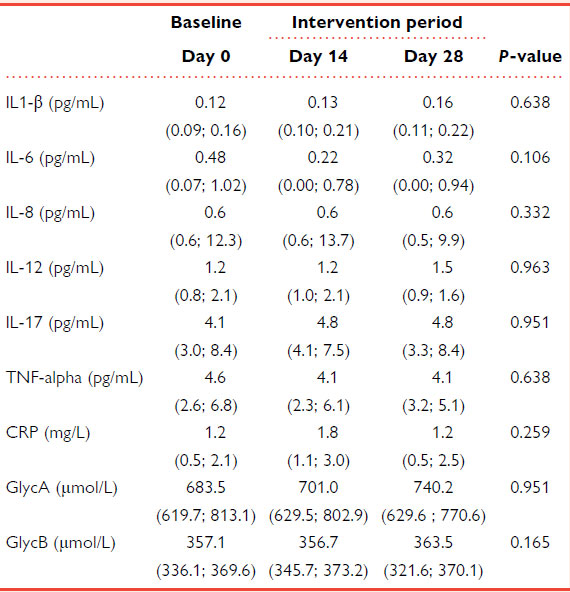 |
| 値は中央値 (IQR) として表されます。P 値: 反復測定のフリードマン非パラメトリック検定。統計的有意性: P < 0.05。すべての時点で N = 20。 |
| 各炎症性バイオマーカーの平均値をカットオフ値として用いたサブグループ解析(オンライン補足資料、表 S8 を参照)では、ベースラインで検出下限値をそれぞれ 70% と 50% 下回っていた IL-1β と IL-8 を除くすべての変数が、L. plantarum による介入の 28 日後に減少傾向(IL-6 については統計的に有意)を示したことが示された。このパターンは、炎症レベルがカットオフ値を下回った被験者では見られなかった。カットオフ値より下と上のサブグループの反応の差は、IL-6、IL-12、C反応性タンパク質、および 糖タンパク質A について有意であった。 |
| 3.10 プロバイオティクスの甲状腺ホルモンおよびトリメチルアミンN-オキシドレベルへの影響 |
| 甲状腺ホルモンおよびトリメチルアミンN-オキシド(TMAO)レベルは、オンラインの補足資料の表 S9 に記載されています。 |
| プロバイオティクス介入中、甲状腺ホルモンの血清レベルに対する影響はわずかしか見られませんでした。TSH の変化は、T4 [Rho = 0.569 (P = 0.009)] および T3 [Rho = 0.461 (P = 0.041)] の変化と正の相関関係がありました。ベースラインでは、TSH と T4 または TSH と T3 の間に相関関係は見られませんでした。 |
| トリメチルアミンN-オキシドの中央値はプロバイオティクス摂取によって変化しませんでした。ベースラインでは、被験者 20 人中 18 人の トリメチルアミンN-オキシドレベルが 4 μM 以下 (生理学的範囲 < 6 μM) で、2 人の被験者の血清値は 15 μM を超えました (CVD リスクの高範囲)。28 日目には、これら 2 人の被験者の トリメチルアミンN-オキシドレベルはベースラインと比較して 2~4 倍減少しましたが、残りの個人のトリメチルアミンN-オキシド値は生理学的範囲内で変動しました [2.3 (1.3~3.4) 対 3.4 (1.8~4.9)] μM]。 |
| 3.11 プロバイオティクスの糞便中の短鎖脂肪酸および 低分子量代謝物への影響 |
| 糞便中の 短鎖脂肪酸および 低分子量代謝物のプロファイルは、ベースラインと介入期間終了時の乾燥便サンプルで NMR によって分析されました (オンライン補足資料、表 S10 および S11 を参照)。 |
| 太りすぎの健康な集団では、酢酸、プロピオン酸、酪酸の 3 つの 短鎖脂肪酸が糞便中に多く存在し、総含有量の 97% 以上を占めていましたが、血清中に一貫して検出されたのは酢酸のみでした。プロバイオティクスによる 4 週間の介入では、糞便中の 短鎖脂肪酸含有量も血清中の 短鎖脂肪酸酢酸濃度も有意に変化しませんでした (オンライン補足資料、表 S10 を参照)。 |
| さらに、糞便中に一貫して 22 種類の低分子量代謝物が検出されました。これらには、芳香族および分岐アミノ酸 (54%)、グルコース代謝の代謝物 (14%)、ピリミジンおよびプリン代謝物 (9%)、微生物代謝物 (9%) などが含まれます。オンライン補足資料の表 S11 に示されているように、プロバイオティクス介入後、ベースラインと比較して、85% を超える代謝物の糞便中の含有量が減少傾向を示しましたが、グリシンとサルコシン (それぞれ P = 0.014 および P = 0.025) を除いて、変化は統計的に有意ではありませんでした。 血清を分析すると、グリシン濃度は生理学的範囲内(200~300 μmol/L)(29)で、ベースラインとプロバイオティクス介入後28日目との間に有意差は見られませんでした[238.9(218.5; 283.1)対237.2(218.5; 277.1)μmol/L、P > 0.05]。サルコシンは血清中で検出限界以下(未検出)でした。 |
| プロバイオティクス介入後の糞便中の代謝物の変化をよりよく理解するために、30種類の代謝物(短鎖脂肪酸を含む)の相関分析を実施しました。生成されたネットワーク(オンライン補足資料の図 S5 を参照)により、23 種類の代謝物間の関連性が明らかになりました。これらの代謝物は、プロピオン酸 短鎖脂肪酸とフェニル酢酸の相互作用によってリンクされた 2 つのクラスターに分布していました。最も大きなクラスターは、主に 2 種類の代謝物クラス、アミノ酸、および 短鎖脂肪酸で構成されており、分岐鎖 アミノ酸のロイシン、イソロイシン、チロシン、芳香族アミノ酸 のバリン、アラニン、グリシン、および 短鎖脂肪酸のプロピオン酸、酢酸、酪酸であるため、同じタイプの代謝物種間で高度な相互作用を示しました(ピアソン相関係数 > 0.80、相関の q 値 < 0.05 に基づく)。 |
| 3.12 プロバイオティクスが腸内細菌叢の構成に与える影響 |
| 0日目と28日目の糞便サンプルで検出された門とクラスの相対的な存在量は、オンライン補足資料の図S6AとBに示されており、具体的なデータとP値はオンライン補足資料の表S12に示されています。 |
| アルファおよびベータ多様性の全体的な変化は認められませんでした。しかし、プロバイオティクス介入後の微生物群のクラス別の存在量の差異を分析すると、0 日目と比較して 28 日目に採取した糞便サンプル中の Desulfurovibrio の存在量が有意に増加していることが示されました (P = 0.004、q = 0.003、FDR 補正後) (図 7)。この増加効果は目および科の分類レベルでも名目上有意でしたが (Desulfurovibrionaceae、P = 0.003)、多重性に対する FDR 補正後に有意性は失われました。さらに、名目上有意な変化は、Oscillospirales 目および 未分類_Bacilli_RF39、ならびに Oscillospiraceae 科および Oxalobacteraceae 科でも認められました。さらに、研究対象者の 60% 以上で、糞便中のBacteroides (65%)、Proteobacteria (65%)、およびActinobacteria (59%) の相対的存在量の増加が認められました。 |
| 6 つの細菌門 (Bacteroidetes, Firmicutes, Proteobacteria, Verrucomicrobiota, Actinobacteria, およびDesulfobacterota) が糞便微生物含有量の 97% を占めました。Verrucomicrobiotaを除くすべての門は、研究対象集団の 90~100% で一貫して検出されたため、プロバイオティクス介入終了時の腸内細菌種と 胆汁酸および アポリポタンパク質B の変化との関連性をさらに調査するために選択されました。 |
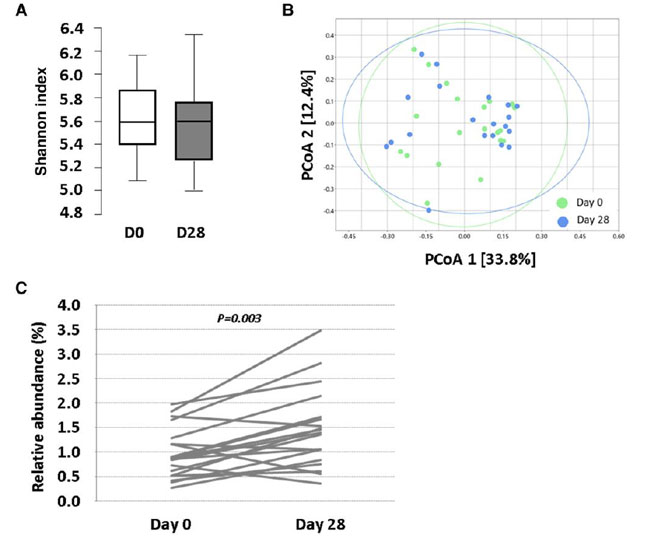 |
図 7 ベースラインと 28 日目に研究参加者の糞便サンプルの微生物叢を分析した図。 (A) アルファ多様性 (シャノン指数) を表すボックス プロット。(B) ベータ多様性 (ブレイ・カーティス類似度指数に基づく PCoA)。(C) 各個人の Desulfurovibrio クラスの相対存在率 (%) のセル線グラフ。P 値: (C) Wilcoxon 符号付き順位検定、FDR 0.10 で多重性を調整しても有意性が維持される。P < 0.05。(A および B) すべての時点で N = 20。(C) 0 時点で N = 20、28 時点で N = 19 (1 人の被験者のレベルが検出限界以下)。 D:日、PCoA:主座標分析。 |
| オンライン補足資料の表 S13 に示されているように、選択された 5 つの門のベースラインの相対的存在量は、L. plantarum 混合物による介入の 28 日後、血漿レベルで観察された総胆汁酸および結合型胆汁酸の変化、あるいは アポリポタンパク質B48 および アポリポタンパク質B100 の変化とは関連していませんでした (スピアマン相関)。ただし、プロバイオティクスに対する各細菌門の反応 (ベースラインに対する変化 > 0 および <0) によって個体をグループ化した場合、結合型胆汁酸の変化の三分位に対するBacteroideteとActinobacteria,の反応の増加と減少に関して逆の傾向分布が見られました (オンライン補足資料の図 S7 を参照)。 |
| プロバイオティクス介入後の アポリポタンパク質B48 および アポリポタンパク質B100 の減少は、L. plantarum 混合物による介入に対する腸内細菌叢 (5 つの門) の反応とは無関係でした。 |
| 4. 考察 |
| コレステロールを胆汁酸に変換することは、血清コレステロールを下げる主な方法です(30)。プロバイオティクスによるコレステロールの減少は、さまざまなメカニズムによって媒介されているようです(31)。典型的な胆汁酸塩加水分解酵素活性を持つプロバイオティクスの場合、このプロセスは、結合胆汁酸の脱結合に関連している可能性があります(32,33)。ただし、プロバイオティクス、胆汁酸代謝、およびLDLプロファイルの関係については十分に検討されておらず、人間で正確なメカニズムを証明する必要がありました |
| ここでは、過体重の健康な被験者を対象に、L. plantarum 株 KABP011、KABP012、および KABP013 (1:1:1) を含む高胆汁酸塩加水分解酵素活性のプロバイオティクス製剤の用量を段階的に増やして 4 週間介入した場合の 胆汁酸およびリポタンパク質 (組成と機能) への影響を調べる前向き介入研究を実施しました。私たちの結果は、この Lactiplantibacillus 製剤を毎日摂取すると、結合型 胆汁酸の減少、アポリポタンパク質B (アポリポタンパク質B100 および アポリポタンパク質B48) レベルの減少、小型 LDL 粒子数の減少、および LDL および HDL 粒子の抗酸化特性の改善が誘発されるという明確な証拠を示しています。これまでのところ、胆汁酸塩加水分解酵素活性プロバイオティクスによる臨床介入に基づく研究で、胆汁酸シグネチャーおよび脂質/リポタンパク質代謝への影響に言及したものはほとんどなく、明らかに議論の余地のある結果となっています(34)。 |
| 本研究の対象となった太りすぎの集団は、L. plantarum 菌株の混合物が 12 週間の介入後に総脂質レベルの低下をもたらした以前のプラセボ対照臨床試験の BMI 範囲と類似していました(19)。 この太りすぎのレベルが選択された理由は、ライフスタイルと食事の介入に従うことが推奨される軽度の高コレステロール血症 (薬物治療の必要がない) の人々を代表しているためです(12,35)。 |
| In vitroでは、L. plantarum は主要なヒトのタウリンおよびグリシン結合 胆汁酸(36,37) の生理的濃度を脱結合することができ、後者を優先することが示されました。ヒトでは、胆汁酸結合は 胆汁酸コエンザイム A「BAAT」(アミノ酸 N アシルトランスフェラーゼ)によって触媒され、グリシンよりもタウリンを優先するようです(38)。しかし、ヒトの胆汁にはタウリン形態よりもグリシン結合胆汁酸が 3 倍多く含まれており(39)、タウリンの利用可能性が de novo 胆汁酸結合の制限要因であるという考えを裏付けています。私たちの研究では、グリコ結合胆汁酸形態よりもタウロ結合胆汁酸形態の減少率が高いことが観察されました。 |
| 遊離した脱結合型 胆汁酸は溶解性が低いため、腸肝循環に再吸収されにくく、糞便中に排泄されやすくなり、肝臓での新規 BA 合成を促進します(40)。残念ながら、私たちは糞便沈着物のサンプルを採取しただけなので、プロバイオティクス介入の前後に排泄された非結合型 胆汁酸 の総量を測定することはできませんでした。プロバイオティクス介入後に小腸で生成された非結合型胆汁酸の蓄積が微生物によって検出されない形に変化したのか、それとも実際に糞便中に増加したのかについては、さらなる研究が必要です。同様に、7α/7β-脱水酸化を介して結腸内の細菌生体内変換反応によって主に生成されるリトコール酸や、腸内細菌によって二次胆汁酸から生成される胆汁酸誘導体である12-オキソ-リトコール酸などの糞便中の二次胆汁酸は、糞便中に検出されたものの、介入期間後に変化しなかったことは興味深いことです。これは、プロバイオティクス混合物が7α-脱水酸化活性を示さず(41)、したがって潜在的に有害な胆汁酸の蓄積に寄与しないことを裏付けています(42)。 |
| 線維芽細胞増殖因子-19 は、胆汁酸合成の負のフィードバック阻害を媒介する重要な代謝シグナル伝達分子としてますます認識されています。さらに、胆汁酸/線維芽細胞増殖因子-19 軸は、エネルギー代謝における重要な内分泌パートナーとして浮上しています。43,44 この研究では、プロバイオティクス摂取後に 線維芽細胞増殖因子-19 と 胆汁酸の協調的な減少を観察しました。これは、負の 線維芽細胞増殖因子調節刺激の減少により、肝臓で循環コレステロールから 胆汁酸の de novo 合成が促進されたことを示唆しています。これと一致して、豚の実験データでは、Lactobacillus delbrueckii を補充した食事を与えられた動物の回腸と肝臓の線維芽細胞増殖因子-19 発現のダウンレギュレーションが実証され、胆汁酸合成経路の律速酵素であるコレステロール 7 α-ヒドロキシラーゼ (CYP7A1) の発現の増加が伴いました(45)。 |
| 現在までに、特定のプロバイオティクスのコレステロール低下特性と、数週間の介入後の血中脂質プロファイルの改善は、特に高コレステロール血症の状態で報告されています(46)。この研究で使用されたL. plantarum株の特定の組み合わせは、12週間の介入後、高コレステロール血症患者の総コレステロールとLDLコレステロールを低下させることが示されました(19)。私たちの研究では、心血管リスク要因のない太りすぎだが健康なボランティアにおいて、1.2 × 109 CFUを含むカプセルを1日1回摂取した1週間の介入直後に、総コレステロールと非HDLコレステロールの大幅な減少が実証されています。個人レベルでの総コレステロールと非HDLコレステロールの変化の分析では、研究対象者の75%で肯定的な反応が示され、研究開始時にコレステロール値が高かった被験者グループ(包含基準に従って正常範囲内)で最も大きな効果が見られました。 |
| この研究で新たに発見されたのは、プロバイオティクス介入中に小型高密度 LDL の数が減少したことです。 私たちの知る限り、循環する小型 LDL 粒子の減少にプロバイオティクスが優先的な効果があることが証明されたのはこれが初めてです。小型 LDL 粒子は、彼らのサイズがため動脈壁透過性が高く、動脈硬化誘発能が最も高い LDL 画分です(1)。 |
| 非 HDL 画分の主なアポリポタンパク質である アポリポタンパク質B47 は、プロバイオティクス摂取によって大幅に減少しました。肝臓由来の アポリポタンパク質B-100 と小腸で発現する アポリポタンパク質B-4848 は両方とも、最初の週の介入直後に大幅に減少し、介入期間全体を通じてレベルが低下したまま維持され、プロバイオティクス誘発性総 BA の変化と同様のパターンを示しました。興味深いことに、アポリポタンパク質B-100 と アポリポタンパク質B-48 のレベルは、ベースラインおよびプロバイオティクス介入中のさまざまな時点での LDL 粒子数および LDLコレステロールレベルと有意に相関していました。これらの結果は、プロバイオティクス介入の有益な効果も腸内脂質輸送の阻害によって媒介されていることを示唆しています。プロバイオティクス誘発性の 胆汁酸/線維芽細胞増殖因子-19 軸の変化とリポタンパク質の組成およびプロファイルの変化との間の潜在的な関連性を調査するには、さらなる研究が必要です。 |
| LDL の酸化は、動脈硬化の発症の特徴です。ここでは、プロバイオティクス摂取後に、LDL の酸化感受性が大幅に低下し、HDL の動脈硬化防止特性が促進されることを観察しました。肥満マウス モデルでの実験的研究では、Lactobacillus株が脂質過酸化反応生成物マロンジアルデヒド (MDA) の循環レベルを低下させることが報告されており(49,50)、 また、in vitro 研究では、Lactobacillus属およびStreptococcus属のいくつかの酸性乳酸菌が LDL 酸化を低下させる能力があることが証明されています(51 )。さらに、Lactobacillus helveticusによる 14 週間の介入により、激しい運動を強いられ、フリーラジカルと酸化ストレスの発生が増加する一流アスリートの LDL 粒子の Cu2+ 誘発酸化が減少しました(52)。 |
| 最近の臨床研究では、アディポネクチンやレプチンなど、満腹感に関連するいくつかの因子に対するプロバイオティクスの効果について報告されていますが、決定的な結果は得られていません(53)。私たちの研究では、プロバイオティクスの投与により、介入期間の終了時にアディポネクチン血漿レベルが大幅に上昇しましたが、血漿レプチンレベルには影響がありませんでした。興味深いことに、健康な青年を対象とした横断的研究では、アディポネクチンレベルは空腹時血漿アポリポタンパク質B48レベルと逆相関しており(54)。これは私たちのプロバイオティクス介入研究でこれらの変数に見つかった変化と一致しています。アディポネクチンは白色脂肪組織から分泌され、インスリン感受性および抗炎症特性を持つと思われます(55)。炎症誘発性のベースライン条件のないボランティア(BMI < 30 kg/m2の健康で非喫煙者)を対象とした研究では、C反応性タンパク質、TNF-α、糖タンパク質A、糖タンパク質B、IL-1β、IL-6、IL-8、IL-12、IL-17などのインターロイキンを含む調査した炎症マーカーのいずれにも大きな変化は検出されませんでした。それでも、さまざまな変数の炎症ベースラインプロファイルに従って患者をサブグループ分けした場合、より顕著な炎症背景を持つ被験者はL. plantarum介入に対する反応が良く、IL-6については統計的に有意な減少傾向を示しました。私たちの研究結果と一致して、炎症マーカーは、2型糖尿病のインスリン抵抗性患者(56)やすでに確立された安定した冠動脈疾患(57–59)などの炎症誘発性背景を持つ集団集団で調査されたときに、プロバイオティクス介入によって影響を受けることが示されました。興味深いことに、12週間にわたってL. plantarum ECGC 13110402を摂取した正常から軽度の高コレステロール血症の成人を対象とした研究では、炎症マーカーは変化しませんでした(60)。 |
| 糞便微生物叢の分析により、プロバイオティクス介入は一般的な微生物叢の多様性には影響を及ぼさなかったが、タウリンを嫌気的に消費できる数少ない腸内細菌の1つであるDesulfovibrio綱のメンバーの存在量を大幅に増加させたことが明らかになった(61)。この研究で報告されているように、Desulfovibrio綱のメンバーは胆汁酸プール内のタウリンを減らし、タウリン形態の再抱合を防ぐことができる。興味深いことに、最近、脱抱合型胆汁酸が、タウリン形態が優勢なマウスにおける病原菌Clostridium difficileの定着を防ぐことが示されました(62)。私たちの研究結果と一致して、腸内細菌叢は非常に回復力のある生態系として認識されており、プロバイオティクス介入にさらされても糞便レベルではほとんど変化が見られません(63)。胆汁酸塩の吸収は遠位回腸で起こり(40,64)、そこでの微生物密度は107~108 CFU/mLであり、結腸の約1012 CFU/mLよりもはるかに低いことを考慮する必要があります(65,66)。したがって、プロバイオティクスは回腸の微生物叢(胆汁酸の再吸収が起こる場所)に大きな影響を与える可能性がありますが、糞便の微生物叢は希釈効果と結腸内の微生物ニッチの変化によりほとんど変化しません(67)。 |
| 一致して、プロバイオティクス介入後の糞便微生物叢の相対的含有量と循環する抱合胆汁酸の変化の間には統計的な相関は見られませんでした。しかし、抱合胆汁酸の最も顕著な減少は、L. plantarum混合物による介入後にActinocabteriaとBacterioidetesの相対的増加を示した個人で見られました。興味深いことに、腸内細菌叢クローン90,000個を対象とした最近の研究では、142個に胆汁酸塩加水分解酵素活性が見られ、その中にはBacteroidetes門とActinobacteria門が多く含まれていました。同じ研究で、Actinobacteriaクローンは試験したすべての糖結合型およびタウロ結合型胆汁酸を脱結合する能力があったのに対し、Bacterioidetesはタウロ結合型 胆汁酸 に対して特異的活性を示したが、糖結合型 胆汁酸に対しては示さなかった(68)。 L. plantarum 介入後の 胆汁酸結合の変化が Lactobacillus 胆汁酸塩加水分解酵素活性のみに依存するのか、それとも腸内細菌叢におけるプロバイオティクス媒介性の変化にも関連しているのかをより明確にするには、さらなる研究が必要である。 |
| 糞便微生物が微生物活動の機能的な読み出しであることを示唆する証拠が増えています(69)。この研究では、NMRによる糞便サンプルの分析により、すべての被験者で一貫して29の代謝物が検出され、アミノ酸(代謝物の41%)と短鎖脂肪酸(代謝物の24%)が濃縮されていることがわかりました。L. plantarumによる4週間の介入では、健康な被験者の糞便メタボロームプロファイルに大きな変化はありませんでした。ただし、ほとんどの代謝物は介入期間の終了時に協調的な減少傾向を示しました。私たちの結果からは、これが微生物叢によるアミノ酸と短鎖脂肪酸の利用増加または生成減少によるものなのか、それともより複雑なプロバイオティクス誘発性の宿主-微生物叢相互作用の結果なのかを結論付けることはできません。 |
| このメカニズム研究には、単群設計やサンプル数の少なさなど、検討に値するいくつかの制限がある。しかし、概念実証メカニズム研究の枠組み内での単群縦断的設計の構造的シンプルさにより、通常の食事に加えて L. plantarum 混合物介入に対する広範囲の変数の反応を同時に調査することができた。私たちの結果から、いくつかの「プラセボ」効果を排除することはできないが、この研究は介入期間を通して食事と身体活動の習慣を維持した健康な太りすぎの個人の安定したコホートで実施され、したがって参加者の自発的な変化は予見されなかったため、これらの効果は最小限であった。しかし、この研究の結果は、プロバイオティクス介入に対する 胆汁酸-リポタンパク質軸の反応に関わる分子プロセスをさらに調査するために、より大きなサンプルサイズと 2 群設計 (プラセボ群を含む) による新しい研究に値する。さらに、小規模なサンプルサイズの研究における個人間の変動から生じる可能性のあるバイアスを最小限に抑えるために、用量漸増設計における各プロバイオティクス投与期間の終了に合わせて、各参加者に対して連続測定(ベースラインおよび毎週の時点)を実施しました。 |
| 要約すると、我々の研究は、胆汁酸塩加水分解酵素活性L. plantarum株KABP011、KABP012、およびKABP013の介入により、アポリポタンパク質B100およびアポリポタンパク質B48の血漿レベルが低下し、LDL粒子のプロファイルが著しく変化して小型LDLが減少し、LDLの酸化感受性が大幅に低下し、HDLの抗酸化能が増加するという、ヒトにおける初めての証拠を提供します。プロバイオティクスによるリポタンパク質プロファイルへの影響は、胆汁酸の脱抱合および線維芽細胞増殖因子-19の循環レベルの低下を伴い、肝臓での循環コレステロールからの胆汁酸の新規合成を促進する可能性があります。本研究は、L. plantarum の 3 つの 胆汁酸塩加水分解酵素活性株 (KABP011、KABP012、および KABP013) を組み合わせた特定のプロバイオティクス製剤の導入が、アテローム性動脈硬化症に関連することが知られている代謝プロセスの制御に有益である可能性があるという考えを支持しています。 |
| 翻訳の視点 |
| Lactiplantibacillus plantarum 株 KABP011、KABP012、および KABP013 の用量を 4 週間にわたって段階的に増やす介入により、胆汁酸およびリポタンパク質プロファイルに変化が誘発され、これは太りすぎの被験者におけるアテローム性動脈硬化症に対する保護パターンと一致します。プロバイオティクスの心血管系の健康促進効果には、腸内での 胆汁酸脱抱合の増加と腸管再吸収の減少、血漿非HDLコレステロールの減少とアポリポタンパク質 B100 およびアポリポタンパク質 B48 レベルの大幅な減少、および小型 LDL 粒子の減少が含まれます。重要な点として、プロバイオティクス摂取後、LDL の酸化に対する感受性が低下し、HDL の抗酸化能力が高まります。 |
| 補足資料 |
| 補足資料はCardiovascular Research onlineで入手できます。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Cardiovascular Research (2024) 120.708–722に掲載されたLactiplantibacillus plantarum strains KABP011,KABP012, and KABP013 modulate bile acids and cholesterol metabolism in humans.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |