
Arianne Morissette et al., |
| 要約 |
| 添加糖の過剰摂取は、現在、肥満と代謝障害の世界的状況における主な原因として広く認識されています。以前の動物研究では、メープルシロップ(MS)は精製糖よりもグルコース代謝と肝臓の健康に有害ではないことが報告されていますが、そのメカニズムはまだ十分に研究されていません。メープルシロップ は、ショ糖の含有量以外にも、腸内細菌叢の調整剤として可能性のあるポリフェノールやイヌリンなどのいくつかの生理活性化合物を含む天然甘味料です。私たちの目的は、高脂肪高ショ糖(HFHS + S)食またはショ糖の一部(総カロリー摂取量の10%)をメープルシロップで置き換えた高脂肪メープルシロップ(HFHS + MS)食を与えられた雄のC57Bl/6Jマウスにおける代謝の健康と腸内細菌叢に対するメープルシロップの影響を調査することです。インスリンおよびブドウ糖耐性試験は、それぞれ食事開始から 5 週目と 7 週目に実施しました。糞便微生物叢は、全ゲノム ショットガン シークエンシングによって分析されました。肝臓脂質と炎症が測定され、肝臓遺伝子発現はトランスクリプトーム解析によって評価されました。メープル シロップは、ショ糖を摂取したマウスと比較して、インスリン抵抗性に対する有害性が低く、肝臓脂肪変性が減少しました。これは、炭水化物の消化と吸収に関与する腸管の α-グルコシダーゼ活性の低下によって説明できます。メタゲノム ショットガン シークエンシング解析により、メープルシロップ 摂取によって、ショ糖利用や酪酸生成などの炭水化物代謝に関与する遺伝子クラスターを持つ Faecalibaculum rodentium、Romboutsia ilealis、および Lactobacillus johnsonii の存在量が増加することが明らかになりました。肝臓のトランスクリプトーム解析により、高脂肪高ショ糖(HFHS + S)を摂取したマウスと 高脂肪メープルシロップ(HFHS + MS)を摂取したマウスでは、シトクロム P450 (Cyp450) エポキシゲナーゼ経路が異なって調節されていることが明らかになりました。 これらの結果は、メープルシロップをショ糖に置き換えることで、食事誘発性肥満マウスの代謝異常が緩和され、炭水化物の消化の低下と腸内細菌叢の変化が引き起こされたことを示しています。 |
| 新着&注目 |
| 天然甘味料のメープルシロップは、精製糖の代替品として大きな関心を集めています。この研究は、ショ糖を同量のメープルシロップで置き換えることによる代謝上の利点が、肥満マウスの腸内細菌叢の構成と炭水化物の消化の変化と関連しているかどうかを調査することを目的としています。私たちは、メープルシロップが代謝の健康に対してショ糖よりも有害性が低く、腸内細菌叢と肝臓の新しいメカニズムを通じてプレバイオティクスのような活性を持つことを実証しました。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.方法 |
| 2.1.動物と食事療法 |
| 2.2.グルコースおよびインスリン耐性 |
| 2.3.オイルレッドO染色 |
| 2.4.分析方法 |
| 2.5.α-グルコシダーゼ活性アッセイ |
| 2.6.盲腸の短鎖脂肪酸の定量 |
| 2.7.RNA 配列解析 |
| 2.8.糞便DNA抽出 |
| 2.9.16S rRNA 遺伝子増幅産物とショットガンメタゲノムシーケンシング |
| 2.10.アンプリコンベースの分類学的分析 |
| 2.11.メタゲノムリードの分類学的および機能的プロファイリング |
| 2.12.微生物叢分析 |
| 2.13.統計分析 |
| 3.結果 |
| 4.考察 |
| 本文 |
| 1.はじめに |
| 肥満は、代謝障害のリスクを大幅に高めるため、大きな健康上の課題となっています (1)。2020 年には、世界中の成人人口の 15% 以上が肥満 (BMI 30 kg/m2) とみなされ、この割合は 2030 年までに 18% に増加すると推定されています(2)。この憂慮すべき状況の結果、2 型糖尿病、心血管疾患、非アルコール性脂肪肝疾患、がんの患者数はますます増加しています(3)。現在では、主に加糖飲料 (SSB) (4) の形での添加糖の慢性的な過剰摂取が、この肥満の流行の主犯であることが広く認識されています (5、6)。実際のところ、世界保健機関(WHO)、米国心臓協会、医学研究所などのいくつかの科学組織は、添加糖または遊離糖の1日の上限摂取量に関する勧告を策定しています。WHOは、食品や飲料に添加される単糖類や二糖類(ショ糖など)や蜂蜜、シロップ、フルーツジュース、濃縮果汁に自然に含まれる糖類を含む精製遊離糖の摂取量を、総エネルギー摂取量の10%未満に減らすことを推奨しています(7)。 |
| 動物実験の増加により、メープルシロップ(MS)(8、9)、アガベシロップ(10)、蜂蜜(11、12)などの天然糖は、同量の精製糖と比較して、グルコース恒常性および/または脂質プロファイルに対する悪影響が少ないことが示されています。メープルシロップは、北米原産のサトウカエデ(Acer saccharum Marsh)などの特定のカエデ(Acer属)種から晩冬から早春に採取した水分の多い樹液を熱蒸発させて得られる、最小限に変化した甘味料です(13)。 メープルシロップの乾燥成分は主にショ糖 (97%) で構成されていますが、それでも私たちのグループは、メープルシロップの急性投与と慢性投与の両方が、同量の精製糖を投与された動物と比較して、肥満ラットの血糖値とインスリン反応に及ぼす悪影響が少ないことを実証しました (14、15)。さらに、以前の動物研究では、メープルシロップ抽出物が脂質代謝に関連する遺伝子の発現を変更することで肝臓の健康に良い影響を与える可能性があることが示唆されています (16–20)。これらの結果を総合すると、精製糖をメープルシロップで置き換えることがより好ましい代替手段となる可能性があることが示唆されます。 |
| メープルシロップには、アミノ酸、有機酸 (コハク酸およびフマル酸)、ミネラル (カリウム、カルシウム、マグネシウム)、ビタミン (B2 およびナイアシン) など、さまざまなマクロ栄養素およびミクロ栄養素が含まれています。また、リグナン、クマリン、スチルベンなどのポリフェノールも含まれています (21、22)。樹液を煮沸してメープルシロップを生成するプロセスでは、これらの植物化学物質が濃縮されるだけでなく、ケベコールという新しいポリフェノールが生成されることも報告されています (23)。ポリフェノールの存在は、in vitro で炭水化物加水分解酵素 α-グルコシダーゼを阻害することが示されています (24)。さらに、メープルシロップには腸内細菌叢によって特に発酵されるプレバイオティクス繊維であるイヌリンが含まれていることが以前に報告されています (25)。 |
| 過去 15 年間に、多数の研究により、腸内細菌叢と宿主代謝の機能的つながりが特定されました。その結果、腸内細菌叢、その代謝産物、および肥満、2 型糖尿病、脂肪肝疾患などの代謝障害との重要な関連性を示す証拠が増えています (26–28)。したがって、プレバイオティクスのような活性を持ち、炭水化物の消化を減らすポリフェノールの存在は、腸内細菌叢の再構築に役立ち、ショ糖をメープルシロップに置き換えることで得られる健康上の利点を説明できる可能性があります (29、30)。ただし、私たちの知る限り、メープルシロップのプレバイオティクスのような作用と、脂肪肝疾患やインスリン抵抗性などの肥満に関連する代謝障害への影響を徹底的に調査した研究はありません。 |
| この研究の目的は、食事誘発性肥満のマウスモデルにおいて、ショ糖を同等量のメープルシロップで置き換えることによる代謝上の利点が、腸内細菌叢の構成と炭水化物の腸内消化の変化と関連しているかどうかを調査することであった。 |
| 2.方法 |
| 2.1.動物と食事療法 |
| 6 週齢の C57Bl/6J 雄マウス (Jackson, Bar Harbor, ME)を、ケベック心臓肺研究所 (Qu_ebec City, QC, Canada) の動物施設で、管理された環境 (12 時間の昼夜サイクル、18:00 に消灯) で、自由に餌と水を与えられ、個別に飼育しました。低脂肪食で2週間順応させた後、マウスを低脂肪低ショ糖食(LFLS)(脂質10%、タンパク質13%、炭水化物78%)、高脂肪高ショ糖食(HFHS)(エネルギーの62.5%が脂質、14.8%がタンパク質、22.5%がショ糖)、ショ糖の一部をメープルシロップに置き換えた等カロリー高脂肪食(エネルギーの62.5%が脂質、13%がタンパク質、19%がショ糖、3.5%がメープルシロップ)のいずれかに割り当てた。高脂肪高ショ糖食を摂取したマウスには、総エネルギー摂取量の6.5%をショ糖(HFHS + S)(n = 12)またはメープルシロップ(HFHS + MS)(n = 12)も経口投与した。 低脂肪低ショ糖食(LFLS)を摂取したマウスに、媒体 (水) (LFLS + V) (n = 11) を経口投与した (表 1)。経口投与によるメープルシロップまたはショ糖から供給されるカロリーの割合 (総エネルギー摂取量の 6.5%) は、砂糖入り飲料から添加された砂糖によって供給される推定エネルギー摂取量 (31) に従って決定されたが、食事中のメープルシロップまたはショ糖から供給されるエネルギー (総エネルギー摂取量の 3.5%) は、食品に含まれる添加糖分を表している。メープルシロップは、ケベック州メープル シロップ生産者連盟から提供されたもので、エキストラライト、アンバー、ダーク シロップを同量混合したものであった。 |
| 表1. 食餌の構成 |
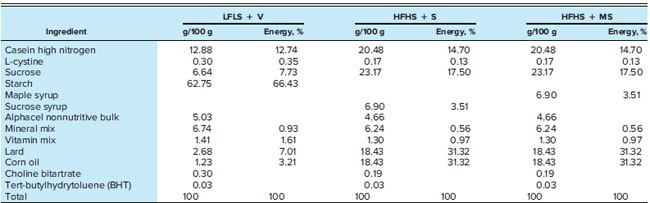 |
| 低脂肪低ショ糖と水(LFLS + V)、低脂肪低ショ糖を溶媒とともに経口投与。高脂肪高ショ糖(HFHS + S)、高脂肪高ショ糖をショ糖とともに経口投与。高脂肪メープルシロップ(HFHS + MS)、高脂肪高ショ糖をメープルシロップ (MS) とともに経口投与。 |
| 体重増加と食物摂取量は週 2 回評価しました。体組成は 0 週目と 8 週目に磁気共鳴法で分析しました (Bruker Minispec LF90II、Bruker Optics、Germany)。新鮮な糞便は 0 週目と 8 週目に収集しました。8 週目に、動物はイソフルランで飽和させたチャンバーで麻酔をかけられ、心臓穿刺により安楽死させられました。組織が採取され、EDTA でコーティングしたチューブに血液が採取され、遠心分離されました。動物の絶対的な包含基準は、皮膚炎、脱水、体重増加がないことでした。この研究は、実験動物のケアと使用に関するガイドラインに従っており、すべての手順は、ラヴァル大学動物倫理委員会 (CPAUL 2018-081-1) によって事前に承認されていました。 |
| 2.2.グルコースおよびインスリン耐性 |
| 5 週目に、マウスを 6 時間絶食させ、腹腔内インスリン耐性試験 (ITT) (0.65 U/kg 体重) を実施しました。尾静脈から血液を採取し、腹腔内インスリン注射前 (0 分) および注射後 (5、10、15、20、30、60 分) に Accu-Check 血糖測定器 (Bayer) で血糖値を測定しました。7 週目の終わりに、マウスを一晩 (12 時間) 絶食させ、経口ブドウ糖耐性試験 (OGTT) (1 g ブドウ糖/kg 体重) を実施しました。血糖値とインスリン値を測定するため、グルコースボーラス投与前(0分)と投与後(15、30、60、90、120分)に尾静脈から血液を採取しました。腹腔内インスリン耐性試験 (ITT)とブドウ糖耐性試験(GTT)については、試験後にマウスに水、ショ糖、またはメープルシロップを経口投与しました。 |
| 2.3.オイルレッドO染色 |
| 安楽死中、マウスの肝臓は Tissue-Tek OCT に包埋され、直ちに液体窒素で急速凍結され、-80℃ で保存されました。中性脂質の染色は、Mehlem ら (32) が説明した方法に基づいており、以前に説明したように (33)、いくつかの改良が加えられています。簡単に説明すると、12 mm の肝臓切片を室温で 5 分間平衡化させ、その後ホルマリン (10%)/カルシウム (2%) 溶液で 15 分間後固定しました。次に、切片をオイルレッド O (ORO) 作業溶液で室温で 5 分間インキュベートし、その後 60% イソプロピルアルコールで 5 分間透明化し、マイヤーのヘマトキシリンで 15 秒間対比染色しました。肝臓切片の写真は、染色後 30 分以内に広視野顕微鏡 (Zeiss) で撮影されました。オイルレッド O (ORO)陽性領域の定量化は、Image-Pro Plus ソフトウェアを使用して行いました。各マウスの平均 オイルレッド O (ORO)陽性切片を計算するために、同じ肝臓切片の写真 8 枚を定量化しました。 |
| 2.4.分析方法 |
| 血漿インスリン濃度は、超高感度 ELISA キット (それぞれ Alpo, Salem, NH および Chrystal Chem, Elk Grove Village, IL,) を使用して測定しました。肝臓トリグリセリドとコレステロールは、クロロホルムメタノールで抽出しました。肝臓と血漿のトリグリセリドとコレステロール含有量は、市販のキット (Randox Laboratories) を使用した酵素反応によって測定しました。サイトカインは、Bio-Plex Pro Assay Moue Cytokine (Bio-Rad) を使用して、肝臓溶解液 50 lL (0.5% ウシ血清アルブミンを含むリン酸緩衝液中のタンパク質 100 ng) で定量しました。検出限界以下のサイトカインは分析対象としませんでした。脂質過酸化は、チオバルビツール酸反応性物質 (TBARS) アッセイ キット (R&D Systems) を使用して評価しました。 |
| 2.5.α-グルコシダーゼ活性アッセイ |
| 8週齢の飼料を与えられたマウスの補助群を、動物施設で2週間順応させました。マウスは一晩絶食し、ショ糖シロップ(n ¼ 12)またはメープルシロップ(n ¼ 12)から2 g/kgの糖を経口投与しました。どちらも0.87 g/mLでした。その後、マウスは直ちに安楽死させ、腸を採取しました。回腸の10 mgの切片を200 lLの氷冷α-グルコシダーゼアッセイ緩衝液に加えました。サンプルをホモジェナイズし、上清を採取して、メーカー(Abcam)の指示に従ってα-グルコシダーゼ活性を測定しました。簡単に言うと、α-グルコシダーゼは基質混合物を加水分解してp-ニトロフェノールを放出し、これを比色法で測定します(光学密度¼ 410 nm)。光学密度は、α-グルコシダーゼ基質混合物を加える前(0)と加えた後(60分)に測定しました。 |
| 2.6.盲腸の短鎖脂肪酸の定量 |
| 盲腸の短鎖脂肪酸 (SCFA) はガスクロマトグラフィーで定量しました。リン酸は VWR から購入しました。ジエチルエーテル (99.5%) とすべての 99% グレードの標準 (酢酸、プロピオン酸、イソ酪酸、酪酸、イソ吉草酸、吉草酸、および内部標準 4-メチル吉草酸) は Sigma-Aldrich から購入しました。盲腸を収集し、抽出まで -80 ℃ で凍結保存しました。100 mg の物質あたり 1 mL の H2O を加えた後、糞便懸濁液を 2 分間ホモジナイズし、4 ℃ で 18,000 g で 10 分間遠心分離しました。上清に 4-メチル吉草酸を加え、リン酸 10% で酸性化しました。 短鎖脂肪酸を抽出するために、サンプルを等量のジエチルエーテルと 2 分間混合し、その後 4 ℃ で 18,000 g で 10 分間遠心分離しました。有機相分析は、AOC-20s オートサンプラー、AOC-20i オートインジェクター、および炎イオン化検出器を備えた GC 2010 Plus ガスクロマトグラフで構成される、炎イオン化検出器付きガスクロマトグラフィー (GC-FID) システム (島津製作所) で実施しました。システムは GC ソリューション ソフトウェアによって制御されました。短鎖脂肪酸は、Nukol キャピラリー GC カラム [30 m 0.25 mm 内径 (ID)、0.25 lM 膜厚、Supelco Analytical] で分離しました。カラム流量は水素 1.3 mL/分で一定でした。インジェクターは 230 ℃、検出器は 250 ℃ に設定されました。オーブンの温度は最初に 60 ℃ に設定され、その後 12 ℃/分で 200 ℃ まで上昇し、2 分間保持されました。短鎖脂肪酸は、酢酸、プロピオン酸、酪酸、イソ酪酸、吉草酸、イソ吉草酸、および内部標準 4-メチル吉草酸の混合物で作成された 5 点検量線を使用して定量化されました。 |
| 2.7.RNA 配列解析 |
| 肝臓は安楽死時に採取され、急速冷凍されました。RNA は Direct-zol RNA Miniprep Plus (Zymo Research) で組織から抽出され、配列解析のために Genome Qu ebec (GQ) に送られました。RNA 配列の解析は Galaxy のパブリック サーバー (usegalaxy.org) で処理されました。FASTQ 配列の品質は FASTQC (34) ツール (Galaxy バージョン 0.72) で評価され、Illumina アダプターは Cutadapt (35) (Galaxy バージョン 1.16.6) で除去されました。結果として得られた配列は RNA STAR (36) (Galaxy バージョン 2.7.5b) でマウス参照ゲノム (mm10) にマッピングされました。FeatureCounts (37) ツール (Galaxy バージョン 1.6.4) を使用して、注釈付き遺伝子あたりの読み取り数を決定しました。 高脂肪高ショ糖(HFHS + S)食マウスと 高脂肪メープルシロップ(HFHS + MS)食マウス間の差次的発現解析は、DESeq 2 (38) (Galaxy バージョン 2.11.40.6) を使用して実施しました。検出された遺伝子は、偽発見率 (FDR) 調整後の P 値が 0.05 未満の場合、差次的発現しているとみなされました。次に、結果として得られた重要な遺伝子に対して、GOseq (39) (Galaxy バージョン 1.36.0) を使用して機能エンリッチメント解析を実施し、選択されたカテゴリは、遺伝子オントロジー (GO) 細胞成分、GO 生物学的プロセス、GO 分子機能、および京都遺伝子ゲノム百科事典 (KEGG) パスウェイでした。決定された GO 用語と KEGG パスウェイは、FDR 調整後の P 値が 0.05 未満の場合に有意でした。生の RNAseq データは、次のアクセス番号を持つ European Nucleotide Archive (ENA) データベースからアクセスできます: PRJEB66211。 |
| 2.8.糞便DNA抽出 |
| 糞便サンプルは、治療開始から8週間後に新鮮に採取し、直ちに-80℃で保存しました。細菌ゲノムDNAは、各マウスから採取した糞便50mgから抽出しました。サンプルはビーズビーターと0.1mmのジルコニウムビーズを使用して均質化し、DNA抽出キット(Zymo Research、カリフォルニア)を使用して処理しました。DNA収量は、NanoDrop ND-1000分光光度計(Thermo Scientific)を使用して評価しました。抽出したDNAは、使用時まで-20℃で保存しました。 |
| 2.9.16S rRNA 遺伝子増幅産物とショットガンメタゲノムシーケンシング |
| 各 DNA サンプルは、その後、トランスポゾンベースの Illumina Nextera アダプター (Illumina、California) と、Institut de Biologie Int egrative et des Syst emes (IBIS、Universit_e Laval) でのマルチプレックス ペアエンド シーケンシングを可能にするサンプル バーコード シーケンスを組み込むように適合されたプライマー 341 F (50-CCTACGGGNGGCWGCAG-30) と 805 R (50-GACTACHVGGGTATCTAATCC-30) を使用して、V3-V4 領域の 16S 増幅に使用されました。構築された 16S メタゲノム ライブラリは、50μL PCR 反応あたり 35 μL の磁気ビーズ (AxyPrep Mag PCR クリーンアップ キット、Axygen Biosciences、New York) を使用して精製されました。ライブラリの品質管理は、DNA 7500 チップ (Agilent Technologies、California) を使用した Bioanalyzer 2100 で実施しました。等モル プールを取得し、さらに処理する前に品質をチェックしました。プールは PicoGreen (Life Technologies、California) を使用して定量化し、2 300bp ペアエンド シーケンシング (Illumina、California)を使用して MiSeq プラットフォームにロードしました。ハイスループット ショットガン シーケンシングは GQ で実施しました。4 つのサンプル (4 つの 高脂肪高ショ糖(HFHS + S)グループと 4 つの 高脂肪メープルシロップ(HFHS + MS)グループ) の 2 つのプールも、Shogun シーケンシングにかけられました。メタゲノム ライブラリは、製造元の推奨に従って、NEBNext Ultra II DNA ライブラリ準備キット for Illumina (New England BioLabs) を使用して準備しました。ライブラリは、Kapa Illumina GA with Revised Primers-SYBR Fast Universal キット (Kapa Biosystems、Massachusetts) を使用して定量化されました。平均サイズのフラグメントは、LabChip GX (PerkinElmer) 機器を使用して決定されました。ライブラリは、2 150 bp ペアエンドランを使用して Illumina NovaSeq 6000 プラットフォームでシーケンスされました。これにより、サンプルあたりの平均読み取りペア数は約 3,200 万になりました。 |
| 2.10.アンプリコンベースの分類学的分析 |
| 16S rRNA 遺伝子アンプリコンから Cutadapt (v1.14; 34) を使用してフォワードプライマーとリバースプライマーが除去されました。シーケンスリードは R (http://www.R-project.org) の dada2 パッケージ (v1.26; 39) を使用して分析されました。フォワードリードとリバースリードは、まず低品質領域を除去するためにトリミングされました。フィルタリングされたシーケンスのデレプリケーションとノイズ除去は、DADA2 のデフォルトパラメータを使用して実行されました。ノイズ除去されたフォワードリードとリバースリードはマージされ (不一致のあるリードはすべて除去)、キメラが検索されました。アンプリコンシーケンスバリアント (ASV) の分類学的割り当ては、Silva データベース 138.1 (41) に対してトレーニングされた RDP 分類アルゴリズム (v2.2; 40) を使用して実行されました。データセット全体で 3 回未満しか出現しない分類群は削除されました。不均等なサンプルサイズの正規化は、ASV テーブルを 8,259 シーケンスの深さで希薄化することによって実行されました。 |
| 2.11.メタゲノムリードの分類学的および機能的プロファイリング |
| メタゲノムリードは、カットオフ Q20 (42) の Trimmomatic を使用して品質フィルタリングされ、さらに Bowtie2 (43) を使用してホスト起源リードが除去されました。ホスト汚染除去されたリードは、SLIMM (44) を使用して種レベルで分類学的にプロファイリングされました。存在率が 0.1% 未満で、データセット全体で 3 回未満しか出現しなかった分類群は除去されました。 機能分析は HUMAnN2 (45) を使用して完了しました。 その後、HUMAnN2 の結果は、KEGG 遺伝子注釈データベース (46) に基づいてパスウェイにグループ化されました。 |
| 2.12.微生物叢分析 |
| R Phyloseq パッケージ (v1.40.0) (47) を使用して、すべての多様性分析を実施しました。グループ間で異なる量の分類群または経路の検出は、メタゲノミクス バイオマーカー検出ツールの線形判別分析効果サイズ (LEfSe) を使用して、線形判別分析 (LDA) スコアしきい値 >2.0 (48) を使用して実施しました。2 つの独立したグループ間の差は、Mann–Whitney 検定を使用して決定しました。微生物叢の構成要素と生物学的パラメータ間の相関は、Spearman 検定を使用して分析しました。多重検定には Benjamini–Hochberg (BH) 補正を使用しました。P 値が 0.05 未満の場合、統計的に有意であると判断されました。 |
| 2.13.統計分析 |
| 高脂肪高ショ糖(HFHS + S)を与えられたマウスと 高脂肪メープルシロップ(HFHS + MS) を与えられたマウス間の統計分析は、両側 t 検定 (GraphPad) を使用して実施しました。 低脂肪低ショ糖と水(LFLS + V)食を与えられたマウスは参照グループとしてのみ使用されたため、統計分析では計画されていません。体重増加、エネルギー摂取量、血糖値、およびインスリン血症曲線は、2 元配置反復測定 ANOVA と Bonferroni 事後検定を使用して統計的に比較され、上記のパラメータに対する時間と食事介入の影響を評価しました (SigmaPlot)。すべての結果は、P < 0.05 で統計的に有意であると判断されました。ここで、 は 高脂肪高ショ糖(HFHS + S) と 高脂肪メープルシロップ(HFHS + MS)の差を示しています。データは平均 ± SE として表されます。 |
| 3.結果 |
| 予想通り、低脂肪低ショ糖食(LFLS)を与えられたマウスは、高脂肪高ショ糖(HFHS + S)を与えられたマウスよりも体重増加がかなり少なかった。総体重増加とエネルギー摂取量は、高脂肪高ショ糖(HFHS + S)を与えられたマウスと高脂肪メープルシロップ(HFHS + MS)を与えられたマウスで同様であった(図 1、A~C)。臓器重量に有意差はなかったが、メープルシロップ食事介入により腓腹筋重量が増加する傾向が観察された(表 2)。 |
| 表2. 臓器重量 |
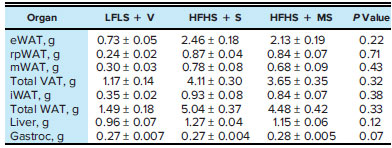 |
| 高脂肪高ショ糖(HFHS + S)と 高脂肪メープルシロップ(HFHS + MS)を比較するために両側 t 検定を実施しました。データは平均値 (g) ± SE (n ¼ 12) として表されます。低脂肪低ショ糖と水(LFLS + V)、低脂肪低ショ糖を溶媒(水)とともに経口投与。高脂肪高ショ糖(HFHS + S)、高脂肪高ショ糖をショ糖とともに経口投与。高脂肪メープルシロップ(HFHS + MS)、高脂肪高ショ糖をメープルシロップ (MS) とともに経口投与。WAT、白色脂肪組織。eWAT、精巣上体 WAT。rpWAT、後腹膜 WAT。mWAT、腸間膜 WAT。VAT、内臓脂肪組織 (eWAT、rpWAT、mWAT の合計)。iWAT、鼠径部 WAT。gastroc、腓腹筋。体重調整済み。 |
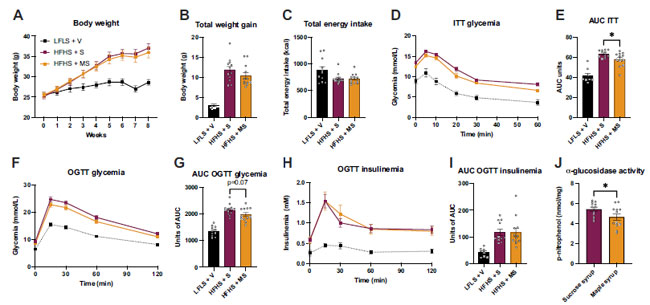 |
| 図 1. メープルシロップ は体重増加には影響しませんが、グルコース恒常性を改善します。体重 (A)、総体重増加 (B)、総エネルギー摂取量 (C)。 5 週目に、マウスを 6 時間絶食させ、腹腔内インスリン耐性試験 (ITT)を実施しました。腹腔内インスリン耐性試験 (ITT)中の血糖値 (D) と 腹腔内インスリン耐性試験 (ITT)中の血糖値の曲線下面積 (AUC) (E)。 7 週目に、マウスを一晩 (12 時間) 絶食させ、経口ブドウ糖負荷試験 (OGTT) を実施しました。経口ブドウ糖負荷試験 (OGTT)中の血糖値 (F)、経口ブドウ糖負荷試験 (OGTT)中の血糖値の曲線下面積 (AUC) (G)、経口ブドウ糖負荷試験 (OGTT)中のインスリン血症 (H)、および 経口ブドウ糖負荷試験 (OGTT)中のインスリン血症の曲線下面積 (AUC) (I)。J: 60 分後の α-グルコシダーゼ活性。データは平均 ± SE として表されます。A、D、F、および H: 2 元配置分散分析 (時間列因子)。 B、C、E、F、G、I、J:高脂肪高ショ糖(HFHS + S)と高脂肪メープルシロップ(HFHS + MS)を比較する両側t検定。P < 0.05 高脂肪高ショ糖(HFHS + S)vs. 高脂肪メープルシロップ(HFHS + MS)。データは平均±SE(n ¼ 12)として表される。低脂肪低ショ糖と水(LFLS + V)、低脂肪低ショ糖を与え、溶媒を経口投与。高脂肪高ショ糖(HFHS + S)、高脂肪高ショ糖を与え、ショ糖を経口投与。高脂肪メープルシロップ(HFHS + MS)、高脂肪高ショ糖を与え、メープルシロップを経口投与。ITT、インスリン耐性試験。 |
| 介入の 5 週間後、マウスは 6 時間絶食し、腹腔内インスリン耐性試験 (ITT)を受けました (図 1D)。高脂肪高ショ糖(HFHS + S)食を摂取したマウスでは、高脂肪メープルシロップ(HFHS + MS)グループで血糖曲線下面積 (AUC) の減少によって表されるように、ショ糖シロップよりもメープルシロップによるインスリン耐性の低下は少なかった (図 1E)。食事開始から 7 週目に、マウスは一晩絶食し、経口ブドウ糖負荷試験 (OGTT)を実施した (図 1F)。高脂肪高ショ糖誘発性グルコース不耐性は、曲線下面積 (AUC)によって示されるように、メープルシロップによって減少する傾向があった (図 1G)。しかし、経口ブドウ糖負荷試験 (OGTT)中のインスリンの循環レベルに変化は検出されなかった (図 1、H および I)。これらのデータを総合すると、総カロリー摂取量の 10% でも、メープルシロップは精製糖よりもグルコース代謝に悪影響が少ないことが示唆される。 |
| メープルシロップがグルコース代謝に与える影響をより深く理解するため、腸の刷子縁にある、二糖類を吸収可能な単糖類に消化する酵素である α-グルコシダーゼ活性を測定した。この分析では、別のマウス群に メープルシロップ(n = 12) またはショ糖(n = 12) (2 g/kg) を単回投与し、30 分後に安楽死させた。回腸を直ちに採取し、酵素活性を測定した。メープルシロップ の投与により α-グルコシダーゼ活性が大幅に低下したことから、二糖類の消化が減り、吸収も減ったことが示唆される (図 1J)。長期研究では、メープルシロップを経口投与と食事の両方で毎日投与したため、糖の吸収がある程度防止され、慢性高血糖とグルコース恒常性の低下が部分的に防がれた可能性がある。 |
| 次に、高脂肪高ショ糖食を与えられたマウスの総カロリー摂取量の 10% をメープルシロップで置き換えることによる肝臓の健康への影響を調査しました。 メープルシロップは肝臓の重量に変化を与えませんでしたが (図 2A)、高脂肪メープルシロップ食を与えられた動物では肝臓のトリグリセリド レベルの低下 (図 2B) からわかるように、この治療によって肝臓の脂肪変性が減少しました。 肝臓コレステロール レベルとオイルレッド O (ORO)陽性領域はメープルシロップによって有意に減少しませんでした (図 2、C および D)。メープルシロップが肝臓の炎症に及ぼす潜在的な影響を調べるために、マルチプレックス アッセイを実施しました。 高脂肪高ショ糖食を摂取したマウスでは、インターロイキン 6 (IL-6)、単球走化性タンパク質 1 (MCP-1)、腫瘍壊死因子アルファ (TNF-a)、インターロイキン 10 (IL-10) などの炎症マーカーのレベルに変化は見られませんでした (補足図 S1、A~D)。これと一致して、肝臓ホモゲネートでは、チオバルビツール酸反応性物質 (TBARS) によって証明される脂質過酸化の変化は検出されませんでした (補足図 S1E) (すべての補足資料は https://doi.org/10.6084/m9.figshare.22149206.v1 で入手できます)。 |
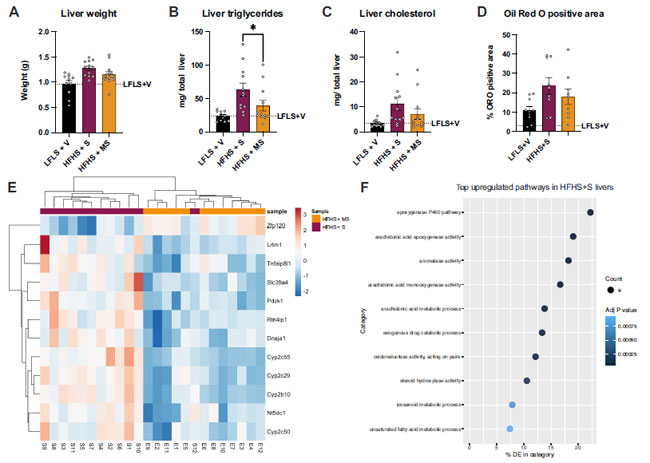 |
図 2. メープルシロップは肝臓トリグリセリドの蓄積を減らし、抗炎症防御に関連する遺伝子発現を変化させます。 A: 肝臓重量。肝臓トリグリセリド (B) とコレステロール (C) は肝臓ホモゲネートから測定しました。D: オイルレッド O (ORO) 陽性領域の定量化。E: 肝臓遺伝子の階層的クラスタリング分析。ヒートマップは、高脂肪高ショ糖(HFHS + S)と 高脂肪メープルシロップ(HFHS + MS)を摂取したマウス間で差次的に発現した遺伝子の Z スコアを示しています。異なる列は異なるサンプルを表し、異なる行は異なる遺伝子を表します。赤は有意にアップレギュレーションされた遺伝子に対応し、青は有意にダウンレギュレーションされた遺伝子に対応します。F: P 値でランク付けされた、高脂肪高ショ糖(HFHS + S)で過剰に表現された上位 10 個の GO 用語。データは平均 ± SE として表されます。高脂肪高ショ糖(HFHS + S) と高脂肪メープルシロップ(HFHS + MS)を比較するために、両側 t 検定を実行しました。 P < 0.05 高脂肪高ショ糖(HFHS + S)vs. 高脂肪等カロリーメープルシロップ(HFHS + MS)。データは平均±SE(n ¼ 12)として表されます。DE、差次的発現、GO、遺伝子オントロジー、高脂肪高ショ糖HFHS + S)、高脂肪高ショ糖を与え、ショ糖を経口投与、高脂肪メープルシロップ(HFHS + MS)、高脂肪高ショ糖を与え、メープルシロップを経口投与。 |
| メープルシロップが肝臓の健康に与える影響をさらに分析するために、トランスクリプトーム解析を実施しました。高脂肪高ショ糖(HFHS + S)および高脂肪メープルシロップ(HFHS + MS)遺伝子発現のクラスタリングにより、2 つの 高脂肪高ショ糖食摂取群間に有意な差があることが明らかになりました (図 2E)。高脂肪メープルシロップ(HFHS + MS)摂取マウスの肝臓では、ジンクフィンガータンパク質 120 (Zfp120) という 1 つの遺伝子のみが有意に過剰発現していました。一方、高脂肪高ショ糖(HFHS + S)摂取マウスの肝臓では、いくつかの遺伝子がアップレギュレーションされていました。これらの遺伝子のほとんど(例:Cyp2c55、Cyp2c29、Cyp2b10、Cyp2c50)は、アラキドン酸(AA)代謝のシトクロムP450(Cyp450)エポキシゲナーゼ経路に関与するタンパク質をコードしており、エポキシエイコサトリエン酸(EET)としても知られるアラキドン酸エポキシドを生成します。これに沿って、KEGG分析では、高脂肪メープルシロップ(HFHS + MS)給餌マウスと比較して、高脂肪高ショ糖(HFHS + S)給餌マウスの肝臓で最もアップレギュレーションされた経路は、アラキドン酸エポキシゲナーゼ活性に関連していることが明らかになりました(図2F)。EETは抗炎症メディエーターとして知られています(40)。 高脂肪高ショ糖(HFHS + S)給餌マウスの肝臓におけるエポキシゲナーゼ経路に関連する遺伝子の差次的発現は、脂肪肝によって誘発される炎症刺激に対抗する早期反応を示唆している可能性があります。これによりサイトカイン レベルが低下し、脂肪肝から保護された 高脂肪メープルシロップ(HFHS + MS)給餌マウスと同レベルになりました。 |
| メープルシロップには、腸内細菌叢によって特異的に代謝されるポリフェノールやイヌリンなどの多様な生理活性化合物が含まれているため、次に、16S rRNA シーケンシング (補足図 S2) と全ゲノム ショットガン シーケンシング (図 3A) によって、糞便細菌叢への影響を調査しました。主座標分析 (図 3D) で明らかなように、高脂肪高ショ糖を摂取した 2 つのグループの細菌組成は異なってクラスター化しました。線形判別分析 (LDA) 効果サイズ (LEfSe) 分析により、高脂肪メープルシロップ(HFHS + MS)を摂取したマウスの糞便には、Faecalibaculum rodentium、Romboutsia ilealis、および Lactobacillus johnsonii が有意に多く含まれていることが明らかになりました (図 3B)。ショットガンシーケンスにより、高脂肪高ショ糖を摂取した両グループ間で細菌代謝経路が変化していることも明らかになりました。一方では、高脂肪高ショ糖(HFHS + S)を摂取したマウスのマイクロバイオームで、ペントースとグルクロン酸の相互変換、フェニルアラニンチロシンとトリプトファンの生合成、リボフラビン代謝、バリンロイシンとイソロイシンの生合成に関連する経路がアップレギュレーションされていました。他方では、メープルシロップは一次および二次胆汁酸、ホスホトランスフェラーゼシステム(PTS)、ピリミジン代謝、ヌクレオチド除去修復、アラニン代謝に関連する経路を増加させました(図3C)。 |
| F. rodentium は酪酸の生産菌として知られているため、次に盲腸の短鎖脂肪酸プロファイルを調査しました。高脂肪メープルシロップ(HFHS + MS)を摂取したマウスの盲腸では酪酸レベルが高くなる傾向がありました (P ¼ 0.09) (図 3G)。一方、イソ吉草酸はメープルシロップによって有意に増加しました (図 3H)。酢酸、プロピオン酸、吉草酸、イソ酪酸には変化は見られませんでした (図 3、E、F、I、J)。 |
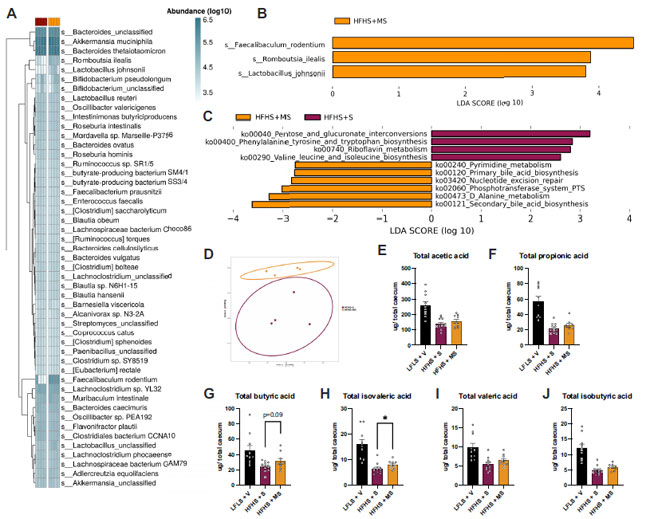 |
図 3. 食事介入後の糞便微生物叢とマイクロバイオームの変化。糞便サンプルは 8 週目に採取されました。 A: 食事介入 8 週後の細菌種の豊富さのヒートマップ。B: 高脂肪高ショ糖(HFHS + S) を摂取したマウスと 高脂肪メープルシロップ(HFHS + MS)を摂取したマウスの腸内微生物叢を最も強く区別する分類群を調べるために、線形判別分析 (LDA) 効果サイズ (LefSe) を計算しました。C: 高脂肪高ショ糖(HFHS + S) と高脂肪メープルシロップ(HFHS + MS)間の有意に異なる経路豊富さを調べるためにも、LefSe を計算しました。D: Bray–Curtis 非類似度行列に基づく主座標分析 (PCoA)。盲腸の内容物を使用して、酢酸 (E)、プロピオン酸 (F)、酪酸 (G)、イソ吉草酸 (H)、吉草酸 (I)、およびイソ酪酸 (J) を測定しました。 E–J: 高脂肪高ショ糖(HFHS + S)を与えられたマウスと高脂肪メープルシロップ(HFHS + MS)を与えられたマウスを比較する両側t検定。P < 0.05 高脂肪高ショ糖HFHS + S) vs. 高脂肪シロップ(HFHS + MS)。データは平均±SE(n ¼ 12)として表されます。高脂肪高ショ糖HFHS + S)、高脂肪高ショ糖を与え、ショ糖を経口投与。高脂肪メープルシロップ(HFHS + MS)、高脂肪高ショ糖を与え、メープルシロップを経口投与。 |
| 4.考察 |
| 我々の研究は、肥満誘発食の総エネルギー摂取量のわずか10%を占めるメープルシロップの等カロリー部分をショ糖に置き換えることで、8週間の介入でインスリン抵抗性が緩和され、肝臓トリグリセリド蓄積が減少したことを示しています。これは、高脂肪メープルシロップ(HFHS + MS)を摂取したマウスの腸管α-グルコシダーゼ活性の低下によって証明されるように、炭水化物の消化と吸収の低下によって部分的に説明できます。さらに、トランスクリプトーム解析により、高脂肪高ショ糖(HFHS + S)を摂取したマウスの肝臓では、メープルシロップを投与したマウスと比較して、アラキドン酸代謝のCyp450エポキシゲナーゼ経路が著しくアップレギュレーションされていることが明らかになりました。ショ糖組成以外にも、メープルシロップ組成の複雑さによって腸内細菌叢組成に著しい変化が起こり、高脂肪メープルシロップ(HFHS + MS)を摂取したマウスの糞便中の F. rodentium、R. ilealis、L. johnsonii の存在量が増加したことがそれを証明しています。高脂肪高ショ糖(HFHS + S) を摂取したマウスのマイクロバイオームの代謝経路は主にタンパク質分解発酵に関係していましたが、メープルシロップは代謝経路と炭水化物代謝に関係する細菌の存在量を増加させました。特に、高脂肪メープルシロップ(HFHS + MS)を摂取したマウスのマイクロバイオームではホスホトランスフェラーゼ システム (PTS) が増加しており、これがポリフェノールのバイオアベイラビリティの増加に寄与している可能性があります。 |
| ラットにおけるショ糖の代替として メープルシロップを与えることの長期的影響を調査した他の研究 (9、14) と同様に、高脂肪メープルシロップ(HFHS + MS)を与えられたマウスの体重に変化は検出されませんでした。これは、0.1% のポリフェノールに富む メープルシロップ抽出物を含む食事を与えられた KK-Ay マウスでも報告されています (18)。体重に変化がなかったにもかかわらず、メープルシロップを投与されたマウスは 腹腔内インスリン耐性試験 (ITT)中に血糖値が低下し、経口ブドウ糖負荷試験 (OGTT)中に血糖値が改善する傾向がありました。私たちのグループが実施した以前の研究では、メープルシロップの組成が分析され、ポリフェノールや植物ホルモンなどのいくつかの生理活性分子が含まれていることが明らかになりました。実際、メープルシロップには高濃度のアブシジン酸 (ABA) と アブシジン酸 (ABA)の代謝物であるファゼイン酸 (PA) が含まれています (22)。 メープルシロップにおけるこれらの植物ホルモンの出現は、糖尿病や炎症の治療における有効性が研究されていることを考えると興味深い (41, 42)。さらに、メープルシロップは小腸の刷子縁にある二糖類の消化に関与する酵素である α-グルコシダーゼの活性を阻害し、その結果吸収可能な単糖類 (グルコース、フルクトース、ガラクトース) を放出することが以前に報告されているが、この効果は in vitro でのみ観察されている (24, 43)。したがって、精製ショ糖を メープルシロップに 8 週間毎日代用すると、血糖値とインスリン反応が低下し、精製糖の摂取と比較してグルコース恒常性の悪化が少なくなると我々は提案する。 |
| また、メープルシロップを投与したマウスでは、ショ糖を投与したマウスよりも肝臓トリグリセリドの蓄積が有意に少ないことも観察されました。私たちの知る限り、この発見を報告したのは私たちが初めてです。実際、他の研究では、ポリフェノールが豊富なメープルシロップ抽出物 (MSX) が肥満 C57Bl/6J マウスの肝臓の健康に与える影響が調査されましたが、肝臓トリグリセリド含有量に有意差は見られませんでした (16、17)。肝臓のトランスクリプトーム解析により、高脂肪高ショ糖(HFHS + S)を投与したマウスの肝臓では、高脂肪メープルシロップ(HFHS + MS)を投与したマウスと比較して、いくつかのシトクロム P450 (CYP) 遺伝子がアップレギュレーションされ、アラキドン酸エポキシゲナーゼ活性に関連する経路がアップレギュレーションされていることが明らかになりました。アラキドン酸の分解と代謝は、炎症の誘発と解消に大きな役割を果たします。実際、抗炎症性代謝物(エポキシエイコサトリエン酸、EET)と炎症誘発性代謝物(ロイコトリエン)のバランスは、多くの病態生理学的状態において極めて重要です(44)。炎症誘発性刺激を受けると、リン脂質膜に蓄えられたアラキドン酸(AA)は細胞質ホスホリパーゼA2(cPLA2)によって加水分解され、CYP2JおよびCYP2Cサブファミリーによって酸化されて抗炎症性エポキシエイコサトリエン酸(EET)になります(45、46)。したがって、高脂肪高ショ糖(HFHS + S)を摂取したマウスの肝臓におけるエポキシゲナーゼP450経路の活性化は、炎症誘発性障害に対する第一の防御線であり、さらなる損傷を制限する試みである可能性があります。一方、高脂肪メープルシロップ(HFHS + MS)を摂取したマウスの肝臓ではこれらの経路がダウンレギュレーションされており、炎症の程度が低いことが示唆されています。この結果は、メープルシロップ抽出物 (MSX) と メープルシロップの両方が肥満誘発性食事によって引き起こされる肝臓の炎症を軽減すると報告した以前の研究と一致しています (14、16)。 |
| いくつかの研究により、腸内細菌叢がさまざまなメカニズムを通じて代謝の健康に中心的な役割を果たしていることが説得力を持って実証されています (47–49)。腸と肝臓は本質的につながっており、代謝機能の点で互いに強く依存しています。当然のことながら、腸管透過性の増加や腸内細菌叢の異常など、腸-肝軸の障害は非アルコール性脂肪性肝疾患 (NAFLD) に関連しています (50)。プレバイオティクスは、腸内細菌叢によって特異的に分解される炭水化物と定義され、それによって短鎖脂肪酸などの重要な代謝産物が生成され、代謝結果の改善に関連しています (50–52)。メープルシロップ にはプレバイオティクス繊維であるイヌリンが含まれていることが以前に報告されています (25)。さらに、私たちと他の研究者は、メープルシロップ が、プレバイオティクスのような作用で知られる特定のポリフェノールであるリグナンの供給源であることを報告しました (15、21、22)。他の多くのポリフェノールと同様に、リグナンの生理活性は腸内細菌による変換に依存しており、代謝の健康に良い効果を発揮するためには、生体内に侵入する前に腸内細菌叢によってエンテロリグナンへの脱グリコシル化を受ける必要があります (53、54)。今日まで、メープルシロップが腸内細菌叢の構成に重大な影響を与えることを報告した研究はありません。そのため、私たちは、全ゲノムショットガンシーケンスによって、精製糖をメープルシロップに置き換えることが腸内細菌叢に与える影響を徹底的に調査することを目的としました。 |
| ショットガン シーケンシングにより、8 週間にわたってショ糖シロップを等カロリー量の メープルシロップに置き換えると、F. rodentium、R. ilealis、および L. johnsonii の存在量が大幅に増加することが明らかになりました。興味深いことに、Lactobacillus および Romboutsia 細菌科は、ショ糖などのさまざまな単純炭水化物をエネルギー源として利用することに関与する細菌代謝経路であるホスホトランスフェラーゼ システム (PTS) をコードする遺伝子を持つことが知られています (55、56)。したがって、高脂肪メープルシロップ(HFHS + MS) を摂取したマウスのマイクロバイオームでは、ホスホトランスフェラーゼ システム (PTS) に関連する経路が大幅に増加していることが観察されました。メープルシロップ投与後の α-グルコシダーゼ活性の低下と一致して、吸収されない糖の割合が腸管腔内に高くなり、ホスホトランスフェラーゼ システム (PTS)を介してエネルギー源として使用される可能性があります。最近の記事では、乳酸菌はグリコシル化された植物化学物質の糖部分を代謝し、その生理活性アグリコンを外部に放出して、より生体利用性を高めることができるとも報告されています(56)。したがって、ホスホトランスフェラーゼ システム (PTS)経路の増加は、メープルシロップに自然に含まれるポリフェノールの脱グリコシル化にも寄与し、その生体利用性を高めた可能性があります。 |
| メタゲノムデータから、重要な酪酸産生菌であるF. rodentiumと、既知の短鎖脂肪酸産生菌であるR. ilealisが、高脂肪メープルシロップ(HFHS + MS)を摂取したマウスの糞便中に多く含まれていることが明らかになった(55、57)。食事誘発性肥満マウスに共生菌(プレバイオティクスとプロバイオティクスの混合物)を与えると、代謝障害が緩和され、F. rodentiumの割合が増加し、それが短鎖脂肪酸の正常化につながることが以前に報告されている(58)。これに沿って、高脂肪メープルシロップ(HFHS + MS)を摂取したマウスの盲腸では酪酸の濃度が増加する傾向があった。以前の研究では、高脂肪食を摂取したマウスに酪酸を投与すると、腸管バリアが改善し、脂肪肝炎が軽減された(59)。酪酸は結腸細胞の好ましい燃料であることに加え、細胞増殖と分化の主要な調節因子でもあり、腸管透過性において重要な役割を果たしています (60)。興味深いことに、短鎖脂肪酸は全身循環に吸収されると、ペルオキシソーム増殖因子活性化受容体 c (PPARc) 依存性の肝臓および脂肪組織における脂肪生成から脂肪酸化への切り替えを介して肝臓保護作用を発揮することもできます (61)。これに沿って、同位体標識短鎖脂肪酸を用いたげっ歯類実験では、短鎖脂肪酸の盲腸濃度ではなく 短鎖脂肪酸の吸収が代謝の健康に関係していることが実証されました。したがって、これは、酢酸、プロピオン酸、酪酸に大きな変化が見られなくても代謝パラメータの改善が見られる理由を説明できます。全体的に、メープルシロップのプレバイオティクス作用は、炭水化物の利用と短鎖脂肪酸の生成に関連するマイクロバイオーム経路を促進し、代謝結果の改善につながった可能性があります。高脂肪メープルシロップ(HFHS + MS)を摂取したマウスのマイクロバイオームとは対照的に、メタゲノム解析により、高脂肪高ショ糖(HFHS + S)を摂取したマウスの糞便では、分岐鎖アミノ酸のバリン、ロイシン、イソロイシン、および芳香族アミノ酸のフェニルアラニン、チロシン、トリプトファンに関連する代謝経路がアップレギュレーションされていることが明らかになりました。タンパク質分解発酵では、アンモニアやフェノールなどの主に有害な誘導体が生成され、宿主の腸や代謝の健康に悪影響を及ぼす可能性があります (50)。 |
| この研究には、砂糖入り飲料からの炭水化物摂取を模倣するように注意深く設計された食事(総エネルギー摂取量の 6.5% を供給(31)、食事に砂糖が組み込まれている)など、大きな強みがあります。ショ糖を メープルシロップに置き換えることの影響も、特に全ゲノムショットガンシーケンスによる腸内細菌叢の構成の分析や、腸内炭水化物消化に対するメープルシロップのメカニズムの影響の調査によって、慎重に調査されました。ただし、この研究にはいくつかの限界もあります。まず、この研究は雄のマウスのみで実施され、ショ糖をメープルシロップに置き換えることの影響は雌のマウスでさらに調査する必要があります。さらに、8 週間後に観察された代謝の改善はわずかですが、これは、少量の メープルシロップを使用した等カロリーの食事介入を使用し、ショ糖によって提供される総カロリー摂取量の 10% のみを置き換えたという事実によって説明できます。このような置き換えは、人間が達成可能な砂糖の置き換えの範囲内であるため、臨床的に関連性を保つために選択されました。ショ糖をすべてメープルシロップに置き換えていたら、代謝の健康にさらに大きな影響が見られていただろうと私たちは考えています。最後に、メープル シロップは天然物であり、その植物栄養素の組成は季節やシロップの種類によって異なる場合があります。この研究では、この変動を考慮するために 3 種類のメープルシロップ (エクストラクリア、アンバー、ダーク) を混合して使用しましたが、各 メープルシロップ の種類の影響もさらに調査する必要があります。 |
| 結論として、高脂肪食を摂取したマウスでショ糖をメープルシロップに置き換えると、炭水化物の消化が減少し、腸内細菌叢の構成の変化に関連してインスリン抵抗性や脂肪肝などの代謝結果に対する悪影響が軽減されることがわかりました。メープルシロップを投与された 高脂肪食摂取動物のマイクロバイオームは、ポリフェノールと炭水化物を代謝できる細菌の量を増やすように再形成され、その結果、肝臓の健康の改善に関連する酪酸などの生理活性代謝物が生成されました。これらの結果を総合すると、精製糖をメープルシロップに置き換えることは、代謝の健康にとってより好ましい代替手段となる可能性があることが示唆されます。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Am J Physiol Endocrinol Metab 325: E661–E671, 2023に掲載されたThe metabolic benefits of substituting sucrose for maple syrup are associated with a shift in carbohydrate digestion and gut microbiota composition in highfat high-sucrose diet-fed mice.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |