
| Reham Samir Hamida et al., Biomedicine & Pharmacotherapy 133 (2021) 110974 |
| 概要 |
2019年コロナウイルス病(COVID-19)は、最近発見された「重症急性呼吸器症候群コロナウイルス2」(SARS-CoV-2)と呼ばれるコロナウイルスによって引き起こされる感染症です。 何人かの学者は、COVID-19を克服するために抗ウイルス薬と化合物をテストしました。 「ケフィア」は、ケフィアの粒から作られた薄いヨーグルトに似た発酵乳飲料です。 ケフィアとそのプロバイオティクスの内容物は、免疫系を調節してウイルス(ジカ熱、C型肝炎、インフルエンザ、ロタウイルスなど)による感染を抑制することができます。 ケフィールの抗ウイルスメカニズムには、マクロファージ産生の増強、食作用の増加、分化陽性(CD4 +)、CD8 +、免疫グロブリン(Ig)G +およびIgA + B細胞、T細胞、好中球、ならびにサイトカイン(例、インターロイキン(IL)-2、IL-12、インターフェロンガンマ-γ)。 ケフィアは、IL-6、IL-1、TNF-α、およびインターフェロン-γの発現を低下させることにより、抗炎症剤として作用することができます。 したがって、ケフィアは、COVID-19に寄与する「サイトカインストーム」の重要な阻害剤である可能性があります。 ここでは、ウイルス感染に対するケフィア消費とその微生物組成の影響に特に重点を置いたいくつかの研究をレビューし、免疫応答の調節を介したSARS-CoV-2感染に対する保護補助食としてのケフィアのさらなる開発について議論します。 |
1.はじめに |
| ウイルス感染は人命を脅かす可能性があります[1]。 気道の急性感染症は、ウイルス、真菌、および細菌に関連しており、成人、子供、および免疫不全の罹患率と死亡率を引き起こします[2]。 パラミクソウイルス科、オルトミクソウイルス科、アデノウイルス科、ピコルナウイルス科、コロナウイルス科のウイルスは、気道感染症を引き起こす可能性があります。 コロナウイルス科のウイルスには、エンベロープと一本鎖RNAがあります。 コロナウイルス(CoV)は最大のRNAゲノム(30 kB)を持ち、人間と動物に感染します[3,4]。 CoVは、高齢者、慢性疾患のある人、および子供の下気道に感染する可能性があります[5]。 CoV感染は、胃腸、呼吸器、肝臓、中枢神経系の障害にもつながる可能性があります[6,7]。 CoVは、2012年にサウジアラビアで中東呼吸器症候群(MERS)が発生し、2002年から2004年に中国で重症急性呼吸器症候群(SARS)が発生した主な理由でした[8-10]。 SARSに関連するさまざまなCoVが、貯水池の宿主としてコウモリで研究されています[7、11、12]。 2019年12月12日、武漢(中国湖北省)で肺炎を引き起こす新しいCoVによる感染が認められました[13]。 この新しいCoVは、ゲノム全体の配列が決定されたときに、コウモリのCoVと96%の類似性があることがわかりました[14]。 世界保健機関(WHO)は、2020年2月11日に、この新しいCoVを「重症急性呼吸器症候群コロナウイルス2」(SARS-CoV-2)と名付けました。 SARS-CoV-2は当初中国を席巻し、世界中に広がりました。 WHOは、SARS-CoV-2感染に起因する病気を「コロナウイルス病2019」(COVID-19)と名付けました。 2020年10月25日の時点で、COVID-19は世界で42,624,910件の確定症例と1,149,928人の死亡をもたらしました[15]。 |
ウイルス感染と戦うために使用される戦略は、感染した患者を治療するための適切なワクチンまたは効果的な抗ウイルス薬の開発です[16]。 ほとんどのワクチンの作用機序は、インターフェロン(IFN)-γ、インターロイキン(IL)-2 およびIL-12などのさまざまなサイトカインを産生するTヘルパー1型(Th1または分化クラスター(CD)4+)細胞の促進です。 後者はキラーT細胞の成熟を刺激し、ナチュラルキラー(NK)細胞の細胞傷害性を高めて、ウイルス感染細胞を特定して破壊します[17]。 Buisman et al [18]は、ワクチンが免疫グロブリン(Ig)Aの産生を誘導して体を保護することを報告しました。 抗ウイルス薬の作用機序は、主に免疫系の強化、標的細胞へのウイルスの付着の抑制、または複製ステップの停止に基づいています[16]。 |
| COVID-19に対する有効な薬やワクチンは入手できません。 ただし、綿密な衛生状態と免疫システムのサポートは、可能な予防戦略です。 したがって、現在利用可能な抗ウイルス薬(インフルエンザウイルスなど)はSARS-CoV-2に対して有効ではないため、免疫系を強化し、SARS-CoV-2活性を抑制する適切な化合物を発見するための調査が緊急に必要です[19,20]。 |
| 天然物は免疫システムを強化し、ウイルス感染を抑制する可能性があります。 「ケフィア」は、ケフィアの粒から作られた薄いヨーグルトに似た発酵乳飲料です。 ケフィアは、健康的なプロバイオティクス(つまり、腸内細菌叢を改善/回復することによって消費されたときに健康上の利益をもたらすことができる生きた微生物)として世界的に受け入れられ、商業規模で製造されています[21]。 人間の健康に関して、ケフィアには抗ウイルス、抗菌、抗炎症の可能性があります。 ケフィアは、アンジオテンシン変換酵素(ACE)レベル、コレステロール代謝を阻害し、創傷治癒を促進し、腫瘍の成長を抑制し、免疫系の変化を引き起こして喘息の症状とアレルギーを改善することが示されています[22–25]。 ケフィア およびケフィア誘導体(多糖類、タンパク質、ペプチドなど)は、免疫系の応答を調節したり、ウイルスの接着を破壊したりすることで、ウイルスの活動を抑制することができます[26,27]。 それらはまた、IL-1β、腫瘍壊死因子(TNF)-αおよびIL-6などの炎症誘発性サイトカインの活性を阻害することによって抗炎症剤として作用します[27]。 したがって、ケフィアとその副産物は、ウイルス感染に対する保護剤として使用できます。 このレビューは、ケフィアとその副産物の抗ウイルスメカニズムに焦点を当てています。 研究者がこの天然物に基づいて抗ウイルス活性をスクリーニングするのを助けるために、SARS-CoV-2などのウイルスに対するケフィアの可能性に関していくつかの提案が策定されました。 |
| 2.COVID-19の病因 |
| COVID-19の病因は完全には理解されていません。 ただし、SARS-CoVおよびMERS-CoVの感染作用機序との比較は、SARS-CoV-2によって引き起こされる感染を理解するための洞察を提供する可能性があります。 CoVの組み立てと感染には、4つの構造タンパク質が使用されます。 ウイルスと宿主の付着に関与するタンパク質は「スパイク」(S)糖タンパク質です[28]。 膜(M)タンパク質は、ウイルスの形状、湾曲した膜、およびヌクレオカプシド結合に関与しています[29]。 ウイルスの放出と病因はエンベロープ(E)タンパク質の役割です[30,31]。 ウイルスのRNAゲノムの結合はヌクレオカプシド(N)タンパク質の責任ですが、ウイルス複製にも重要です(図1)[32]。 |
図1 SARS-COV-2の構造
|
| CoVは複製するために細胞質に到達する必要があるため[33]、細胞受容体と相互作用する必要があります[34,35]。 SARS-CoV-2のS糖タンパク質は、肺細胞の膜上のACE2受容体と相互作用します(SARS-CoVで見られるものと同様)[14]。 受容体とウイルスの結合に続いて、タンパク質分解酵素によるS糖タンパク質の分解後にウイルスと細胞膜が融合し、それによってウイルスゲノムが細胞質に侵入します[36]。 タイプII膜貫通型セリンプロテアーゼはACE2関連タンパク質であり、ウイルス融合を促進することができます[37,38]。 その後、ゲノムRNAの複製とウイルスのmRNA転写が起こり、マイナス鎖RNAからのゲノムRNAの合成が行われます(図2)[39]。 |
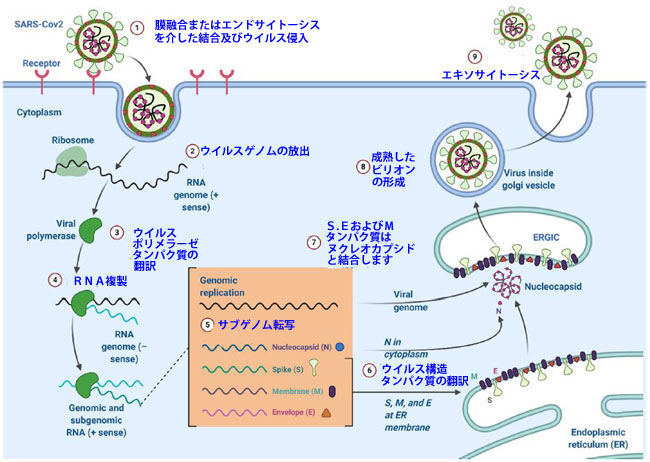 |
| 図2 コロナウイルスのライフサイクル |
| その結果、S、E、およびMタンパク質が新たに形成され、小胞体またはゴルジ体に組み込まれます。 ヌクレオキャプシドタンパク質とゲノムRNAが組み合わさってヌクレオキャプシドが形成されます。 その後、ウイルス粒子は小胞体-ゴルジ中間コンパートメントに発達します[19]。 その後、Nタンパク質は成熟ウイルスの形成のためにウイルスゲノムを捕捉します[40]。 次に、ウイルス粒子は原形質膜と結合してウイルスを放出します[41]。 SARS-CoV-2に感染した人の症状は、乾いた咳、発熱、呼吸困難、頭痛、肺炎であり、呼吸不全や死に至ることさえあります[14]。 しかし、そのような兆候は、SARSおよびMERSによって誘発される症状に関して軽度の反応であると考えられています[4]。 SARS-CoV-2の2〜10日間の潜伏期間は、汚染された手や咳やくしゃみを介して広がる飛沫を介した人から人への感染による迅速な発生を確実にします[42]。 ウイルスがその遺伝的構造を変化させる能力があるため、抗ウイルス薬は十分ではありません[43]。 |
| 3. ケフィアの特性評価と潜在的な使用 |
| ケフィアは、東ヨーロッパ、バルカン半島、コーカサスで最初に特許を取得しました。 クリーミーな食感の酸アルコール発酵乳です[44,45]。 ケフィア粒の直径範囲は0.3〜3.5cmです[46,47]。 ケフィア粒は、タンパク質と多糖類の複雑なマトリックスに存在するプロバイオティクス微生物を含みます[48,49]。 ケフィアは、乳酸菌(LAB)と酵母のさまざまな集団を含むケフィア粒を室温で新鮮な牛乳と混合することによって形成されます。 潜伏期間は、ケフィア粒の微生物群集が発達して広がる絶好の機会を提供し、細菌、酵母、およびそれらの遺伝子の追加または喪失につながります[22、24、25]。 ケフィアは、伝統的および商業的アプローチを含むさまざまな方法で容易に形成することができます[50]。 ケフィアは、その微生物群集と有機酸[54,55]などの代謝収量に関連するいくつかの健康上の利点[51–53]を持っています。 さらに、商業的関心は、健康促進細菌の増殖を促進するための栄養媒体としてのケフィアの使用を増加させています[56–58]。 ケフィア粒の主な多糖類はエテロ多糖類ケフィランであり、これはほとんどがラクトバチルスケフィラノファシエンスによって形成される等量のガラクトースとグルコースで構成されています[59]。 ケフィランは酸性牛乳の粘度を上げます[60]。 ケフィランは低温で良好な粘度のゲル材料を製造でき、発酵製品の改良に使用できます[61]。 さらに、ケフィランは重要な抗腫瘍、抗真菌、抗菌特性[62,63]に加えて、免疫調節または上皮保護[45]、抗炎症[64]、治癒[53]、および抗酸化活性[47]を持っています。 |
| ケフィアのグレインと牛乳で最も一般的な細菌属は、ラクトコッカス、ストレプトコッカス、ラクトコッカスラクチス亜種ラクチス、ラクトバチルスデルブルッキイ亜種ブルガリクス、Lヘルベティカス、Lカゼイ亜種偽プランタルム、Lスケフィリ、Lケフィア、Lブレビスおよびストレプトコッカスサーモフィラスです。 微生物集団の–90%(表1)[22–25]。 何世紀にもわたって、これらのバクテリアは重要な健康上の利点があることが知られています[65]。 また、ロイコノストックメセンテロイデスや酵母種などの他の細菌種が一部のケフィア粒で優勢になる可能性があります[25]。 ケフィアを他の発酵乳製品と区別する特徴は、ケフィア粒が多くの酵母集団を持っていることです[66,67]。 |
| ケフィアの組成は、発酵に使用される牛乳(増殖培地)の種類によって異なります。 ケフィアの栄養上の重要性は、さまざまな生体分子(例、ミネラル、糖、炭水化物、タンパク質、ペプチド、ビタミン、脂肪)および二次代謝産物(例、カテキン、バニリン、フェルラ酸、サリチル酸)の濃縮に基づいています[ 68]。 ビタミンB1、B2、B5、C、高濃度(カルシウム、マグネシウム、カリウム、ナトリウムなど)と低濃度(亜鉛、銅、鉄など)の元素、および必須アミノ酸(セリン、スレオニン、アラニンなど) 、リジン、バリン、イソロイシン、メチオニン、フェニルアラニン、トリプトファン)はケフィールに存在します[69–71]。 これらの成分は、免疫調節、消化、代謝、エネルギーバランス、治癒、中枢神経系、および恒常性の改善に重要な役割を果たします[70-72]。 Nisoli et alは、ケフィラン含有アミノ酸が高齢者の健康的な寿命を延ばし、重度の外傷性脳損傷の患者の精神状態を改善すると報告しました[73]。 |
| 3.1 ケフィア補給に対する免疫系の反応 |
| 腸内細菌叢(GM)は、胃腸管(GIT)に存在する微生物、細菌、ウイルス、原生動物、真菌、およびそれらの集合的な遺伝物質の全体です。 GMは、適切な量で適用された場合に免疫応答を調節できるため、疾患の治療/予防に適用できます[65,74]。 GMは、動物モデルにおいてインフルエンザウイルスおよび肺炎球菌に対して有効性を示しています[75]。 異なるプロバイオティクスは、自然免疫系と適応免疫系をサポートおよび調節する上で異なる能力を示します[76]。 それらは、リポテイコ酸、ペプチドグリカン、および核酸を含む免疫刺激部分を含んでいます[77]。 プロバイオティクスは、GIT [76]および上気道[78,79]におけるさまざまな種類の感染症の重症度を軽減することもできます。 プロバイオティクス微生物は、ウイルスと結合することにより、ウイルスの活動と宿主細胞へのウイルスの侵入を抑制することができます[80]。 |
| 一部のプロバイオティクスの潜在的な抗ウイルス作用メカニズムは、直接トラップ、免疫化合物の強化、および抗ウイルス剤としてのバクテリオシン、乳酸、過酸化水素の開発である可能性があります[81]。 プロバイオティクス微生物の有益な活動は、生きている微生物細胞への直接的な影響、または代謝物(生体分子)の微生物分泌による間接的な影響を通じて機能します[82]。 M¨ollerらは、発酵乳に含まれる生体分子がリンパ球とIg分子の生成を促進できることを実証しました[83]。 |
| 何人かの学者は、免疫系に対するケフィアの影響について議論しました。 マウスモデルにおいて、安井らはインフルエンザウイルスに対する経口投与時のビフィズス菌の抗ウイルス活性を調査した[84]。 彼らは、B.breveが下気道をウイルス感染から保護することを示しました。 他の研究では、発酵乳の摂取後に鼻の病原菌の数が減少することが示されています[85、86]。 |
| Vinderola et alは、免疫系エンハンサーとしてのケフィア(および他のプロバイオティクス)の有効性を示しました。 彼らは、ケフィアがIgA +の腸および気管支細胞の数を増やすことによって免疫応答を調節できることを示しましたが、マウスに適用した場合、腹膜および肺マクロファージの食作用の可能性も調節します[87]。 また、彼らは、サイトカインIL-4、IL-6、およびIL-10の発現が、ケフィアを投与されたマウスの小腸の固有層で増加したことを報告しました。 Perdigon et alは、発酵乳を与えられたマウスが、IgA +細胞の数の増加、マクロファージ活性、および特異的抗体反応などの免疫反応を示したことを報告しました[88-90]。 Can et alは、チョルフトラウト(Salmo coruhensis)にケフィアを与えた後にIgMレベルが増加することを示しました[91]。 ThoreuxとSchmuckerは、十二指腸内でコレラ毒素(CT)で免疫された若いラットにおけるケフィアの免疫調節活性を研究しました[92]。 |
| 彼らは、抗CT IgAのレベルが、CTグループのラットと比較して、ケフィアを与えられたラットの血清、パイエル板、腸間膜リンパ節、脾臓、および腸固有層で増加したことを発見しました。 彼らは、ケフィアが若い成体ラットではCTに対する腸粘膜免疫反応を誘発するが、老化ラットでは誘発しないことを示唆した。 さらなる調査により、ケフィア(ケフィアミクロフローラL.ケフィラノファシエンスによって産生される)を異なるグループのマウスに投与した後、サイトカインIL-1α、IFN-γ、TNF-α、IL-6およびIL-10の発現の増強が示された[26]。 同様に、IFN-γの血清濃度の増加が天然痘ワクチン接種に応答して観察されており、ケフィアの上記と同様の作用機序を示唆している[93]。 IFNベースの治療がC型肝炎ウイルス感染患者を治療する能力を示したので、ケフィアメカニズムとウイルス感染を治療するワクチン能力との間の類似性を示す[94,95]。 |
| ケフィアの免疫調節効果は、その誘導体にも及びます。 いくつかの研究は、特異的および非特異的免疫応答の調節におけるケフィアのプロバイオティクス集団(例えば、LAB)の効力を示しています[96]。 ケフィア粒に存在する新しいプロバイオティクス株L.kefiranofaciens M1は、無菌マウスでinvitroおよびinvivoで免疫調節、抗アレルギー、抗喘息、および抗大腸炎の活性を示しました[97]。 L.ロイテリとL.プランタルムは、肺炎ウイルスに感染したマウスに対してプラスの効果を示しました[98]。 L. plantarum HEAL9およびL.paracasei 8700の摂取に2〜12週間かかると、CD4 +およびCD8 +細胞の誘導を介してヒトライノウイルスによって引き起こされる風邪感染のリスクが低下することが示されました[99]。 Cavicchioli et alは、L.lactis亜種lactisの精製バクテリオシンがヘルペスポリオウイルス-1に対して顕著な阻害活性を有することを実証しました[100]。 さらに、Nanisらは、Lactobacillus acidophilusやBifidobacteria種などのプロバイオティクスの投与により、IFN-αとリバビリンの調節によるC型肝炎ウイルス(HCV)による感染症の治療に対する治癒反応が増強されることを示しました[95]。 ワイスらは、L。アシドフィルスNCFMの投与により、トール様受容体2–IFN-β依存的にウイルス防御遺伝子の発現が活性化され、マウス骨髄由来樹状細胞に関連する遺伝子がアップレギュレーションされることを報告しました[ 101]。 |
| Adilo˘gluらは、ケフィアの経口投与がヒトの自然免疫系に及ぼす影響を研究しました[102]。 彼らは18人の健康な参加者に6週間ケフィアを供給し、TNF-α、IL-1、IL-5、IL-8、トランスフォーミング成長因子-β、ヘモグロビン、クレアチニン、アラニンアミノトランスフェラーゼの血清レベルを測定しました。 結果は、Th1型の免疫反応分極の増加、Th2型の応答の減少、そしてその結果としてのアレルギー反応を示しました。 また、ケフィア補給後のIL-8発現の低下は、好中球の走化性を阻害することによって炎症反応を制御する可能性があります。 対照的に、IL-5発現の増加は、胃腸粘膜でのIgA分泌を増強し、腸管腔でのより効率的な免疫応答をもたらす可能性があります(図3)。 |
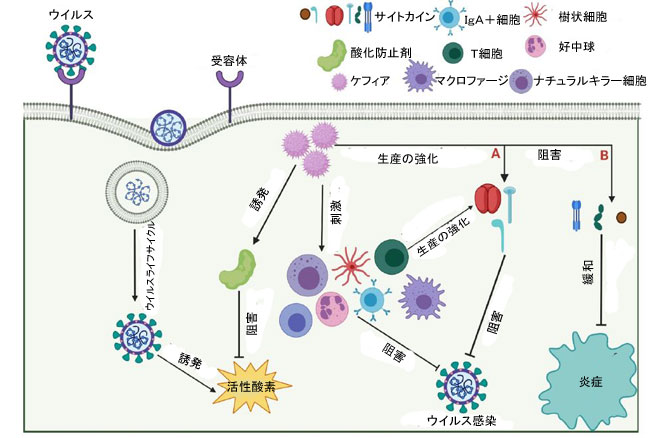 |
| 図3.ウイルス感染に対するケフィアの潜在的な 作用機序 |
| (A)Kefirは、インターフェロンガンマ(IFN-γ)、インターロイキン(IL)-2、IL-12などのサイトカイン産生を刺激することにより免疫応答を増強します。 |
| (B)ケフィアは、IL-6、IL-1、腫瘍壊死因子(TNF)-αなどのサイトカイン産生を抑制することにより、炎症反応を抑制します。 |
| 3.2 ケフィアの抗炎症作用 |
| ウイルス感染は、細胞サイトカインの過剰発現に関連しています。 たとえば、COVID-19は、エフェクターT細胞の過剰活性化と炎症性サイトカイン(特にIL-6)の追加合成に関連しています。 このような作用は「サイトカインストーム」と呼ばれ、抗体ベースの免疫療法で治療された患者の生命を脅かす合併症として割り当てられています。 さらに、IL-1、TNF-α、IFN-gなどの他のサイトカインも形成されます。 すべての製品は、血漿漏出、血管透過性、および血管内凝固を引き起こす病理学的事象に関与しています[103,104]。 Giavanniらは、サイトカインストームとSARS-CoV-2誘発性肺炎の症状との関係を示唆しました[104]。 免疫障害のある患者やサイトカイン遮断薬を服用している患者では、SARS-CoV-2による肺炎の増加は報告されていません。 学者たちは、IL-6阻害剤(またはIL-6産生またはIL-6シグナル伝達の媒介で終了する免疫経路を阻害する化合物)を服用している免疫性疾患の患者は、SARS-CoV-2による肺炎から保護される可能性があると推測しています。 |
| ケフィアに存在する微生物群集に加えて、他の発酵生成物や代謝物は重要な活動をしています。 これらの副産物の多くは、微生物群集が存在しなくても、宿主に広範な結果をもたらす可能性があります[48]。 Chenらは、トランスジェニックホモ接合性核因子-カッパB(NF-κB)-ルシフェラーゼ+ / +マウスにおいて、4μm(PM4.0)未満の粒子状物質に対するケフィアペプチドの抗炎症および抗酸化活性を研究しました[27 ]。 彼らは、ケフィアペプチドが、NF-κBシグナル伝達の阻害による肺組織における炎症誘発性サイトカインIL-1β、IL-4、IL-6およびTNF-αの発現の減少を通じて強力な抗炎症効果を有することを実証しました。 また、ペプチドは、肺の総スーパーオキシドジスムターゼの活性を刺激することにより、活性酸素種のレベルを低下させる抗酸化剤として作用しました。 Rosa et alは、10週間のケフィア給餌が高血圧ラットの脂肪組織における炎症性サイトカイン(IL-1β)、酸化ストレスマーカー(マロンジアルデヒド、ヒドロペルオキシド)の発現を減少させる可能性があることを報告しました[105]。 |
| Andrade et alは、ケフィア投与により、(抗炎症性)IL-10の増強と同時に、TNF-α/ IL-10発現が42%減少し、(炎症誘発性)IL-6発現が50%減少することを示しました[106]。 チベットケフィアの凍結乾燥多糖抽出物は、2.08 mg / mLで最小限の活性でヒアルロニダーゼの強力な阻害作用を示しました[105]。 Seo et alは、ケフィアから生成された細胞外小胞が、炎症誘発性サイトカインの合成を抑制することにより、腸細胞の炎症を軽減したことを報告しました[107]。 また、彼らは、炎症性腸疾患によって誘発されたマウスがケフィア由来のラクトバチルス細胞外小胞で治療されたとき、体重減少と直腸出血の有意な減少を報告しました。 |
| Morsy et alによる重要な研究は、ケフィアを飲むことが慢性HCV感染症の患者に利益をもたらす可能性があることを示しました[108]。 また、ケフィアを患者が服用した場合、HCV感染のかなりの改善が見られ、それにより、抗炎症作用と抗酸化作用に加えて、免疫系を刺激する能力が示唆されました。 Carasiらは、パイエル板および腸間膜リンパ節における炎症誘発性メディエーターの発現を低下させたが、IL-10産生を増強したL.ケフィリCIDCA8348の抗炎症活性を研究しました[109]。 さらに、回腸では、IL-10、ケモカイン(CXCモチーフ)リガンド-1およびムシン6遺伝子が誘導されたが、結腸では、ムシン-4の発現がアップレギュレートされ、IFN-g、顆粒球-マクロファージコロニー刺激の発現が 因子、およびIL-1b遺伝子がダウンレギュレートされました。 |
| 3.3 ケフィアの抗ウイルス活性 |
| ウイルス性疾患、特に新たに出現したウイルス(チクングニア熱、デング熱、エボラ出血熱、ジカ熱、SARS-CoV-2)によるウイルス性疾患の数が大幅に増加し、世界中の公衆衛生に大きな打撃を与えています[106,110]。 また、抗ウイルス薬に対する耐性の発達を止めるのに十分な薬が開発されていません。 人間の栄養、免疫系、および感染症の発生、発症、抑制におけるそれらの役割の間の強い関係は、免疫系を強化する製品を探すための有益な概念かもしれません[111]。 あるメタアナリシスは、プロバイオティクスとプレバイオティクスが成人のインフルエンザワクチンの免疫原性を高めることができることを示唆しました[112]。 |
| 副作用の少ない抗ウイルス薬に関しては、プロバイオティクス製品を抗ウイルス薬と一緒に治療薬として使用できるかどうかを調査した学者もいます[113–115]。 de Andrade et alは、ジカウイルスに対するケフィア(37.5μg/ mL)の能力が、上皮細胞への影響の抑制を介して、またはTリンパ球の増殖に対するウイルスの影響の拮抗作用によって発生したことを示しました[106]。 L. kefiri(100μg/ mL)の使用は、抗ウイルス性サイトカインおよびヒト単球由来樹状細胞の発達を促進し、抗ウイルス剤および抗癌剤として適用できることが示されています[116]。 |
| ケフィアの成分の1つである酵母は、HCVやSARSなどのRNAウイルスの複製部位であることが示されています。この機能は、ウイルス複製の減少のメカニズムを理解するのに役立つ可能性があります。 約100の非必須酵母遺伝子が一部の植物(トマトブッシースタントウイルス、ブロムモザイクウイルスなど)のRNAウイルスの複製に影響を与えるため、酵母は他のヒトRNAウイルスにも影響を与える可能性があります[117,118]。 パーソンズらは、酵母から塩酸アマンタジンを単離し、抗ウイルス能力があることを示しました(図4)[119]。 |
| 図4 ケフィアの抗ウイルス活性 |
| 3.3.1 ウイルス誘発性肺炎 |
| インフルエンザウイルスは、抗ウイルス療法やワクチンで打ち消すことができる季節性の発生を人間に定期的に引き起こします。 それにもかかわらず、これらの治療作用は、免疫抑制された人または高齢者において限られた効力を示すことが多い。 さらに、ウイルスの高い遺伝的柔軟性は、活性ワクチンおよび抗ウイルス剤の有効性を妨げます[120]。 これらの状況では、プロバイオティクス微生物の概日投与がインフルエンザウイルスに対して役立つ可能性があります[121]。 |
| 細菌株乳酸エンテロコッカスフェシウムNCIMB10,415は、直接の接触と相互作用を介してインフルエンザウイルスの影響を鈍らせる可能性があります[20]。 Choiらは、L。アシドフィルス、L。ラムノサス、L。プランタルム、ストレプトコッカスサーモフィラス、ビフィズス菌との嫌気性培養下で発酵させた5つのヨーグルトの無細胞上清(CFS)の抗ウイルス効果を、7つのRNAウイルスと比較して研究しました(インフルエンザウイルスを含む)(122)。 彼らは、プロバイオティクス細菌で発酵させたヨーグルト代謝物を使用して、薬物や発酵乳ベースの食品を改善できることを示しました。 Maruoらは、マウスでエキソポリサッカライドを産生するラクトコッカスラクチス亜種クレモリスで発酵させた牛乳の抗ウイルス能を研究しました[123]。 彼らは、L.lactis亜種のクレモリス発酵乳で処理されたグループのマウスの肺は、対照グループのそれと比較してウイルス力価の有意な減少を示した。 後藤らは、インフルエンザウイルス(H1N1)に感染したマウスにおける非生存および生存L.アシドフィルスの抗ウイルス結果を調査しました。 彼らは、L。アシドフィルスの経口投与後のいくつかの抗ウイルスサイトカインおよびケモカインによって誘発された肺のNK細胞活性の改善がインフルエンザウイルス感染を防ぐ可能性があることを示唆しました[124]。 |
| インフルエンザウイルス(H1N1)に対する市販薬とL.プランタルムの分離株との比較研究では、後者の方が有効性が高いことが示されました[125]。 L.ラムノサスの経口摂取は、体液性および細胞性免疫応答を動機付けることによってマウスの生存率を改善し、インフルエンザウイルス感染に対する宿主の耐性を改善しました[120]。 さらに、Baeらは、ヒト季節性インフルエンザウイルスおよび鳥インフルエンザウイルスに対するL.プランタルムおよびロイコノストックメセンテロイデスプロバイオティクスの抗ウイルス特性をスクリーニングしました[121]。 彼らは、マウスの肺におけるウイルス複製がこれらのプロバイオティクスによって有意に制御されていることを報告しました。 Lactobacillus gasseriにはいくつかの重要な効果があり[121]、小児の肺炎および細気管支炎の主な原因病原体である呼吸器合胞体ウイルス(RSV)に対して有意な活性を示します[126]。 マウスの肺のRSV力価は、L。gasseri治療後に大幅に減少し、RSV感染に起因する炎症性サイトカインの発現についても同様のパターンが観察されます。 |
| 細胞プロテオミクス研究は、SNF2関連CBPアクチベータータンパク質がRSVに対するL.gasseriの活性において生物活性分子であることを示しました[126]。 さらに、Saccharomyces cerevisiaeのβ-グルカンは、IFN-gと一酸化窒素の産生を増加させることにより、豚インフルエンザウイルスに対して効果を示しています[127]。 フリーマンらは、非構造タンパク質3(nsp3)またはパパイン様プロテアーゼ(PLP)の抑制に基づいて、SARS-CoV複製の遮断に関与する小分子を検出するための特定のアッセイを設計しました。 このスクリーニングの理論的根拠は、S。cerevisiaeにおけるnsp3の発現の増強が表現型の著しく遅い増殖を引き起こしたということでした[128]。 PLPはウイルス複製に不可欠です。 どの分子がSARS-CoV複製の抑制に関与しているかを発見するために、酵母ベースのアッセイがPLP活性のために設計されました。 分子のセットをスクリーニングして、PLPの阻害効果をテストし、成長を維持しました。 NSC158362はSARS-CoV複製を排他的にブロックしましたが、nsp3のプロテアーゼ、デユビキチナーゼ、または抗IFN活性への影響は検出されませんでした。 これは、PLP活性が明確に明らかではないSARS-CoV複製の阻害メカニズムを示唆した。 代わりに、PLP機能の変更による直接阻害が予想される場合があります。 さらに、PLPプロテアーゼの活性は、サプレッサーNSC158011で処理した場合、細胞ベースのアッセイで阻害されました(表1)。 |
| 表1 ケフィアのプロバイオティクス微生物と その抗ウイルス活性 |
| 3.3.3 単純ヘルペスウイルス(HSV) |
| HSVはヘルペス感染の主な原因であり、体の多くの部分で発症する可能性がありますが、最も頻繁には性器(HSV-2)または口(HSV-1)で発症します[100,131–133]。 L.lactis亜種lactis、L.rhamnosusとL.brevis、およびL.crispatusはそれぞれHSV-1とHSV-2に対して活性を持っています[100]。 最近の研究では、L.lactis亜種lactisの精製バクテリオシンがHSV-1に対して顕著な阻害活性を示し、新しい抗ウイルス剤として使用できることが明らかになりました[100]。 さらに、Khani et alは、L。rhamnosusがHSV-1除去のマクロファージ生存率を改善したと述べました[131]。 L. brevisは、分子量が10kDaを超える複合材料に関連するHSV-2の繁殖を阻害する効果があります。 これは、耐熱性の非タンパク質細胞表面細菌成分のために可能です[132]。 Mousaviらは、哺乳類のVeroおよびHeLa細胞株におけるHSV-2に対するL.crispatusの阻害活性をスクリーニングしました。[133] L.crispatusはHSV-2粒子を「キャッチ」するように見えました。 さらに、細胞表面でのL. crispatusの微小コロニーの実現は、HSV-2受容体をブロックし、感染初期の細胞へのウイルスの侵入を回避する可能性があります(表1)。 |
| 3.3.4 エンテロウイルス |
| エンテロウイルスは、一般的に軽度の多くの感染症の原因です。 それにもかかわらず、中枢神経系のエンテロウイルス感染は深刻な健康障害を引き起こす可能性があります[134]。 ほとんどのエンテロウイルスはGITで繁殖するため、LABはGITでそれらを防御できます[134]。 多くの研究が、選択されたエンテロウイルスに対する抗ウイルス剤としての市販のプロバイオティクスの活性を示しています[134,135]。 2016年に、2つの市販のプロバイオティクスが抗ウイルス活性について調査されました。 Lactobacillus reuteriProtectisおよびLactobacilluscasei Shirotaを、ヒト結腸および骨格筋細胞において、エンテロウイルス71(EV71)、コクサッキーウイルスA型(CA)、6株(CA6)、およびCA16(手足口病の主な病原体)に対して検査しました。行。 L. reuteriProtectisはEV71に対してかなりの活性を示しました[135]。 著者らは、ウイルス粒子と細菌の間の物理的相互作用によって抗ウイルスの結果が達成され、哺乳類の宿主細胞へのウイルスの侵入が停止したと主張した。 L.カゼイシロタの抗ウイルス結果は文書化されていません。 Sunmolaらは、エンテロウイルスに対するLABL.plantarumおよびL.amylovorusの抗ウイルス活性を調べました[134]。 彼らは、細菌細胞ペレット、CFS、および培養液中のL.plantarumおよびL.amylovorusのエコーウイルス7(E7)およびE19に対する抗ウイルス活性を治療前後で実証しました。 さらに、コクサッキーウイルスに対する阻害活性は、L。プランタルム、L。アシドフィルスおよびL.ラムノサス株とそれらの誘導体によって示されました(表1)[122,136]。 |
| 3.3.5 その他のウイルス |
| ノロウイルス(NV)やA型肝炎ウイルスなどの食品媒介性ウイルスは、食品媒介性ウイルス感染を阻止するための新しく効果的な方法の開発を必要とする主要な公衆衛生上の懸念事項です[137]。 Aboubakrらは、ネコカリシウイルス(ヒトNVの代替)に対するプロバイオティクスLABの抗ウイルス活性を測定しました[137]。 彼らは、L.lactis亜種lactisの使用がウイルス力価の低下をもたらすことを実証しました。 L. reuteriは、宿主細胞へのCAの侵入を損なう細菌とウイルスの直接的な相互作用により、CAに対して有意な活性を示します[135]。 さらに、L。アシドフィルスやビフィズス菌などのプロバイオティクスの投与を調査したところ、IFN-αとリバビリンの調節による抗HCV治療に対する治癒反応の増強が明らかになりました(表1)[95]。 |
| 4. 結論と将来の展望 |
| COVID-19のパンデミックは世界中で大混乱を引き起こしており、すべての科学コミュニティにとって大きな懸念事項です。 SARS-CoV-2に対する特定のワクチンは入手できませんが、抗ウイルス剤(リバビリン、アシクロビル、ガンシクロビル、ノイラミニダーゼ阻害剤)は調査中です[19]。 しかし、COVID-19と戦うための適切な治療法を見つける試みには、免疫系が関与している必要があります。 |
| ケフィアとその成分は、免疫反応において重要な調節的役割を果たしています。 この点で、ジカウイルス、HCV、B型肝炎ウイルス、インフルエンザウイルス(H1N1)、HSV、ライノウイルス、レトロウイルスに対する活動が報告されています。 |
| 一部のCOVID-19患者は、1 L-6、IL-1、TNF-α、およびIFN-γが関与するサイトカインストームに起因する大規模な炎症反応の後に死亡すると仮定されています。 サイトカインストームから患者を保護するために提案された最初の解決策は、IL-6機能の遮断または炎症を抑制するための化合物の投与です。 ケフィアは炎症性サイトカインの活性を阻害する可能性があります。 COVID-19患者における炎症性サイトカインの発現の阻害剤としてケフィア(およびその副産物)を使用することは、実行可能な方針である可能性があります。 SARS CoV-2の複製はpHに依存するため、ケフィアの消費とpHを変化させる能力との関連を解明することは価値があります[44,45]。 研究によると、ケフィアのpHは酸性(pH 4.6)であることが報告されています[21,138]。 この酸性度は、酸性細菌のさまざまな集団に関連しています[139,140]。 Rea et alは、ケフィア粒の酸性pHが病原性活動を妨げる可能性があることを報告しました[139]。 ケフィアは、酸性の二次代謝産物を生成し、分解されないため、消費時に特定の領域のpHを変化させる可能性があります。 CoVの融合は弱アルカリ性のpHで起こるため[141]、ケフィアの消費と特定の身体部位のpH変化およびウイルス感染との関係を確認することは価値があります。 |
| ケフィアとそのプロバイオティクス微生物について行われたすべての研究に基づいて、ケフィアはウイルス感染に対する保護剤として機能する可能性があります。 |
| この文献は、Biomedicine & Pharmacotherapy 133 (2021) 110974に掲載されたKefir: A protective dietary supplementation against viral infectionを日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |