
Kenji Uchida et al., |
要約 |
| 蓄積された証拠は、ケフィアから分離されたLactococcus lactis subsp. cremoris YRC3780がアレルギー反応を緩和する可能性があることを示唆しています。ここでは、スギ花粉症(JCP)のマウスモデルに対するLactococcus lactis subsp. cremoris YRC3780の効果を調査しました。スギ花粉抽出物(CPE)で免疫化されたBALB/cマウスは、血清免疫グロブリンEの増加を示し、鼻腔内アレルゲンチャレンジ時にくしゃみ、鼻過敏症、鼻好酸球蓄積などの鼻炎症反応を起こしました。これらの反応はLactococcus lactis subsp. cremoris YRC3780の経口投与によって抑制されましたが、スギ花粉抽出物誘発性くしゃみ反応および好酸球浸潤に対する効果は統計的に有意ではありませんでした。総糞便微生物叢の多様性は、アレルゲン免疫化およびチャレンジまたはLactococcus lactis subsp. cremoris YRC3780投与によって影響を受けませんでした。しかし、Lactococcus lactis subsp. cremoris YRC3780 を投与したマウスでは、スギ花粉抽出物感染マウスや Lactococcus lactis subsp. cremoris YRC3780 を投与していないマウスと比較して、Bifidobacteriales, Veillonellaceae, Lactococcus, およびLactococcus lactisの存在量が多く、Bacteroides の存在量は少なかった。私たちの研究結果は、スギ花粉症の緩和に Lactococcus lactis subsp. cremoris YRC3780 が有用であることを示唆している。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. Lactococcus lactis subsp. cremoris YRC3780 の調製 |
| 2.2. マウスへの Lactococcus lactis subsp. cremoris YRC3780 の投与 |
| 2.3.スギ花粉症モデルマウス |
| 2.4. 血清 IgE レベルの測定 |
| 2.5. 微生物叢解析 |
| 2.6. 統計分析 |
| 3. 結果 |
| 3.1. Lactococcus lactis subsp. cremoris YRC3780 の血清 IgE 反応に対する効果 |
| 3.2. 鼻の反応に対する効果 |
| 3.3. 鼻粘膜における好酸球蓄積への影響 |
| 3.4. 糞便微生物叢への影響 |
| 3.4.1. 微生物叢の多様性 |
| 3.4.2. 細菌種 |
| 4. 考察 |
| 本文 |
| 1.はじめに |
| 近年、アレルギー疾患の患者数は世界中で年々増加しています。特に日本では、2019年時点でアレルギー性鼻炎(AR)の有病率は49.2%で、10年間で約10%増加しています[1]。日本のアレルギー性鼻炎患者の約80%(全人口の38.8%)はスギ花粉症(JCP)に罹患しています[1]。スギ花粉症を含むアレルギー性鼻炎の現在の治療は、くしゃみ、鼻漏、鼻づまりなどの症状を緩和し、鼻の炎症を抑える薬剤が中心です。皮下および最近承認された舌下免疫療法は、疾患活動を調節する可能性があります。しかし、多数のアレルギー性鼻炎患者に薬剤を処方することは、多大な費用と重篤な副作用による罹患率に対する懸念を引き起こします[2]。バイオ製品の経口投与、特に舌下免疫療法の成功に触発されて、我々はアレルギー性鼻炎の発症を予防し症状を緩和する免疫調節効果を示す食品の可能性に興味を持つようになりました。最近の報告では、べにふうき茶[3]や発酵果汁飲料[4]に加えて、乳酸菌、酢酸菌、ビフィズス菌を含むいくつかの食品がスギ花粉症[5,6,7,8,9,10,11,12,13,14,15]を含むアレルギー性鼻炎に有効であることが示唆されています。たとえば、スギ花粉症の二重盲検プラセボ対照試験に基づくと、Lactobacillus paracasei KW3110、 Lactobacillus acidophilus L-55およびL-92、Lactobacillus casei Shirota、およびBifidobacterium longum BB536 が患者の症状をある程度改善すると報告されています[5,6,7,8,9,10]。 |
| Lactococcus lactis subsp. cremoris YRC3780は、コーカサス地方で習慣的に消費されている伝統的な発酵乳製品であるケフィアから分離されました。Lactococcus lactis subsp. cremoris YRC3780は、加熱殺菌された形であっても、いくつかの動物実験で免疫調節効果を示しました。たとえば、大腸がん移植マウスモデルでは、経口生Lactococcus lacti subsp. cremoris YRC3780投与後に血清IL-2レベルとナチュラルキラー細胞活性が増加しました[16]。アレルゲン誘発性IL-4産生は抑制され、免疫マウス脾臓細胞とLactococcus lactis subsp. cremoris YRC3780の共培養によりIL-12産生が促進され、Th1/Th2バランスに有益な効果が示唆されました。アトピー性皮膚炎様のマウス皮膚炎症モデルにおいて、加熱殺菌したLactococcus lactis subsp. cremoris YRC3780を経口投与すると、アレルギー誘発性皮膚反応が緩和され、パイエル板と流入領域リンパ節のCD4+ T細胞におけるIL-4とIL-33の発現がそれぞれ減少した[17]。生Lactococcus lactis subsp. cremoris YRC3780のヒトアレルギーに対する有効性も、いくつかの臨床研究で示唆されている[18,19]。これらのげっ歯類およびヒトの研究では、Lactococcus lactis subsp. cremoris YRC3780の有害な影響は報告されていない。 |
| 本研究では、スギ花粉抽出物で免疫しチャレンジするスギ花粉症の実験モデル[20]を使用して、Lactococcus lactis subsp. cremoris YRC3780の有効性を評価しました。このマウススギ花粉症モデル(図1)は、スギ花粉症患者と同様のアレルギー反応、すなわち血清免疫グロブリンE(IgE)レベルの上昇、スギ花粉抽出物誘発性くしゃみ反応、鼻粘膜への好酸球蓄積、およびアレルギー性鼻炎症状を増強する病態生理学的特徴である鼻過敏症(NHR)を示します[21]。私たちは以前、同様のアレルゲンで免疫しチャレンジしたマウスモデルでデキサメタゾンと舌下免疫療法の有効性を実証しました[22,23]。加熱殺菌したLactococcus lactis subsp. cremoris YRC3780のこれらのアレルゲン誘発反応に対する効果は、糞便微生物叢の変動をモニタリングすることによって調査されました。 |
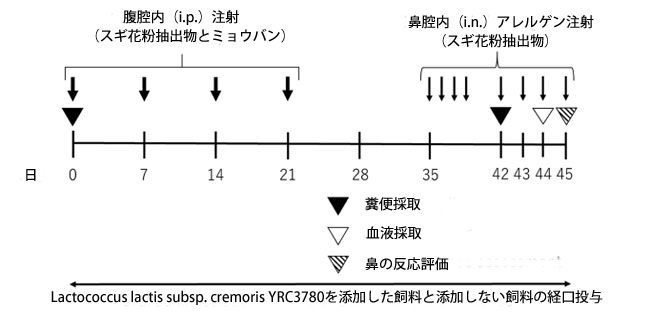 |
図 1 スギ花粉症のマウスモデルの実験スケジュール。 腹腔内(i.p.)注射でスギ花粉抽出物(CPE)とミョウバンを接種して免疫化した BALB/c マウスに、鼻腔内(i.n.)アレルゲンを注射して攻撃した。 実験期間中、マウスには標準的なげっ歯類用飼料 CE-2(Crea-Japan Inc., Tokyo, Japan)を与え、これに Lactococcus lactis subsp. cremoris YRC3780(YRC3780)を添加した場合と添加しない場合とで対照をとった。血液と糞便の採取および鼻の反応評価は、指定日に実施した。詳細な実験手順はセクション 2 に記載している。 |
| 2. 材料と方法 |
| 2.1. Lactococcus lactis subsp. cremoris YRC3780 の調製 |
| Lactococcus lactis subsp. cremoris YRC3780 はよつ葉乳業株式会社(Hokkaido, Japan)によって単離され、M17 培地(Merck KGaA、Darmstadt, Germany)に接種され、30 °C で 16 時間培養されました。別の実験で、得られた Lactococcus lactis subsp. cremoris YRC3780 が約 3~4 × 1011 コロニー形成単位/g を示したことを確認しました。次に、細胞を 4 °C で 10 分間、8000 rpm で遠心分離して回収し、2 回洗浄し、滅菌蒸留水に再懸濁しました。100 °C で 10 分間熱処理した後、細胞を凍結乾燥し、0.2% (w/w) の濃度で標準げっ歯類飼料(CE-2、Crea-Japan Inc., Tokyo, Japan)と混合しました。 |
| 2.2. マウスへの Lactococcus lactis subsp. cremoris YRC3780 の投与 |
| 7 週齢の特定病原体フリー雌 BALB/c マウスを日本クレア株式会社から購入しました。マウスは、温度 (25 ± 2 °C)、湿度 (50 ± 10%)、光 (12 時間の明暗サイクル) が制御された条件下で、ミリ Q 水と CE-2 を摂取しました。少なくとも 7 日間の馴化期間の後、Lactococcus lactis subsp. cremoris YRC3780 群には実験期間を通して 0.2% Lactococcus lactis subsp. cremoris YRC3780 を含む CE-2 を摂取しました (図 1)。45 日間連続投与には CE-2 に含まれる Lactococcus lactis subsp. cremoris YRC3780 の品質が安定している必要があるため、本研究では加熱殺菌した形態を使用しました。 |
| 2.3.スギ花粉症モデルマウス |
| スギ花粉症の実験的マウスモデルは、以前に説明した方法 [20] に若干の修正を加えて開発されました (図 1)。簡単に説明すると、BALB/c マウスに、0.5 mg のミョウバン (Imject Alum、Thermo Fisher Scientific Inc.、Chicago, IL, USA) で乳化した 10 μg の スギ花粉抽出物(Cedar Pollen Extract-cj、Cosmo bio、Tokyo, Japan) を腹腔内注射して、0、7、14、21 日目に免疫しました (図 1)。35~38 日目と 42~45 日目に、マウスに 0.1 mg/mL スギ花粉抽出物溶液を 5 分間隔で 1 鼻孔あたり 5.75 μL ずつ 2 回鼻腔内投与して、1 日 1 回チャレンジしました。Normal群は、スギ花粉抽出物免疫およびチャレンジと同じ方法で、生理食塩水を腹腔内および鼻腔内に注射して、ネガティブ コントロール用に準備しました (図 1)。 |
| 最後のアレルゲンチャレンジ直後、5分間のくしゃみの回数を数えることで鼻症状を評価した。6時間後、100 mM ヒスタミン(Nacalai Tesque Inc., Kyoto, Japan)溶液を各鼻孔に5 μL ずつ鼻腔内投与した後、5分間のくしゃみの回数を数えることで鼻過敏症を評価した。鼻過敏症評価直後、以前に記載したように鼻洗浄を実施した[23]。鼻洗浄液(NALF)中の白血球数を血球計数器を使用して計数した。Diff-Quik(Sysmex、Kobe, Japan)で染色した細胞遠心分離標本の顕微鏡検査を通じて、少なくとも200個の細胞について形態学的基準に基づく分化細胞分類を実施した。 |
| 2.4. 血清 IgE レベルの測定 |
| アレルゲン誘発 IgE 反応は、血清総 IgE を測定することで評価しました。マウスへの侵襲性の影響を減らすために、末梢血採取は、鼻腔反応評価および糞便採取日に近いが、異なる 44 日目に実施しました。血清 IgE レベルは、製造元の指示に従って、LBIS マウス IgE ELISA キット (Fujifilm Wako Pure Chemical, Osaka, Japan) を使用して評価しました。 |
| 2.5. 微生物叢解析 |
| 糞便微生物叢を調査するため、メタゲノム次世代シーケンシング解析を実施した。0日目と42日目に各マウスから採取した糞便を、ZymoBIOMICS DNA Miniprep Kit (ZYMO Research、Irvine, CA, USA) を用いて製造元の指示に従って DNA 抽出に使用した。16S rDNA の V4 領域を、KAPA Hifi HS ReadyMix (NIPPON Genetics、Tokyo, Japan)、F515 プライマー (5′-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGGTGYCAGCMGCCGCGGTAA-3′)、および R806 プライマー (5′-TCGTCGGCAGCGTCAGATGTGTATAAGACAGGTGYCAGCMGCCGCGGTAA-3′) で増幅し、AMPure XP (Beckman CoulterBrea, CA, USA) を使用して精製した。 DNA ライブラリーは、Nextera XT DNA ライブラリー調製キット (Illumina Inc.、San Diego, CA, USA) を使用して調製し、iSeq100 (Illumina Inc.) で解析しました。得られた FastQ シーケンスは、FASMAC (Kanagawa, Japan) での OTU および微生物生態学の定量的洞察解析に適用されました。分類学上の分類は、ローレンス バークレー国立研究所 (Berkeley, CA, USA) が提供する Greengenes データベースと、マックス プランク海洋微生物学研究所およびヤコブス大学 (Bremen, Germany) が提供する SILVA データベース (SILVA131) に基づいて実施しました。実験開始から 42 日目に微生物叢の多様性の変化を、OTU 数、Chao1 指数、シャノン多様性指数、およびいくつかの細菌種の構成を評価することで評価しました。 |
| 2.6. 統計分析 |
| データは平均値±平均値の標準誤差として提示されます。3 つのグループ間の差は、BellCurve for Excel (Social Survey Research Information Co., Tokyo, Japan) の Kruskal–Wallis 検定と Dunnet の多重比較検定を使用して分析されました。p 値が 0.05 未満の場合、統計的に有意であると判断されました。 |
| 3. 結果 |
| 3.1. Lactococcus lactis subsp. cremoris YRC3780 の血清 IgE 反応に対する効果 |
| マウススギ花粉症モデル (図 1) は、以前に説明したようにスギ花粉抽出物による免疫化とチャレンジによって確立されました [20]。YRC3780 の投与は、0.2% Lactococcus lactis subsp. cremoris YRC3780 を含む食事の自由経口摂取によって達成されました。アレルゲン誘発性 IgE 反応は、末梢血中の血清 IgE レベルを評価することによって評価されました。アレルゲンで免疫化およびチャレンジしたマウス (コントロール グループ) の血清 IgE レベルは、免疫化およびチャレンジしていないマウス (通常グループ) と比較して有意に上昇しました。アレルゲン誘発性血清 IgE 反応は、Lactococcus lactis subsp. cremoris YRC3780 を投与したマウス (YRC3780 グループ) で有意に抑制されました (図 2)。 |
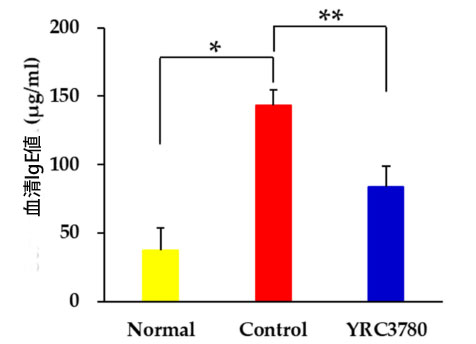 |
図 2 血清免疫グロブリン E (IgE) 反応に対する Lactococcus lactis subsp. cremoris YRC3780 の効果。 スギ花粉抽出物で免疫化したマウスに、Lactococcus lactis subsp. cremoris YRC3780 を経口投与した (YRC3780) または経口投与しない (Control) 鼻腔内アレルゲン注射でチャレンジしました。免疫化せずチャレンジしなかったマウス (Normal) は陰性コントロールでした。血清 IgE レベルは、図 1 に示すように 44 日目に評価しました。データは、各グループの 12 匹のマウスの平均 ± 標準誤差として表されます。* p < 0.05、** p < 0.01。 |
| 3.2. 鼻の反応に対する効果 |
| アレルゲン誘発性鼻の反応に対するLactococcus lactis subsp. cremoris YRC3780の効果を調査しました。鼻腔内スギ花粉抽出物投与により、対照群のくしゃみの頻度が有意に増加しました。アレルゲン誘発性くしゃみ反応は、Lactococcus lactis subsp. cremoris YRC3780投与によりわずかに軽減されましたが、有意ではありませんでした(図3a、p = 0.08)。私たちの以前の研究では、このモデルにおけるアレルゲン誘発性くしゃみ反応は、IgE依存性マスト細胞脱顆粒ではなく、T細胞依存性鼻鼻過敏症を表していることが実証されています[24]。したがって、アレルゲン誘発性鼻過敏症に対するLactococcus lactis subsp. cremoris YRC3780の効果を調べました。ヒスタミン誘発性くしゃみ反応は対照群で有意に増強され、鼻過敏症の発生を示しました。鼻過敏症はLactococcus lactis subsp. cremoris YRC3780投与により有意に抑制されました(図3b)。 |
| 3.3. 鼻粘膜における好酸球蓄積への影響 |
| アレルギー誘発性の鼻粘膜における好酸球蓄積は、好酸球と総炎症細胞の比率および鼻洗浄液 (NALF) 中に回収された好酸球の数によって評価されました。免疫マウスに対する スギ花粉抽出物 チャレンジは、鼻洗浄液中の好酸球比率の有意な増加を引き起こしました。アレルギー誘発性の鼻洗浄液好酸球比率の増加は、Lactococcus lactis subsp. cremoris YRC3780 投与によって抑制されました (図 4a)。本質的に同じ傾向が、有意ではありませんが、鼻洗浄液好酸球の数にも見られました。 |
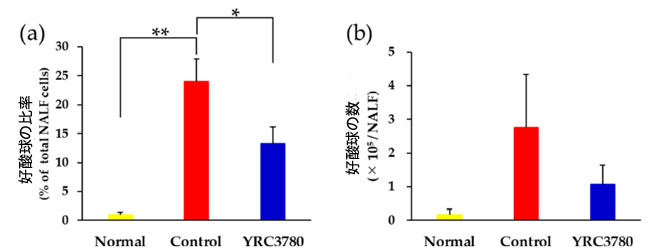 |
図 4 アレルゲン誘発性鼻腔好酸球蓄積に対する Lactococcus lactis subsp. cremoris YRC3780 の効果。 スギ花粉抽出物で免疫化したマウスに、Lactococcus lactis subsp. cremoris YRC3780 を経口投与した (YRC3780) または経口投与しない (Control) 鼻腔内アレルゲン注射でチャレンジしました。免疫化せずチャレンジしたマウス (Normal) は陰性コントロールでした。鼻洗浄液 (NALF) 中の好酸球の比率 (a) と数 (b) は、最後のアレルゲンチャレンジから 6 時間後に評価しました。データは、11 匹 (Control) または 12 匹 (YRC3780、Normal) のマウスの平均 ± 標準誤差として表されます。* p < 0.05、** p < 0.01。 |
| 3.4. 糞便微生物叢への影響 |
| 3.4.1. 微生物叢の多様性 |
| 実験期間中の糞便微生物叢の多様性の変化を調べた結果を図1に示す。操作的分類単位(OTU)数(3914 ± 608)およびChao1指数(15678 ± 1615)やShannon多様性指数(4.21 ± 0.10)などのα多様性の指標の基準値は、以前の研究[25]で実証されたものと同等であった。実験開始から42日目に、NormalグループでOTU数のわずかな増加が観察された。スギ花粉抽出物免疫およびチャレンジは、Lactococcus lactis subsp. cremoris YRC3780投与に関係なく、OTU数を増加させる傾向があったが、有意ではなかった(図5a)。おそらく OTU 数の自発的な変動が原因で、Chao1 指数のわずかな増加と、逆に Shannon 多様性指数の減少がNormalグループで観察されましたが、これらのパラメータはアレルゲンまたは Lactococcus lactis subsp. cremoris YRC3780 処理による影響を受けませんでした (図 5b、c)。これらの差は統計的に有意ではなかったため、Lactococcus lactis subsp. cremoris YRC3780 が胃腸内微生物叢の全体的な多様性に及ぼす影響は、あったとしてもごくわずかであることが示唆されました。 |
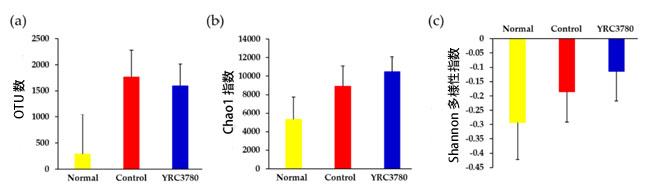 |
図 5 Lactococcus lactis subsp. cremoris YRC3780 の糞便微生物叢多様性への影響。 スギ花粉抽出物で免疫したマウスに、Lactococcus lactis subsp. cremoris YRC3780 の経口投与あり (YRC3780) またはなし (Control) で、鼻腔内アレルゲン注射によるチャレンジを行いました。免疫付与もチャレンジも行っていないマウス (Normal) はネガティブ コントロールでした。 糞便中の微生物叢の構成は、図 1 に示すように 0 日目と 42 日目に分析しました。実験開始からの OTU (操作分類単位) 数 (a)、Chao1 指数 (b)、および Shannon 多様性指数 (c) の変化を計算しました。データは、各グループの 12 匹のマウスの平均 ± 標準誤差として表されます。 |
| 3.4.2. 細菌種 |
| 実験期間中の微生物叢構成の変化を分析することにより、経口 Lactococcus lactis subsp. cremoris YRC3780 投与がいくつかの糞便細菌種に与える影響を評価しました。実験開始から 42 日目に、Normalグループでも Bifidobacteriales と Bacteroides の自然減少と Veillonellaceae の増加が観察されました (図 6)。免疫化と スギ花粉抽出物によるチャレンジにより、Veillonellaceae、Lactococcus、および Lactococcus lactis の構成が大幅に減少しました。Controlグループでは、Lactococcus lactis subsp. cremoris YRC3780グループでBifidobacteriales、Veillonellaceae、Lactococcus、および Lactococcus lactis の構成が大幅に増加し、Bacteroides の構成が減少しました。 Lactococcus lactis subsp. cremoris YRC3780 グループでは、Normalグループと比較しても、Bifidobacteriales, Lactococcus, と Lactococcus lactis の量が有意に多く、Bacteroidesの量が低かった (図 6)。これは、Lactococcus lactis subsp. cremoris YRC3780 のアレルゲン非依存効果の存在を示唆している。対照的に、スギ花粉抽出物による Veillonellaceae 組成のダウンモジュレーションは、Lactococcus lactis subsp. cremoris YRC3780 投与により回復した。この結果は、アレルゲン誘発性血清 IgE、鼻過敏症、および鼻腔好酸球反応に対する Lactococcus lactis subsp. cremoris YRC3780 の効果と平行していた。 |
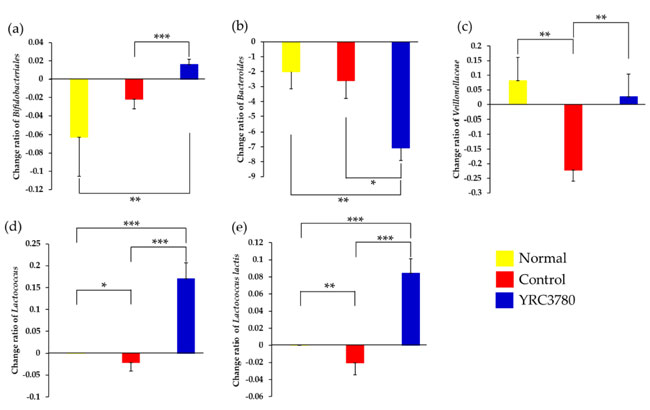 |
図 6 Lactococcus lactis subsp. cremoris YRC3780 が糞便細菌種の変化に与える影響。 スギ花粉抽出物で免疫したマウスに、Lactococcus lactis subsp. cremoris YRC3780 を経口投与した (YRC3780) または経口投与しない (Control) 鼻腔内アレルゲン注射で感染させた。非免疫および感染させたマウス (Normal) は陰性コントロールとした。 糞便中の微生物叢の構成は、図 1 に示すように 0 日目と 42 日目に分析した。実験開始時からの Bifidobacteriales (a)、Bacteroides (b)、Veillonellaceae (c)、Lactococcus (d)、および Lactococcus lactis (e) の存在量の変化率を計算した。データは、各グループの 12 匹のマウスの平均 ± 標準誤差として表される。* p < 0.05、** p < 0.01、*** p < 0.001。 |
| 4. 考察 |
| 本研究では、Lactococcus lactis subsp. cremoris YRC3780 は、好酸球比の低下とともに IgE 産生、鼻過敏症発達、鼻炎をダウンレギュレーションすることで、アレルギー性鼻炎の病因を変える可能性があることが実証されました。私たちの研究結果は、Lactococcus lactis subsp. cremoris YRC3780 のこれらの有益な効果と、総微生物叢の多様性には影響がないものの、いくつかの消化管細菌種への影響との間に関係がある可能性を示唆しています。 |
| Lactococcus lactis subsp. cremoris YRC3780 の IgE 合成に対するダウンモジュレーション効果は、Lactococcus lactis subsp. cremoris YRC3780 処理により in vitro での脾臓細胞および in vivo でのパイエル板 CD4+ T 細胞の IL-4 発現が減少することを実証した以前の研究によって裏付けられています [17]。マウスはスギ花粉抽出物で免疫化されたため、総 IgE 応答はスギ花粉抽出物特異的 IgE 応答を反映すると予想されました。したがって、この効果はおそらく、主に IgE を介した肥満細胞の脱顆粒によって引き起こされるアレルゲン誘発性くしゃみ応答の抑制傾向に関連しています。さらなる概念実証として、私たちは最近、Lactococcus lactis subsp. cremoris YRC3780 を含む飲むヨーグルトのランダム化二重盲検プラセボ対照試験で、アレルギー性鼻炎の成人患者における IgE および肥満細胞依存性の目のかゆみが抑制されることを実証しました [19]。Lactobacillus helveticus株を投与されたスギ花粉抽出物免疫マウスでは、アレルゲン誘発血清IgE応答が減少したことも報告されている[26]。 |
| アレルゲン誘発性のくしゃみ反応は 鼻過敏症と関連しています。私たちのマウスアレルギー性鼻炎モデルでは、鼻過敏症の発生は主にアレルゲン特異的 T 細胞に依存していました。この研究で示されているように、アレルゲンで免疫化およびチャレンジしたマウスにおけるヒスタミン誘発性のくしゃみ反応の増強は、CD4+ T 細胞を枯渇させることによって抑制されました。さらに、in vitro 分化 T 細胞サブセットを移植したマウスは、IgE および肥満細胞関連の反応とは無関係に、アレルゲンチャレンジ時に顕著な 鼻過敏症を発症しました [24]。これらの観察結果は、CD4+ T 細胞が Lactococcus lactis subsp. cremoris YRC3780 を介した 鼻過敏症抑制の主な標的の 1 つである可能性が高いことを示しています。Lactococcus lactis subsp. cremoris YRC3780 の IL-4 活性抑制能力に加えて、私たちは最近、抗原提示細胞と CD4+ T 細胞の共培養において Lactococcus lactis subsp. cremoris YRC3780 が IFN-γ の産生を増強することを実証しました。この点で、Lactococcus lactis subsp. cremoris YRC3780はTh1/Th2バランスを改善する可能性があります。他の乳酸菌の研究でも同様の効果が報告されています。シラカバ花粉アレルギーのマウスモデルにおいて、RepaらはLactococcus lactisとLactobacillus plantarumの投与によりIgG2aとIFN-γの産生がアップレギュレーションされることを実証しました[27]。Lactobacillus gasseri株の投与により、スギ花粉抽出物免疫マウスにおけるアレルゲン誘発性腹膜好酸球増多症のダウンレギュレーションと血清IgG2a/IgG1比の上昇も報告されています[28]。 |
| アレルゲン誘発性の局所的好酸球蓄積も、CD4+ T細胞によって媒介される。我々は以前の研究[29]で、アレルゲン特異的T細胞移植マウスの気道好酸球増多が抗IL-5中和抗体治療によって解消されることを実証した。さらに、周産期母体マウスにLactobacillus paracasei 株を投与すると、子孫における好酸球蓄積とIL-5産生を伴う白樺花粉誘発性気管支炎症が減少した[30]。Lactococcus lactis subsp. cremoris YRC3780のIL-5合成に対する効果を確認する必要がある。Wangらは、Lactococcus lactis subsp. cremoris YRC3780を投与したアトピー性皮膚炎モデルマウスの排出リンパ節で、別の好酸球活性化サイトカインであるIL-33の発現が減少することを実証した[17]。 鼻過敏症の発症に関与する T 細胞由来因子に加えて、Lactococcus lactis subsp. cremoris YRC3780 が CD4+ T 細胞に及ぼす影響の根底にあるメカニズムもまだ解明されていません。 |
| 本研究のように、加熱殺菌した形態であっても、いくつかの乳酸菌による胃腸内細菌叢の改変が報告されている[31,32]。生きた微生物ベースのプロバイオティクスに加えて、ポストバイオティクスの概念が腸内環境の維持のために最近注目されている。本研究で使用したように、非生存微生物と無細菌抽出物に基づくポストバイオティクスは、プロバイオティクスの生物活性を高めることで宿主に利益をもたらす[33]。総微生物叢の多様性への影響は観察されなかったが、いくつかの細菌株の構成はLactococcus lactis subsp. cremoris YRC3780投与の影響を受けた。特に、アレルゲン誘発性ダウンレギュレーションからのVeillonellaceaeの回復は、アレルギー性鼻炎応答に対するLactococcus lactis subsp. cremoris YRC3780の効果に関連している。アレルギー反応への直接的な影響は報告されていない。しかし、消化管中のVeillonellaceaeの含有量と食物過敏症[34]およびアトピー[35]との間に強い関連性があることが報告されている。Lynchらは、気管支喘息の発症と環境中のハウスダスト中のVeillonellaceaeの存在との相関関係を実証した[36]。Veillonellaceaeがアレルギー反応に直接及ぼす影響については、さらなる調査が必要である。 |
| 結論として、アレルゲン誘発性血清IgE産生、鼻過敏症、および鼻腔好酸球増多に対する抑制効果に基づくと、加熱殺菌された形態であっても、Lactococcus lactis subsp. cremoris YRC3780の経口摂取は、スギ花粉抽出物媒介スギ花粉症を含むアレルギー性鼻炎の現在利用可能な治療薬への有望な追加です。Lactococcus lactis subsp. cremoris YRC3780の有用性、および胃腸内微生物叢の変化を含むその基礎となるメカニズムをさらに詳しく説明するには、追加の研究が必要です。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Pathogens. 2022 Nov; 11(11): 1347.に掲載されたSuppressive Effect of Lactococcus lactis subsp. cremoris YRC3780 on a Murine Model of Japanese Cedar Pollinosis.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |