
Dong‐Hyun Jang et al., |
要約 |
| 細胞老化と腸内細菌叢の変化との複雑な相互作用は、老化プロセスにおける極めて重要な軸として浮上しており、全身性炎症、生理学的衰退、そして加齢関連疾患への素因への寄与がますます認識されています。様々なストレス因子への反応として細胞分裂の停止を特徴とする細胞老化は、組織内の形態学的および機能的変化を引き起こします。老化細胞の複雑性と多様性は、老化関連分泌表現型(SASP)の分泌と相まって、炎症誘発性経路を介して老化プロセスを悪化させ、微小環境と免疫系に影響を及ぼします。同時に、加齢に伴う腸内細菌叢の多様性と構成の変化は、ディスバイオシス(腸内細菌叢の乱れ)に寄与し、全身性炎症をさらに悪化させ、様々な身体機能の健全性を損ないます。本レビューは、細胞老化と腸内細菌叢のディスバイオシスの相互関係に関する急速な研究を概説し、骨粗鬆症、サルコペニア、変形性関節症といった加齢に伴う筋骨格系疾患への相乗的な影響に焦点を当てています。また、健康的な老化と老化関連疾患の進行抑制のための革新的戦略として、腸内細菌叢の調節と細胞老化を標的とした可能性についても探究します。本レビューは、老化治療薬やプロバイオティクス療法の開発を含む標的介入を検討することで、新たな治療法の開拓を目指しています。これらの戦略は、細胞老化と腸内細菌叢の変化との関連性を活用し、高齢者の健康寿命の延伸と生活の質の向上を目的とした老化研究と介入の開発を推進します。 |
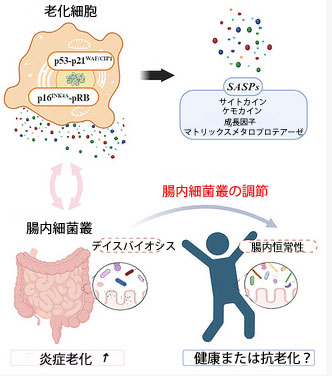 |
| グラフィック アブストラクト |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 老化細胞の増加と老化プロセスへの影響 |
| 3. 加齢に伴う腸内細菌叢の変化 |
| 4. 筋骨格系疾患と腸内細菌叢のディスバイオシスの相関関係 |
| 5. 新たなつながり:加齢に伴う細胞老化と腸内細菌叢の変化 |
| 6. 健康的な老化のための腸内細菌叢の調節 |
| 7. 結論と今後の展望 |
| 本文 |
| 1.はじめに |
| 老化は諸刃の剣です。世代交代を通じて種の進化を促し、遺伝的多様性と適応を促進します。しかしながら、個人レベルでは、老化は普遍的に克服すべき課題とみなされています。先進国では、栄養、衛生、社会福祉の進歩が平均寿命の延長に貢献しているにもかかわらず、これらの進歩は必ずしも健康期間の延長にはつながっていません。そのため、持続可能な社会システムと医療システムにとって重大な課題となっています。その結果、研究の焦点は、平均寿命の延長と、健康寿命と呼ばれるその余命における生活の質の向上へと移行しています。 |
| 高等動物の老化過程に関与する因子の中で、近年、2つの現象が重要な要因として浮上している。それは、分裂を停止しているものの死滅せず代謝が活発な細胞である老化細胞の蓄積と、腸内細菌叢の構成における大きな変化である。しかし、これらの因子間の複雑な相互作用とそれらが老化に及ぼす総合的な影響は、解明が始まったばかりである。新たな証拠は、加齢に伴う老化細胞の増加と腸内細菌叢の構成の変化が、特に宿主の免疫系との相互作用を通じて、老化過程に双方向の影響を及ぼすことを示唆している。本レビューは、細胞老化と腸内細菌叢の変化の関係を詳細に検討するための基礎を築き、最新の研究成果を強調するとともに、今後の研究の重要分野を特定するものである。 |
| López‐Otínらは、ゲノム不安定性、テロメア減少、エピジェネティックな変化、ミトコンドリア機能不全、細胞老化など、老化の9つの特徴を概説した基礎研究を基に、その後の更新では、このリストにマクロオートファジーの障害、慢性炎症、そしてディスバイオシスを含めるよう拡張することが提案されている(López‐Otín et al., 2013, 2023)。これらの特徴については個別に広範な研究が行われてきたものの、それらの相互関係や老化への総合的な影響については、まだ十分に研究されていない。 |
| 本レビューは、細胞老化と腸内細菌叢の変化が、老化というより広い文脈の中でどのような役割を果たしているかを深く掘り下げることで、このギャップを埋めることを目指しています。老化におけるこれら2つの重要な側面が、互いに、そして宿主の免疫系とどのように相互作用するかを探り、加齢に伴う機能低下を軽減するための新たな治療標的となる可能性を探ります。老化抑制療法や老化形態学的療法の活用を含む最新の研究状況を検証し、腸内細菌叢の調節の重要性を強調することで、本レビューは、健康的な老化を促進し、加齢関連疾患に対処するための新たな戦略の包括的な概要を提供します。この探求を通して、老化の多面的な性質と、将来の研究および治療介入への有望な道筋を明らかにしたいと考えています。 |
| 2. 老化細胞の増加と老化プロセスへの影響 |
| 細胞老化は、細胞周期が永久的に停止した状態であり、1961年にLeonard HayflickとPaul Moorheadによって初めて試験管内で記述されました。それ以来、老化と疾患研究における重要な治療標的として浮上しています。DNA損傷、テロメア短縮、酸化ストレス、エピジェネティックな変化といった様々なストレスによって引き起こされる細胞老化は、p16INK4A-pRB(訳者注:p16INK4a-pRb(p16INK4a-網膜芽細胞腫タンパク質)は、細胞周期の制御と細胞老化(老化)において中心的な役割を果たす重要な分子経路で、p16INK4aがCDK4/6(サイクリン依存性キナーゼ4/6)を阻害し、その結果としてRbタンパク質(pRb)が活性化され、細胞が分裂を停止(細胞周期停止)するメカニズムです)やp53-p21WAF1/CIP1といった重要な経路を介して誘導されます(Hayflick, 1965; Rodier & Campisi, 2011)。これらの老化細胞は多様な形態学的および機能的変化を示し、組織や臓器の機能変化に寄与します(Hernandez‐Segura et al., 2018)。複製ストレスから発がん性ストレス、活性酸素種(ROS)、タンパク質毒性ストレスに至るまで、様々な刺激因子が、それぞれの細胞刺激の種類に特異的なトランスクリプトームおよびプロテオームパターンを誘導します(Hernandez‐Segura et al., 2017)。さらに、同一の老化細胞内においても、老化の段階によって細胞クラスターや発現mRNAにばらつきが見られます(Admasu et al., 2023; Wechter et al., 2023)。こうした「複雑性」と「不均一性」は、老化プロセスの定義と理解において課題となります。 |
| 老化細胞のもう一つの重要な特徴は、SASP(老化関連分泌表現型(Senescence-Associated Secretory Phenotype))とは、細胞が老化して細胞分裂を停止した後も、炎症性サイトカイン、成長因子、プロテアーゼなど様々な生理活性物質(SASP因子)を分泌し続ける現象のことです)(Coppé et al., 2010)の分泌であり、これには様々なサイトカイン、ケモカイン、成長因子、プロテアーゼ、細胞外小胞などが含まれます(Basisty et al., 2020; Estévez‐Souto et al., 2023; Jeon et al., 2019)。SASP因子は炎症誘発性環境を誘発し、遺伝子発現エラーや代謝異常を引き起こし、老化プロセスや加齢関連疾患の発症に影響を与える可能性があります(Coppé et al., 2011; Hernandez‐Segura et al., 2018; Rodier & Campisi, 2011; Yousefzadeh et al., 2020)。 SASPが隣接細胞に伝播すると、細胞老化が進行します。興味深いことに、老化した全身環境は周囲の組織に老化伝播を誘導し、老齢マウスの血液を移植された若い並体結合体において、生物の再生能力を低下させます(Jeon et al., 2022; Karin & Alon, 2021)。若いマウスの血液中に存在する抗老化特性の活性化、または高齢マウスの血漿の希釈は、若返り効果を促進し、特定の組織の機能低下を改善することが指摘されており、老化細胞由来の加齢に伴う全身因子(SASPなど)を調節して若返り療法を行うことの潜在的な利点が強調されています(Kim et al., 2022; Ma et al., 2022; Mehdipour et al., 2021; Mehdipour et al., 2020; Ximerakis et al., 2023; Zhang, Lee, et al., 2023)。 |
| 老化細胞の蓄積は「インフラメージング」(訳者注:Inflammaging(インフラマエイジング/炎症老化)とは、加齢に伴って体内で慢性的に起こる「低レベルの炎症状態」を指し、この慢性炎症が免疫系の変化や細胞の機能低下を引き起こし、老化を加速させ、がん・糖尿病・心血管疾患・認知症など様々な加齢関連疾患の共通基盤となる現象です)と呼ばれる慢性炎症状態を助長し、加齢に伴う生理機能の低下を悪化させ、骨粗鬆症、サルコペニア、変形性関節症などの疾患のリスクを高めます(Coppé et al., 2011; Funk et al., 2023; Gulen et al., 2023; Guo et al., 2022)。免疫システム(自然免疫および獲得免疫)の低下、すなわち免疫老化は、これらの影響をさらに悪化させ、感染への反応能力や恒常性維持能力を低下させます。この緩やかな劣化により、効果的な免疫応答を行う能力が損なわれ、老化した CD8+ T 細胞、メモリー B 細胞、老化関連マクロファージが特に影響を受けます (Liu et al., 2023; Ovadya et al., 2018; Yousefzadeh et al., 2021)。 |
| したがって、炎症老化の速度を低下させるためには、老化細胞の蓄積を防ぐために特定の老化細胞を正確に標的として除去する介入法を発見するための広範な研究が必要です(Moskalev et al., 2022)。p16INK4a遺伝子を発現する老化細胞を選択的に除去する研究は、げっ歯類モデルにおいて寿命を延ばし、老化関連症状を緩和する上で有望であることが示されており、老化プロセスを停止させるために老化細胞を標的とする薬剤への関心が高まっています(Baker et al., 2011; Chin et al., 2023)。これらの観察結果は、老化中に老化細胞が蓄積すると、老化および老化関連疾患の進行を促進する可能性があることを示唆しています。その結果、老化細胞を標的として老化の進行を緩和する「セノリティック」(訳者注:セノリティクスとは、老化細胞をターゲットとして除去する成分または薬剤のことです。老化細胞は周囲の細胞に悪影響を与える物質を分泌するため、その蓄積は加齢に伴う様々な不調や疾患の原因となります。セノリティクスは、老化細胞を選択的に死滅させることで、健康状態の改善や加齢に伴う病気の予防・治療への応用が期待されており、現在、基礎研究や臨床試験が進められています)と呼ばれる薬剤の開発に注目が集まっています。さまざまなセノリティック候補薬剤の臨床試験がすでに進行中です。しかしながら、これらの老化細胞除去薬は、主にp53(訳者注:p53(ピー・フィフティ・スリー)は、細胞のがん抑制遺伝子(TP53)から作られる重要なタンパク質で、「ゲノムの守護神」とも呼ばれ、DNA損傷やストレスを感知して細胞分裂を停止させたり、DNA修復を促したり、修復不能なら**アポトーシス(細胞死)**を誘導することで、がん化を防ぐ「番人」のような役割をします)を介した経路やBLC-2ファミリー関連経路など、活性化した老化細胞抗アポトーシス経路(SCAP)を標的としています。老化細胞の不均一な特性のため、蓄積した老化細胞集団全体を完全に除去することはできません(Chaib et al., 2022)。 |
| 老化細胞は、その悪影響にもかかわらず、SASPを介して免疫系を活性化することで、腫瘍抑制などの有益な役割も果たしています(Campisi & d'Adda di Fagagna, 2007; Feldser & Greider, 2007)。さらに、老化細胞は組織修復、感染防御、組織恒常性の維持にも関与していることが示唆されています(Demaria et al., 2014; Kita et al., 2022)。ノックインマウスにおいてp16INK4a発現細胞を除去すると健康に悪影響を与える可能性があることも報告されています(Grosse et al., 2020)。この二重性は、老化細胞を無差別に除去すると悪影響が生じる可能性があることを示唆しており、老化の有益な機能を維持しながら、その有害な側面を標的とする戦略が推奨されています(Amor et al., 2024; Chin et al., 2023; Smer‐Barreto et al., 2023)。SASPを選択的に阻害するか、細胞老化の誘因を阻害する老化治療薬の開発は、健康寿命を延ばし、副作用を最小限に抑えるための、よりきめ細やかなアプローチとなる可能性があります(Gasek et al., 2021; Zhang, Pitcher, et al., 2023)(図1)。 |
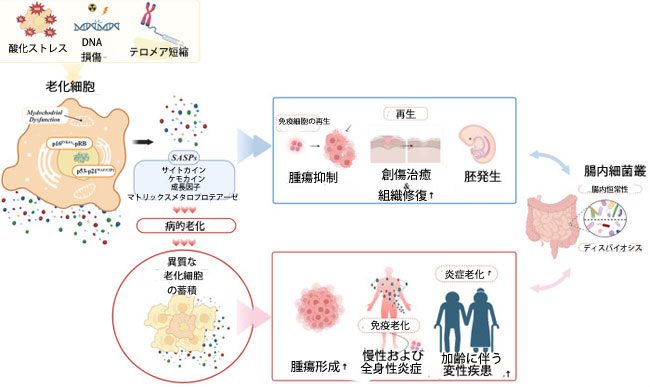 |
図1. 老化細胞の多面的な特徴と腸内細菌叢への影響に関する概要。 細胞老化は、DNA損傷、テロメア短縮、酸化ストレスなど、様々な刺激によって引き起こされます。これらの刺激は、p16INK4A-pRBやp53-p21WAF1/CIP1といった重要な経路を介して正常な細胞機能を阻害し、細胞周期停止を引き起こします。老化細胞は腫瘍抑制、創傷治癒、胚発生において重要な役割を果たす一方で、宿主の加齢に伴い逆説的に有害な影響を及ぼします。免疫老化は老化細胞の除去を阻害し、傍分泌老化を介して近隣細胞への増殖を引き起こします。細胞老化におけるストレス誘導因子と特異的な転写応答の複雑な相互作用は、様々な炎症誘発性SASPの放出につながり、慢性炎症状態の一因となり、炎症老化の進行を加速させます。また、腸内細菌叢と老化細胞との双方向の相互作用が腸内ディスバイオシスを引き起こす可能性があること、そして逆に腸内ディスバイオシスが腸内常在細胞の細胞老化に直接影響を与える可能性があることを示唆する証拠が蓄積されています。この相互作用は、老化関連疾患の発症に重要な意味を持ちます。しかしながら、腸内における老化細胞の有益な役割についてはほとんど分かっていません。したがって、老化過程における細胞老化と腸内腸内細菌叢の相互作用を完全に理解するには、さらなる研究が必要です。(biorender.com で作成) |
| これらの理由から、SenNet(Suryadevara et al., 2024)のような大規模な将来的な取り組みが求められています。バイオインフォマティクスツールを単一細胞トランスクリプトミクス、エピゲノミクス、プロテオミクスと組み合わせることで、老化細胞集団の不均一性とそれらが老化に及ぼす二重の影響を解明する必要があります。有益な老化細胞と有害な老化細胞を区別するためのマーカーを特定することは、正確で個別化された老化介入を開発するために不可欠です。異なる老化細胞タイプの固有の特性と影響に焦点を当てたこのような標的アプローチは、害を最小限に抑えながら利益を最大化することを目的とした老化治療戦略の開発を可能にします。これは、より健康的な老化と加齢関連疾患の予防に貢献する上で重要な役割を果たすでしょう。 |
| 3. 加齢に伴う腸内細菌叢の変化 |
| 「マイクロバイオーム」という用語は、「マイクロバイオータ(微生物叢)」と「ゲノム(ゲノム)」を組み合わせたもので、特定の環境における微生物の遺伝物質の集合体を指します(Hou et al., 2022)(訳者注:マイクロバイオームは腸内細菌叢が持つ遺伝子の総体を指していますが、訳者はマイクロバイオームをマイクロバイオータ(腸内細菌叢)と区別せず腸内細菌叢と訳しています)。ヒトの腸内では、ヒトの細胞数を上回る2000種以上からなる1014種以上の微生物からなる複雑な生態系が、ヒトの健康維持に重要な役割を果たしています(Thursby & Juge, 2017)。この腸内細菌叢は、消化、栄養吸収、免疫機能、そして病態生理学的プロセスにおいて極めて重要な役割を果たしています(Nagpal et al., 2018; Sbierski‐Kind et al., 2022; Shin et al., 2021; Sun et al., 2023)。しかし、加齢は微生物の多様性と構成に影響を与え、腸内細菌叢のディスバイオシスにつながる(Clark et al., 2015; Jiao et al., 2021; Langille et al., 2014; You et al., 2022)。高齢マウスでは、このディスバイオシスと腸管透過性の増加が相まって、微生物産物の循環への移行を促進し、全身性炎症(老化細胞によって引き起こされる低度で持続的な炎症に関連する状態(例:血中の腫瘍壊死因子(TNF)およびIL-6レベルの上昇))を引き起こした(Thevaranjan et al., 2017)。この関係は、腸内細菌叢が老化に果たす役割を強調するものであり、健康的な老化を促進する可能性についてさらなる研究を促すものである。 |
| ヒトは加齢に伴い、酪酸などの短鎖脂肪酸(SCFA)を産生する微生物叢が減少します。抗炎症作用を持つ酪酸は、食物繊維や難消化性デンプンの細菌発酵によって生成されます(Bach Knudsen et al., 2018; Canfora et al., 2015; Fernández et al., 2016; Wenzel et al., 2020)。特に、加齢は、フェカリバクテリウム・プラウスニッツィ、ユーバクテリウム・レクタレ、クロストリジウム・セプタム、ローズブリア属などのフィルミクテス門に属する酪酸産生細菌の減少と関連しています(Biagi et al., 2016)。この減少は腸管の健全性と免疫機能を損ない、二次胆汁酸とビタミンの減少によってさらに悪化します(Walrath et al., 2021)。同時に、プロテオバクテリア、特に腸内細菌科の増加は腸内リポ多糖(LPS)レベルを上昇させ、腸管細胞の細胞毒性と免疫反応を引き起こします(Mukhopadhya et al., 2012; Shin et al., 2015)。十二指腸細菌叢の加齢変化は、疾患状態、薬剤使用、生活習慣要因の影響を受け、プロテオバクテリアの増加とバクテロイデスの減少につながり、微生物の多様性に影響を与えます(Ghosh et al., 2022; Jackson et al., 2018)。大腸菌、腸球菌、乳酸菌などの特定の属は加齢とともに増加しますが、クレブシエラ属、ビロフィラ属、クロストリジウム属は薬剤の服用や併存疾患によって増加します(Leite et al., 2021)。この腸内細菌叢の乱れと腸管透過性の増加は、微生物成分の血流への移行を促進し、全身性慢性炎症を引き起こし、加齢関連疾患の一因となります(DeJong et al., 2020; Fransen et al., 2017; Jackson et al., 2018)。 |
| 腸内細菌に関する研究は広範に行われてきましたが、腸内真菌(マイコバイオーム)、ウイルス(ビローム)、原生動物が加齢とともにどのように変化し、加齢関連疾患に寄与するかについてはあまり分かっていません。この知識ギャップは、腸内細菌叢における真菌の割合が低いこと(1%未満)と、ウイルスゲノムデータベースの限界に起因しています(Al Bataineh et al., 2020; Johansen et al., 2023; Wilmanski & Gibbons, 2023)。最近の研究では、これらのギャップに対処し始めています。例えば、中国で行われた研究では、24~108歳(47名が100歳以上)の251名が参加し、腸内細菌叢に加齢に伴う変化が見られました(Pu et al., 2024)。長寿者は、ペニシリウムやアスペルギルスなどの独特な真菌分類群を持ち、バクテロイデスと正の相関関係にあるカンジダのエンテロタイプが豊富であったことから、加齢に伴う真菌と細菌の相互作用があることが示唆された。同様に、195人の百歳以上高齢者を含む389人の日本人参加者を対象とした研究では、ビロームの加齢に伴う変化が明らかになり、百歳以上高齢者は細菌と相互作用する独特なウイルス群集を呈していた(Johansen et al., 2023)。百歳以上高齢者は、クラスウイルス科やミクロウイルス科、C. scindensに関連するウイルスの有病率が高く、バクテロイデス属やフェカリバクテリウム属のウイルスの有病率が低下していた。さらに、百歳以上高齢者の腸内微生物叢は硫黄代謝活性が高く、硫酸塩還元酵素をコードするウイルスに関連しており、粘膜の完全性と病原体抵抗性を高めていた(Johansen et al., 2023)。これらの変化が老化、加齢関連疾患、腸内細菌叢およびウイルス叢とどのように関連しているかを理解するには、さらなる研究が必要です (Balderramo et al., 2023; Cao et al., 2022; Iliev & Leonardi, 2017)。 |
| 重要な知見が得られているにもかかわらず、加齢と腸内細菌叢の変化との複雑な関係は、技術的な制約により未だ十分に解明されていません。シーケンシング、メタゲノム技術、そして解析ツールの進歩は、個人差に対処し、正確な解析を実現するために不可欠です。こうした進歩により、加齢が腸内細菌叢に及ぼす悪影響を軽減し、健康的な老化を促進するための標的介入の開発が可能になるでしょう(Bharti & Grimm, 2021; Ojala et al., 2023)。 |
| 4. 筋骨格系疾患と腸内細菌叢のディスバイオシスの相関関係 |
| 腸内細菌叢のディスバイオシスと加齢に伴う慢性疾患の関係に関する研究は急速に発展しており、世界中の高齢者に大きな影響を与える筋骨格系疾患との重要な関連性が明らかになっています。本研究では、骨粗鬆症、サルコペニア、変形性膝関節症といった筋骨格系疾患が、腸内細菌叢の構成と健康状態にどのように影響される可能性があるかを詳細に検討し、これらの疾患を軽減するための標的腸内細菌叢介入の可能性を強調しています。現在の研究では、これらの関連性は予備的なレベルで確立されていますが、関連する分子メカニズムをさらに解明し、効果的な治療戦略を開発するためには、今後の研究が必要です。 |
| 世界中で2億人以上の高齢者が罹患している骨粗鬆症は、骨組織の劣化と骨量の低下を特徴とし、骨が脆くなり骨折しやすくなります。骨の健康に関する腸内細菌叢研究は急成長を遂げており、代謝経路、免疫系、ホルモンバランスが骨代謝にどのように影響するかを理解することで大きく発展し、腸内細菌叢の潜在的な役割を示唆しています。研究では、腸内細菌叢の変動と骨粗鬆症のリスクとの関連が示されており、骨粗鬆症の人は正常な骨密度の人と比較して、放線菌、エッガーテラ、クロストリジウム・クラスターXVa、ラクトバチルスなどの特定の属のレベルが高いことが明らかになっています(Das et al., 2019)。逆に、骨粗鬆症の人は、骨減少症の人と比較して、大腸菌/赤痢菌およびベイヨネラ属の菌数が少ないこともわかっています(Das et al., 2019)。さらに、骨粗鬆症患者では、正常な骨密度の患者と比較して、ディアリスターとフェカリバクテリウムの多様性と存在量の増加が観察されています(Xu et al., 2020)。KEGGパスウェイ解析により、骨粗鬆症患者では、骨代謝と細胞生存に不可欠な膜輸送および炭水化物代謝モジュールのダウンレギュレーションが明らかになりました。ディアリスターレベルの上昇は、骨量減少を誘発するIL-6レベルの上昇とも関連しています。中国の研究では、特定の細菌(ビフィドバクテリウム、ローズブリア、ラクトバチルス、アリソンエラ、クレブシエラ、メガスファエラ)の豊富さと骨密度(BMD)レベルとの関連も強調されています(He et al., 2020; Li et al., 2019)。臨床試験では、プロバイオティクスの補給は閉経後女性の骨量減少の減少に有望であることが示されており、スウェーデンで脛骨の骨密度に焦点を当てた試験と腰椎(LS)の骨密度に焦点を当てた試験が行われました(Jansson et al., 2019)。さらに、日本の試験では、枯草菌C-3102が股関節全体の骨密度を改善しましたが、腰椎-骨密度には有意な効果がないことがわかりました(Takimoto et al., 2018)。イランの研究では、複数種のプロバイオティクスカプセルを6か月間毎日摂取すると、TNF-αレベル、骨代謝関連マーカー(コラーゲンタイプ1架橋C-テロペプチド(CTX)および骨特異的アルカリホスファターゼ(BALP))、副甲状腺ホルモン(PTH)レベルが低下したことがわかりました。これは、プロバイオティクスが骨代謝と骨吸収を抑制し、骨の健康を改善する可能性があることを示唆しています(Jafarnejad et al., 2017)。ただし、これらのメカニズムを確認するにはさらなる研究が必要です。 |
| サルコペニアは、加齢による筋肉量と機能(筋力とパフォーマンス)の低下として現れ、高齢者の身体活動を妨げる主要な疾患として認識されています(Dennison et al., 2017)。腸-骨軸ほど研究されていませんが、腸-筋軸理論は最近、骨格筋の代謝と機能における腸内細菌叢の恒常性維持の重要性を強調しています(Liu et al., 2021)。マウスの研究では、無菌(GF)マウスと抗生物質投与マウスで骨格筋量と機能が低下することが実証されています。従来の方法で飼育されたマウスの腸内細菌叢を無菌マウスに再導入すると、骨格筋量が増加し、筋萎縮マーカーが減少しました。短鎖脂肪酸による治療は、無菌マウスの骨格筋障害を部分的に回復させました。ヒトにおいては、特定の微生物属が高齢者の除脂肪体重の増加や身体能力の向上と関連していることが報告されている(Cawthon et al., 2021; Song & Lee, 2020; Verschueren et al., 2013)。例えば、抗炎症作用と酪酸産生で知られるフシカテニバクター、ラクノスピラ、ロゼブリア、ユーバクテリウム、ラクノクロストリジウムなどの細菌は減少している一方で、ラクトバチルスはサルコペニア前期およびサルコペニア期の人の糞便サンプル中でより豊富に存在している(Kang et al., 2021)。ノルウェーのコホート(n = 5196、男女を含む)を対象とした大規模集団ベースの研究では、サルコペニアの診断因子である四肢除脂肪量(ALM)および骨密度の増加が、3つの同化細菌種であるドレア・ロンギカテナ、コプロコッカス・カムス、およびユーバクテリウム・ベントリオスムと相関していることが明らかになりました(Grahnemo et al.、2023)。前臨床研究では、腸内細菌叢由来の胆汁酸(BA)関連経路が筋肉の成長と有意に関連していることが明らかになりました(Qiu et al.、2021、2022)。肝臓で産生された一次胆汁酸は回腸に移動し、そこで胆汁酸塩加水分解酵素(BSH)によって脱抱合され、二次胆汁酸に変換されます。これらの胆汁酸はファルネソイドX受容体(FXR)のリガンドとして作用し、線維芽細胞増殖因子15/19(FGF15/19)の分泌を促進します。線維芽細胞増殖因子15/19はERK1/2シグナル伝達経路を活性化し、筋肉量を増加させます(Benoit et al., 2017)。高齢マウスでは、フィルミクテス属細菌の相対的存在量が増加し、プロテオバクテリア属細菌とバクテロイデス属細菌が減少しました。ラコノスピラ科、ルミノコッカス科、ラクトバチルス科、ビフィドバクテリウ科などの胆汁酸塩加水分解酵素活性の高い菌株が減少し、ファルネソイドX受容体拮抗薬であるタウロ‐β‐ムリコール酸(TβMCA)などの共役胆汁酸が増加しました。これによりファルネソイドX受容体-線維芽細胞増殖因子15/19シグナル伝達がダウンレギュレーションされ、筋肉量の減少に寄与します(Benoit et al., 2017; Guo et al., 2021; Mancin et al., 2023; Qiu et al., 2021, 2022)。現在アイルランドでは、植物性食品由来の食事に対するプロバイオティクス(バチルス・コアグランス)補給が筋肉タンパク質合成に及ぼす影響を評価する臨床試験が進行中です(Dublin & Group, 2019)。良好な結果が得られれば、高齢者の加齢に伴う筋肉量減少や身体機能の低下を軽減するための戦略につながる可能性があります。 |
| 変形性関節症(OA)は、最も一般的な変形性関節症であり、主に軟骨マトリックスの進行性の喪失を特徴としますが、軟骨下骨硬化症、骨棘形成、滑膜炎など、他の関節構成要素の病理学的変化も伴います(Favazzo et al., 2020)。変形性関節症の主な危険因子には、加齢、肥満などの全身因子と、過剰体重による機械的ストレスや関節不安定性などの局所因子があります。これらの因子は、腸内細菌叢と相互に関連している局所的および全身的な炎症の増加に寄与します(Berenbaum et al., 2017; Jeon et al., 2017, 2018)。最近の小規模研究では、血清と滑液に細菌性リポ多糖が高濃度で含まれ、膝関節包と滑膜で活性化マクロファージを伴う場合、変形性関節症病態が悪化することが実証されました(Huang et al., 2016)。さらに、オランダで行われた大規模コホート研究において、レンサ球菌属の豊富さが、非肥満の変形性関節症患者における膝関節の炎症および疼痛の増加と関連付けられました(Boer et al., 2019)。腸内細菌叢の代謝と肥満の相関関係(Huang & Kraus, 2016; Liu et al., 2019; Schott et al., 2018; Winer et al., 2016)を考慮すると、腸内細菌叢の乱れに起因する代謝物(例:リポ多糖)は、肥満においてマクロファージおよびToll様受容体(TLR)経路を活性化することで全身性炎症を引き起こし、変形性関節症関連の膝痛を悪化させると考えられます(Huang et al., 2016; Ohto et al., 2012)。ヒト臨床試験では、ラクトバチルス・カゼイ・シロタ菌とストレプトコッカス・サーモフィルスが膝変形性関節症の管理に有益な効果があることがすでに示されています(Lei et al.、2017; Lyu et al.、2020)。 |
| 5. 新たなつながり:加齢に伴う細胞老化と腸内細菌叢の変化 |
| 加齢に伴う腸内細菌叢の変化、特に細胞老化と全身性炎症との関連における理解の進展は、老化と健康に深い影響を与えます。この関係性は、腸内細菌叢の乱れが老化を悪化させる可能性があり、逆に老化細胞が腸内細菌叢の構成と機能に影響を与えるという双方向の相互作用を示唆しています。この相互作用は、筋骨格系疾患を含む加齢関連疾患の発症に重要な意味を持ち、治療介入の潜在的な標的となります。腸内における上皮細胞や免疫細胞などの多様な老化細胞や、加齢に伴うSASPの蓄積は、腸内環境における微生物多様性と腸内細菌叢由来の代謝物の変化を引き起こす可能性があります。逆に、腸内細菌叢によって産生される代謝物は、腸内細胞の細胞老化に直接影響を与える可能性があります。 |
| 腸管上皮は、微生物叢が存在する内腔領域の近傍に位置し、腸管幹細胞(ISC)、杯細胞、パネート細胞など、様々なタイプの腸管上皮細胞(IEC)から構成されています(Hohman & Osborne, 2022)。これらの細胞は、宿主組織を内腔環境から保護する保護バリアとしての機能と、腸管内の炎症バランスの調整因子としての機能の2つの役割を果たしています。腸管陰窩に存在する腸管幹細胞は、通常、標準的なWNT(訳者注:動物の発生、形態形成、幹細胞の維持、そしてがん化など、生命の様々なプロセスに深く関わる分泌性タンパク質とその情報伝達経路の総称です)シグナル伝達を介して自己複製し、損傷した上皮細胞の置換を促進し、腸管バリアの完全性を維持します(Tian et al., 2015)。しかし、老化した腸管幹細胞の蓄積とSASPの持続的な分泌により、炎症性環境が形成され、腸管機能と恒常性が損なわれます(Funk et al., 2023)。例えば、マウスへの鉄放射線曝露は、腸管幹細胞における活性酸素種の増加とDNA損傷の進行、ならびに早期老化およびSASPマーカーの蓄積をもたらしました(Kumar et al., 2019)。さらに、老化は腸管幹細胞の増殖、自己複製、運動性の低下に寄与し、局所的な炎症を悪化させ、腸管機能維持における課題を悪化させます(Choi et al., 2018)。これらの知見は、細胞老化が腸管上皮において重要であり、腸管透過性と免疫応答に影響を与え、最終的には消化管機能全体に影響を及ぼすことを示唆しています。 杯細胞は粘液層を産生し、パネート細胞はαディフェンシンやリゾチームなどの抗菌ペプチドを分泌して細菌の侵入を防御します。研究によると、両細胞の老化は腸管バリア機能を損なうことが示唆されており、高齢マウスのパネート細胞では、杯細胞におけるムチン産生の減少、リゾチーム分泌の減少、そしてWNT阻害因子であるNotumの活性化が見られます(Elderman et al., 2017; Pentinmikko et al., 2019; Sovran et al., 2019)。両細胞の老化によって引き起こされる腸管バリアの完全性の破壊は、細菌の透過性と慢性炎症を促進します(Branca et al., 2019)。その結果、全身性炎症を悪化させ、腸管全体の健康を損なう可能性があります。 |
| 上皮層の下部にある粘膜固有層には、様々な免疫細胞(樹状細胞、マクロファージ、B/Tリンパ球など)が含まれており、免疫応答を誘発することで腸管上皮バリアを通過してきた病原体成分から宿主を保護します(MacDonald, 2003; Montalban‐Arques et al., 2018)。最近の研究では、腸管回腸胚中心(GC)B細胞は、加齢に伴い細菌依存的に細胞老化を起こすことが示されています。これは、加齢に伴う腸管バリア機能不全とグラム陰性細菌の増加が相まって、回腸組織における微生物叢の透過性を高め、免疫細胞への長期的な刺激につながることを示しています。さらに、パイエル板(PP)および孤立リンパ濾胞(ILF)内の胚中心B細胞の老化は、IgA産生を減少させ、多様性を低下させる。その結果、腸内細菌に対するIgAの結合親和性が変化し、結果として腸内細菌叢の構成に影響を与える。重要な点として、p16/p21ダブルノックアウト(DKO)マウスでは、加齢によるB細胞増殖の抑制が緩和され、IgA陽性形質細胞およびIgAクローン型多様性の減少が緩和されると考えられる(Kawamoto et al., 2023; Kawamoto & Hara, 2024)。しかし、腸内常在細胞および腸内細菌叢の文脈において、他の常在細胞の老化が腸内細菌叢構成の変化に直接影響を与える具体的なメカニズムは依然として不明である。これらの細胞の老化は腸内細菌叢の構成を直接変化させることはないかもしれませんが、腸管バリアの機能を低下させます。この障害は腸管透過性の増加につながり、腸内細菌叢の乱れ、腸内恒常性の悪化、そして炎症性疾患の発症に寄与する可能性があります。これらの知見は、健康的な老化を促進し、腸内マイクロバイオームの恒常性を維持するために、腸管透過性細胞(IEC)と免疫細胞、特にB細胞の老化状態を制御することの重要性を強調しています。腸内常在細胞の細胞老化、老化による腸管透過性の増加、そしてそれに伴う腸内細菌叢の変化との関係を解明するには、さらなる研究が必要です。 |
| 老化細胞が腫瘍抑制(Rodier & Campisi, 2011)、胚発生(Storer et al., 2013)、創傷治癒(Demaria et al., 2014)、組織修復(Chikenji et al., 2019)、再生(Paramos‐de‐Carvalho et al., 2021)など、様々な場面で有益な役割を果たすことはよく知られていますが、腸内におけるその有益な役割についてはほとんど分かっていません。これは、加齢に伴う腸内細菌叢における細胞老化の潜在的なプラス効果を完全に理解するために、さらなる研究が必要な分野です。 |
| 腸内細菌叢は、食事性栄養素を代謝し、発酵プロセスを通じて短鎖脂肪酸、アミノ酸、ホルモンなどの様々な生理活性代謝物を産生する上で極めて重要な役割を果たしています(Bernalier‐Donadille, 2010; Fernández et al., 2016; Oliphant & Allen‐Vercoe, 2019)。多くの研究において、腸内細菌叢由来の短鎖脂肪酸が腸内環境に及ぼす影響が強調されています。これらの影響には、腸管バリアの完全性強化、粘液産生の増加、常在微生物の調節、そして特に制御性T細胞(Treg)の恒常性維持による免疫寛容の促進が含まれます(Chang et al., 2014; Corrêa‐Oliveira et al., 2016; Furusawa et al., 2013; Smith et al., 2013)。一方、最近の研究では、ポルフィロモナス属から放出される短鎖脂肪酸である酪酸が、腫瘍環境における細胞老化を誘導することで大腸がんの発症を促進することが実証されています(奥村ら、2021年)。 |
| 腸内細菌叢を介した発酵によって一次胆汁酸から変換される二次胆汁酸も、主に抗菌活性により、腸の恒常性およびバリア機能の維持に関連しています(Jin et al., 2024; Larabi et al., 2023)。マウスの研究では、二次胆汁酸の一種であるisoalloLCAや3-oxoLCAなど、リトコール酸(LCA)のいくつかのアイソフォームが、腸管粘膜固有層内のTh17細胞と制御性T細胞の分化のバランスを調節し、抗炎症作用を通じて宿主の免疫応答を制御しています(Hang et al., 2019)。これに沿って、100歳以上で加齢に伴う疾患に対する脆弱性が低い日本人の百寿者からの糞便サンプルの分析では、isoalloリトコール酸を産生するオドリバクテリア科株の増加が示されました。これは、エンテロコッカス・フェシウムやクロストリジウム・ディフィシルなどのグラム陽性細菌に対して抗菌活性を発揮することで、腸管の恒常性を維持します(Sato et al., 2021)。しかし、肥満マウスの研究では、二次胆汁酸の一種であるデオキシコール酸(DCA)が肝臓に循環し、そこでDNA損傷により肝星細胞(HSC)の細胞老化を引き起こすことが明らかになっています。次に、それはSASPの分泌を刺激し、それが炎症を引き起こし、肝細胞癌(HCC)の発症を促進します(Loo et al., 2017; Yamagishi et al., 2022; Yoshimoto et al., 2013)。微生物由来の代謝物の種類に応じて、組織微小環境において細胞老化に対する多様な影響が現れる可能性があります。また、これらの微生物産物の全身循環は、遠位臓器系と相互作用し、持続的な低レベルの全身性炎症を調節することにより、人間の健康に大きな影響を与える可能性があります(Agus et al.、2021; Glowacki&Martens、2020)。 |
| 若齢マウスと老齢マウスの異時性パラビオシス(並体結合)後、老齢マウスでは全身性炎症の有意な減少が観察されており、腸管細胞における老化関連表現型の緩和が腸管機能とバリア機能の完全性を高める可能性を示唆しています。この改善は、微生物叢の乱れや全身性炎症に関連する問題の解決につながることが期待されます(Shin et al., 2021, 2022)。したがって、これらの抗老化効果に関与する特定の代謝物とその作用機序を解明するためのさらなる研究が必要です。 |
| 6. 健康的な老化のための腸内細菌叢の調節 |
| 腸内細菌叢と細胞老化の複雑な関係を調節することは、健康的な老化にとって極めて重要な腸内細菌叢の均衡を維持する上で大きな可能性を秘めています。腸内細菌叢の調節戦略には、プロバイオティクス、プレバイオティクス、シンバイオティクス、ポストバイオティクスといったバイオティクス(Kim & Mills, 2024)に加え、糞便微生物叢移植(FMT)、そしてカロリー制限などの特定の食事療法(Ghosh et al., 2022; Nagpal et al., 2018; Vaiserman et al., 2017; Zhang et al., 2013)が含まれます。 |
| プロバイオティクスは生きた微生物であり、宿主に投与されると、ポリアミン、短鎖脂肪酸、ビタミンを産生し、病原体に対する抗菌活性を促進することで腸の健康を改善します。ビフィドバクテリウムやラクトバチルスなどのよく知られたプロバイオティクスは、加齢に伴う炎症を軽減します(Boyajian et al., 2024)。例えば、ビフィドバクテリウム・アニマリス亜種ラクティスLKM512は、腸管バリア機能を強化し、TNF-α、NF-κB、IL-6などの炎症マーカーを減少させることで、炎症老化を抑制し、寿命の延長に貢献します(Matsumoto et al., 2011)。 |
| プレバイオティクスは、プロバイオティクスと同様に、善玉菌の増殖を促進する基質です。炭水化物やポリフェノールなどの一般的なプレバイオティクスは、短鎖脂肪酸などの抗炎症性代謝物の産生を促進し、上皮防御機構を強化して全身性炎症を軽減します(Diwan & Sharma, 2022; Martel et al., 2024; Roy & Dhaneshwar, 2023)。例えば、緑茶カテキンであるエピガロカテキンガレート(EGCG)は、マウスの老化細胞から分泌されるDNA損傷マーカー(例:p53、p21)と炎症性サイトカインを減少させ、全身性炎症を緩和し、腸内細菌叢を改善します(Sharma et al., 2022)。 |
| シンバイオティクスは、プロバイオティクスとプレバイオティクスを組み合わせることで、腸内環境への相乗効果をもたらします。例えば、シンバイオティクス混合物FCT(発酵乳中のラクトバチルス・ガセリ505株とクドラニア・トリクスピダ葉エキス)は、大腸がんのマウスモデルにおいて、炎症性サイトカイン(TNF-α、IFN-γ、IL-1β、IL-6など)を減少させ、抗炎症性サイトカイン(IL-4、IL-10など)を増加させ、抗炎症作用と抗酸化作用を示しました(Oh et al., 2020)。しかし、プロバイオティクスとプレバイオティクスの臨床応用は、細胞生存率を維持する必要性と既存製品の健康効果が限定的であることから制限されています(Roy & Dhaneshwar, 2023)。 |
| ポストバイオティクスには、加熱殺菌した微生物やプロバイオティクスの代謝物など、不活性な微生物またはその成分が含まれています(Kim & Mills, 2024)。これらの介入は、炎症や酸化ストレスを標的とすることで炎症老化を抑制し(Diwan & Sharma, 2022)、細胞老化を抑制することで健康的な老化を促進します(Chaib et al., 2022; Zhang et al., 2017; Zhu et al., 2021)。ラクトバチルス・アシドフィルス、ラクトバチルス・カゼイ、ラクトコッカス・ラクティス、ラクトバチルス・ロイテリ、サッカロミセス・ボウラディなどのプロバイオティクスの代謝物には、ヒト結腸上皮細胞において抗炎症作用と抗酸化作用があることが研究で実証されています(De Marco et al., 2018)。特に、ラクトバチルス・ファーメンタムが分泌する代謝物は、老化関連表現型の緩和、p53-p21WAF1やp16INK4aなどの細胞周期阻害因子のダウンレギュレーション、NF-κB転写を介したSASP因子の発現阻害、3T3-L1前駆脂肪細胞における過酸化水素誘導性老化モデルにおけるPI3K/Akt/mTOR経路およびAMPKシグナル伝達の調節に有望であることが示されています(R. Kumar et al., 2020)。加熱不活化ビフィドバクテリウム・アドレセンティスは、加齢マウスにおいて腸管の完全性を強化し、WNTシグナル伝達経路を介してLgr5+ ISCの再生を刺激することで、結腸老化に関連する変化に対抗することが示されている(Qi et al., 2023)。これらの研究は、おそらく老化と炎症に関与するシグナル伝達経路を調節することにより、細胞老化と加齢に伴う病理と闘うさまざまな生物の治療上の可能性を浮き彫りにしています。 |
| 糞便微生物叢移植(FMT)は、健康なドナーの糞便または糞便由来の微生物叢をレシピエントに移植する処置であり、微生物叢の異常とそれに伴う疾患の解決を目的としています。実験では、若いマウスから高齢マウスに微生物叢を移植することで、若いレシピエントの腸管脳軸および腸管網膜軸における加齢に伴う変化を回復できることが示されています。逆に、若いマウスの微生物叢は、高齢マウスの炎症関連サイトカイン(例:TNF-α、IL-6)の発現を減少させることが示されており、微生物調節が加齢に伴う炎症や疾患に対する効果的な戦略となり得ることを示しています(Cheng & Fischer, 2017; Parker et al., 2022)。 |
| さらに、抗老化剤、特にセノリティック薬は、微生物のディスバイオシスによって引き起こされる炎症老化を防ぐ有望な戦略として浮上しています。セノリティック薬であるダサチニブ(D)とケルセチン(Q)の併用をマウスに投与したところ、腸管における老化細胞量とSASP因子(例:TNF-α、IL-6、CXCL1)の発現が有意に減少しました(Saccon et al., 2021)。これは、蓄積した老化細胞を除去することで微生物バランスと炎症環境を回復させ、健康を改善する可能性があることを示唆しています。さらに、老化細胞を標的とする天然フラボノイド化合物フィセチンは、炎症を効果的に軽減し、有益な腸内細菌を回復させることから、炎症性腸疾患(IBD)の臨床治療薬としての可能性を秘めています(Ashiqueali et al., 2024)。同様に、ブレオマイシン誘発性肺線維症のラットモデルにおいて、ケルセチンが腸内細菌叢の乱れを修正する能力、特にアッカーマンシアの豊富さを増強する能力は、細菌叢の乱れを修正し、関連疾患を軽減する上での老化抑制薬の相互に関連した役割を強調しています (Wu et al.、2023)。 |
| これらの介入戦略(図 2)は、健康効果または抗老化効果を達成するための二重のアプローチを強調しています。(1) 腸内細菌叢のディスバイオシスを回復して細胞老化を調節し健康を改善すること、および (2) 細胞老化を制御して腸内細菌叢のディスバイオシスを回復し、抗老化効果を達成することです。後者は、細胞老化を調節して健康を回復することにより、ヒトと腸内細菌叢の共生関係を強化するという新しい治療戦略を導入します。これまで議論してきたように、腸内細菌叢のディスバイオシスと細胞老化は双方向に相互作用し、加齢に伴う腸の健康状態の悪化に寄与しています。状況に応じて、腸の恒常性を維持するために、両方の要因を適切に標的とし、調節する必要があります。しかし、これら 2 つの要因の相互作用に関する理解はまだ初期段階にあります。したがって、細胞老化と腸内細菌叢がどのように相互作用して、加齢中に有害な結果を引き起こすのかを研究することが重要です。この研究は、抗老化および健康的老化介入のための新しい治療標的を特定するのに役立ちます。 |
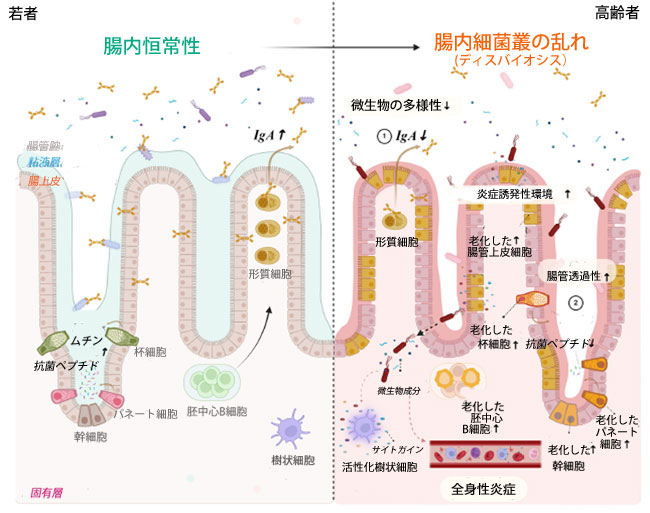 |
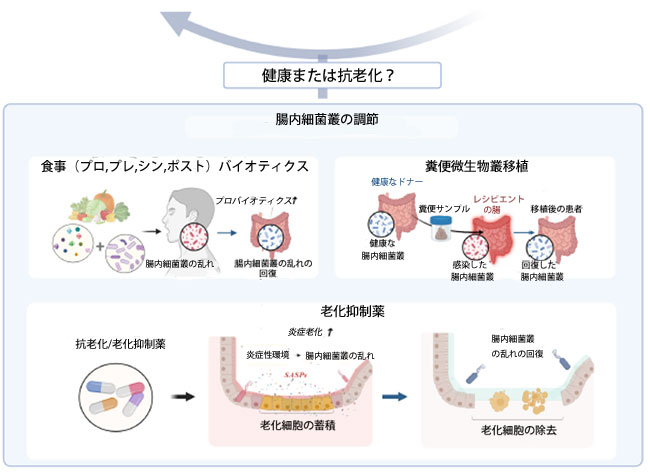 |
図2. 高齢者の腸内細菌叢の変化と、健康維持または抗老化のための腸内細菌叢調節戦略。 加齢に伴い、腸管透過性亢進と炎症性環境を特徴とする複雑な様相を呈する。加齢に伴い、杯細胞やパネート細胞などの様々な腸管上皮細胞(IEC)および腸管幹細胞(ISC)は細胞老化を起こす。このプロセスは、損傷した上皮細胞の再生を阻害し、ムチンおよび抗菌ペプチド(AMP)の産生を減少させ、腸管バリアを弱める。その結果、腸管透過性亢進により微生物叢の浸潤が可能となり、胚中心(GC)B細胞の細胞老化が誘導される。その結果、IgA産生が減少し、腸内細菌叢の構成が変化する。免疫細胞と腸管細胞における老化の相乗効果は、腸内細菌叢のディスバイオシスと全身性炎症を促進し、加齢性疾患の発症に寄与します。そのため、加齢に伴うディスバイオシスを改善するための取り組みは、腸内細菌叢に基づく介入による宿主の健康回復と、老化細胞療法(セノリティックスまたはセノモルフィック)に焦点を当てており、現在も積極的に進められています。(biorender.com で作成) |
| 7. 結論と今後の展望 |
| 加齢、細胞老化、そして腸内細菌叢の変化との複雑な関係は、全身性炎症や加齢に伴う生理機能低下の重要な要因として、ますます認識されつつある (Diwan & Sharma, 2022; Kawamoto & Hara, 2024; Sharma, 2022)。この認識は、加齢に伴う疾患に対する新たな治療のフロンティアを切り開くものであるが、依然として多くの障壁や限界があり、対処・検討する必要がある (Chaib et al., 2022; Schafer et al., 2017; Soto‐Gamez & Demaria, 2017)。第一に、腸内細菌叢と細胞老化の相互作用を理解することが重要である (Okumura et al., 2021)。今後の研究は、腸内細菌叢が細胞老化に、そして細胞老化が腸内細菌叢に影響を及ぼすメカニズムの解明に焦点を当てるべきである。これには、腸内細菌叢の構成を調整する SASP 因子の役割と、細菌代謝物が細胞の老化にどのように影響するかを調べることが含まれます。 |
| 第二に、老化細胞を死滅させるか、あるいはその有害な影響を選択的に抑制することを目的とする老化治療薬の開発においては、腸内細菌叢がその有効性と潜在的な副作用に及ぼす影響を考慮する必要があります。これらの治療法が腸内細菌叢に及ぼす影響を理解することは、健康的な老化を促進するための治療戦略の最適化につながる可能性があります。プロバイオティクス、プレバイオティクス、そして食事介入を通して腸内細菌叢を調節することは、細胞老化を軽減するための有望な手段であり、老化やその全身的影響に対抗できる特定の微生物株や食事成分を特定する必要性を示唆しています。腸内細菌叢の構成には個人差があることを考えると、個人の腸内細菌叢のプロファイル、遺伝的素因、環境要因に合わせて治療を調整する、個別化された腸内細菌叢介入が将来の戦略の基礎となる可能性があります (Ciernikova et al., 2023; Ghosh et al., 2022; Ma et al., 2023; Rafique et al., 2023)。 |
| 第三に、腸内細菌叢研究を、ゲノム不安定性、テロメア減少、ミトコンドリア機能不全といった他の老化理論と統合することで、老化の理解が深まり、複数の老化メカニズムに同時に対処できる介入のための相乗効果のあるターゲットが明らかになる可能性がある。しかしながら、糞便微生物叢移植(FMT)などの既存の介入は、個人差や病原性微生物叢の伝播の可能性といった課題に直面している(Cheng & Fischer, 2017)。個々の特性に合わせて調整された老化治療薬を用いて特定の老化細胞を標的とした調節は、プレシジョン・メディシン(精密医療)の有望な戦略として浮上している(Niedernhofer & Robbins, 2018; Zhang et al., 2022; Zhang, Pitcher, et al., 2023)。 |
| 第四に、メタトランスクリプトミクスの進歩により、活性微生物群とその機能的役割の詳細な特性評価が可能になり、人工知能(AI)は老化抑制薬の開発を促進し、老化を精密に標的とする期待が高まっています(Ojala et al., 2023; Smer‐Barreto et al., 2023)。しかし、老化プロセスの複雑さは、従来の計算手法を用いて腸内細菌叢の変化パターンを標準化し、特定の老化細胞や微生物叢の分類群を特定する上で大きな課題となっています(Ojala et al., 2023; Scepanovic et al., 2019)。量子コンピューティングの登場は、その優れたデータ処理速度、正確性、そして精密性により、この分野に変革をもたらす可能性をもたらしています。量子コンピューティングは、薬物相互作用、結合エネルギー、化学反応の精密計算に優れており、従来のコンピューティングシステムの能力を凌駕しています(Arute et al., 2019; Zinner et al., 2021)。さらに、分子レベルでのタンパク質相互作用の大規模シミュレーションのモデル化にも期待が寄せられており、これは老化細胞と腸内細菌叢の複雑な相互作用を理解する上で極めて重要な側面です(Gupta et al., 2023; Niraula et al., 2021)。量子コンピューティングを活用することで、標的となる腸内細菌叢の選択や、腸内細菌叢の恒常性の回復を目的とした老化治療薬の開発に革命をもたらす可能性があります。これらの技術の進歩が進むにつれ、老化研究と治療の未来は、腸内細菌叢と細胞老化の調節を正確に調整できる時代へと向かい、健康的な老化を促進し、老化関連疾患の影響を軽減するための新たな道が開かれるでしょう(奥村ら、2021年;佐藤ら、2021年)。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Aging Cell. 2024 Aug 15;23(10)に掲載されたThe connection between aging, cellular senescence and gut microbiome alterations: A comprehensive review.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |