
Saurabh Kadyan et al., |
要約 |
| 腸内マイクロバイオームは私たちの生涯のパートナーであり、誕生から生涯を通じて健康を左右します。腸内マイクロバイオームの構成は加齢とともに絶えず変化し、生理学的および免疫学的発達の両方に影響を与えます。新たなエビデンスは、マイクロバイオームが健康で病気のない老化や長寿と密接な関連があり、それゆえに重要な役割を果たすことを強調しています。したがって、腸内マイクロバイオームを標的とすることは、老化関連疾患の予防、緩和、改善のための有望な手段として浮上しています。本稿では、腸内マイクロバイオームとヒトの老化との密接な関係について、将来的かつ包括的な枠組みを提示し、この関連性が加齢関連疾患とどのように絡み合っているかを考察します。私たちは、加齢に伴う様々な疾患の緩和に役立ち、ひいては高齢者の健康と幸福の向上につながると期待される、最近登場したマイクロバイオームに基づく治療法や、将来有望な治療法について深く掘り下げます。最後に、健康と長寿の促進という全体的な目標を掲げ、高齢者向けに開発されカスタマイズされたマイクロバイオームベースの治療法の展望を強調する基礎と展望を示します。 |
| 目次(クリックして記事にアクセスできます) |
| 1.背景 |
| 2.バイオーム老化の概念とメカニズム |
| 3.宿主の老化と長寿におけるバイオーム老化の兆候 |
| 4.バイオーム老化、腸内ディスバイオシス、および関連する疾患素因 |
| 5.バイオーム老化と腸疾患 |
| 6.バイオーム老化と免疫機能障害 |
| 7.バイオーム老化と心血管疾患 |
| 8.バイオーム老化と認知障害 |
| 9.バイオーム老化とその他の全身的健康への影響 |
| 10.老化を緩和し、長寿を促進するマイクロバイオームに基づく治療法 |
| 11.栄養と食事要素 |
| 12.プロバイオティクス、プレバイオティクス、シンバイオティクス |
| 13.ポストバイオティクス |
| 14.マイクロバイオーム関連薬剤およびサプリメント |
| 15.糞便微生物移植 |
| 16.今後の方向性 |
| 17.結論 |
| 本文 |
| 1.背景 |
| 老化は、基本的な生理機能の緩やかな衰えと進行性老化を含む自然な生理学的プロセスです。加齢に伴い老化が加速し、細胞内損傷の蓄積と加齢関連疾患への罹患リスクの増加につながります[1]。世界中から実施された包括的かつ大規模なメタゲノム研究を通して得られた新たなエビデンスは、腸内マイクロバイオームとヒトの老化および加齢に伴う健康状態との密接な相互作用を示唆しています[2–4]。ヒト腸内マイクロバイオームは、高密度かつ多様な微生物群集であり、宿主と共生し、また自らも共生関係にあり、生涯を通じて宿主の環境やライフスタイルに応じて継続的に適応し、変化し続けています[5]。しかし、内因性または外因性の要因によって引き起こされる腸内マイクロバイオームの破壊は、微生物の恒常性を破壊し、「ディスバイオーシス(腸内細菌叢の乱れ、腸内毒素症)」状態を引き起こす可能性があります。これは、宿主の腸管、心血管代謝、免疫、および/または神経認知の健康状態を含む多方向のコミュニケーション軸を介して、さまざまな加齢関連疾患(ARD)の発症を誘発または悪化させる可能性があります[6]。最近の研究では、マイクロバイオームを標的とした治療法が加齢関連疾患を予防・改善することで健康的な老化を促進する可能性があることが示されています[7–10]。したがって、高齢者向けの個別化治療法の開発には、疾患特異的な分類群とその代謝機能を含む、自然および環境誘発性のマイクロバイオームの変化を正確に理解することが不可欠です[4]。加齢に伴う腸内マイクロバイオームの変化は、晩年の健康の主要な決定要因となる可能性があります。このような状況において、治療目的でマイクロバイオームを最適化するための新しい戦略は、健康寿命を延ばし、世界の医療費を削減する可能性があります。この目的のため、本稿では、加齢関連疾患の潜在的な治療標的として腸内マイクロバイオームとディスバイオシスを標的とする話題の研究に関する展望を提示する。続いて、健康な老化と長寿を促進するマイクロバイオームベースの治療法の初期の可能性に関する最近の進歩を要約し、考察する(図1)。最後に、人生のさまざまな段階におけるこのような老化関連のマイクロバイオームの変化の概念を示すために、「バイオーム老化」という用語を紹介・提案する。バイオーム老化の紹介において、腸内環境における累積的な変化(バリアの完全性や栄養吸収の変化から多剤併用療法の影響まで)が、微生物群集を徐々に再構築することを強調する。このダイナミクスは、有益な微生物の減少、病原性微生物の増加、そして局所レベルと全身レベルの両方での炎症反応の亢進を促進する。バイオーム老化を定義することにより、高齢者のバランスの取れた腸内生態系を維持することの重要性を強調し、加速老化や病理学的老化に関連する健康リスクを軽減する新たな可能性を切り開きます (図 1)。 |
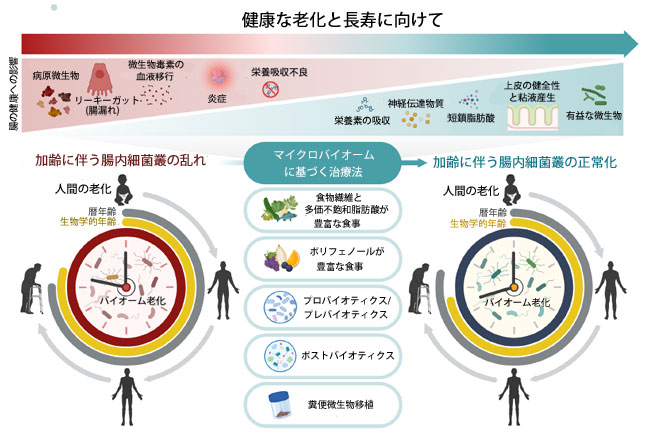 |
図1 バイオーム老化とマイクロバイオームに基づく治療法の概念的概要。 加齢に伴い、食生活、ライフスタイル、生理機能などの要因の大きな変化が「バイオーム老化」と呼ばれるプロセスに寄与します。これは、有益な常在菌の減少、病原性微生物の増殖、腸管透過性亢進(「リーキーガット」)を特徴とする、加齢に伴う腸内細菌叢の乱れです。この腸内環境の乱れは、微生物毒素の全身循環への移行を促進し、慢性炎症を促進します。同時に、機能的微生物の減少は栄養素の代謝と生合成を阻害し、栄養素の吸収不良や微生物由来の必須栄養素の欠乏につながります。これらの変化が相まって、生物学的老化を加速させ、加齢関連疾患のリスクを高めます。マイクロバイオームに基づく治療戦略(食物繊維や多価不飽和脂肪酸を豊富に含む食事、ポリフェノールを豊富に含む食事、プロバイオティクス、プレバイオティクス、ポストバイオティクス、糞便マイクロバイオーム移植など)は、腸内微生物バランスを回復させることでバイオーム老化を軽減する可能性を示しています。これらの介入は、有益な機能的微生物の増殖と、短鎖脂肪酸や神経伝達物質といった重要な微生物由来代謝物の産生を促進します。その結果、栄養素の生合成が促進され、上皮バリアの完全性が強化され、粘液産生が改善され、健康的な老化と疾患予防に貢献します。BioRenderで作成。Nagpal, R. (2025) (https://BioRender.com/5137mjt) |
| 2.バイオーム老化の概念とメカニズム |
| 腸内細菌叢の乱れが特徴的な症状なのか、それとも不健康な老化や加速老化、そして関連する加齢関連疾患(急性呼吸器疾患)の原因因子なのかという区別は、解明され始めたばかりです。インターロイキン(IL)-1、IL-6、および腫瘍壊死因子α(TNFα)の上昇を特徴とする全身性の低度慢性炎症は、加齢関連疾患の主要な原因として浮上しています[11]。「インフラメージング」として知られるこの状態は、宿主の免疫系との緊密な相互作用を通じて、腸内細菌叢の調節異常に寄与します。バイオーム老化という文脈において、インフラメージングとディスバイオシスの間のこの潜在的な双方向コミュニケーションは、特定の外部刺激によって影響を受ける可能性があります。例えば、多剤併用、身体活動の不足、社会的孤立、消化管(GIT)の劣化によるホルモン変化、栄養失調などの要因は、バイオーム老化だけでなく、ヒトの老化にも影響を与えることが知られています。老化モデル研究において、非抗生物質薬の過剰処方は消化管の重篤な変化や腸内細菌叢の多様性の低下にも関連付けられている[12]。薬物は食欲、特定の栄養素の吸収能力、口渇に変化をもたらし、唾液中の酵素産生を低下させることが知られている[13]。多剤併用療法と栄養失調は相まって、食物繊維摂取量と、病原体防御、バリアの完全性、短鎖脂肪酸(SCFA)、ビタミン、ムチン、神経伝達物質の産生に関与する有益な腸内細菌を減少させる[12]。これらの複合的な影響は、局所的にも全身的にも過剰炎症(または炎症誘発性)状態を引き起こす。さらに、食物繊維摂取量の減少は、便秘、膨満感、下痢、吐き気などの症状を特徴とする腸管運動と結腸通過の調節不全につながる[13]。さらに、腸管神経系(ENS)内の筋層間神経叢の変性は、これらの疾患をさらに障害し、悪化させる。高齢者では、腸管神経叢の結腸領域における細胞老化マーカーの発現(アップレギュレーション)が加速するとともに、腸管神経細胞の数も筋層間神経叢で減少し始める[14]。加齢に伴う胃pHの上昇は、慢性萎縮性胃炎に起因することが多く、胃粘膜の腺機能低下の結果として無胃酸症および低胃酸症を引き起こす[15]。胃pHの上昇は、ヘリコバクター・ピロリやその他の病原性細菌の過剰増殖を促進する可能性もある[16]。加齢に伴い、腸管上皮細胞(IEC)の機能が低下し、腸管幹細胞は自己複製能力を失い、組織の若返りと治癒が損なわれる。最終的には、腸管上皮細胞、特に腸管上皮細胞と杯細胞の老化により、サイトカインと粘液の産生が減少し、病原体の侵入や感染に対する感受性が高まります[17]。 |
| 補助臓器に関しては、加齢により膵外分泌液が減少し、腸内微生物の恒常性が不安定になります。一次胆汁酸と二次胆汁酸(BA)も加齢とともに減少しますが、高齢者の腸内微生物叢によって二次胆汁酸のプロファイルは大きく変化します。特に、100歳以上の高齢者は、抗菌作用を持つ二次胆汁酸(例えば、リトコール酸のユニークなアイソフォーム)を産生できるユニークなマイクロバイオーム表現型を示し、腸内恒常性と定着抵抗性を促進します[18]。逆に、デオキシコール酸やそのグリシンまたはタウリン抱合型などのマイクロバイオーム由来の二次胆汁酸のディスバイオティックプロファイルは、アルツハイマー病(AD)を含む加齢関連疾患と関連付けられています[19]。総合すると、二次的な胆汁酸プロファイルの変動は、マイクロバイオームの変化が腸管恒常性と宿主の老化関連の健康に影響を与えるメカニズムの一つとして想定できる。さらに、加齢と全身老化に伴い、胆嚢は満腹感を媒介するペプチドホルモンであるコレシストキニンに対する不応性を徐々に獲得し、血漿中濃度の上昇につながる[20]。このコレシストキニン機能の抑制は、食欲・空腹感および食物摂取量の減少に徐々につながり、高齢者の栄養失調を促進し、これらすべてがビタミン合成、エネルギー代謝、および免疫機能に不可欠な有益な腸内細菌叢を徐々に減少させる[21]。マイクロバイオームとその宿主に影響を与える内因性および外因性因子は極めて多様で、個人差が大きいため、バイオーム老化の正確なメカニズムと結果に関する理解は依然としてほとんど不明確である。しかしながら、新たなエビデンスが、腸内マイクロバイオームと宿主の生理学的相互作用に関する複雑かつ重要な研究において急速に大きな進歩をもたらしている。次のセクションでは、これらの累積的な変化が、宿主の老化と寿命を反映、または潜在的に予測する観察可能な微生物シグネチャにどのように変換されるかを検討することに注目します。 |
| 3.宿主の老化と長寿におけるバイオーム老化の兆候 |
| バイオーム老化現象を包括的に理解することは、健康的な老化と長寿を支えるツールとして、非常に大きな可能性を秘めています。図2に示すように、私たちのマイクロバイオームは、人生のさまざまな段階を経て加齢するにつれて着実に適応していきます。出生前の子宮内マイクロバイオームの存在は依然として議論の的となっていますが[22]、腸内常在細菌によるコロニー形成は出生後に始まることが確立されています[23]。この新生児の微生物学的個体発生は、乳児期(生後1000日)の間も発達を続け、3~4歳までに比較的安定します[23]。新生児の腸内細菌叢はビフィドバクテリウム属菌が優勢ですが、母乳や粉ミルクから離乳食への移行に伴い、他の競合微生物群が出現するため、生後1年までにビフィドバクテリウム属菌の数は減少する傾向があります。乳児のマイクロバイオームは3~6歳までに成人のような構造を示し始めると以前は考えられていましたが[5, 24]、最近の研究では、6~12歳の小児の特定のマイクロバイオームの特徴は、依然として成人とは大きく異なることが示唆されています[25]。対照的に、腸内マイコバイオーム(真菌マイクロバイオーム)の発達はバクテリオムの発達とは逆の傾向を示し、真菌の多様性と存在量は、個人が成人に移行するにつれて減少します[26]。新生児および乳児の腸内マイコバイオームは通常、サッカロミセスおよびエキソバシディオミセテス(出生)、デバリオミセス・ハンセニーおよびカンジダ・パラプシロシス(3か月)、およびサッカロミセス・セレビシエ(1歳)によって支配されています[26]。この発達の軌跡は、分娩方法、授乳タイプ、病院環境、母親のマイクロバイオーム、および抗生物質への曝露を含む、出生前および新生児のさまざまな要因によって影響を受けます。母乳栄養児は、母乳オリゴ糖の消化に特化したビフィズス菌種を保有する一方、粉ミルク栄養児はより多様なマイクロバイオームを形成する[5]。その後、成人のマイクロバイオームは、フィルミクテス門とバクテロイデス門が優勢で、次いで放線菌、プロテオバクテリア、ヴェルコミクロビア門が続く安定した細菌門プロファイルを形成する[23]。しかしながら、成人腸内マイクロバイオームの多様性と密度のため、低レベルの分類学的変異は個人間で依然として高いままである。 |
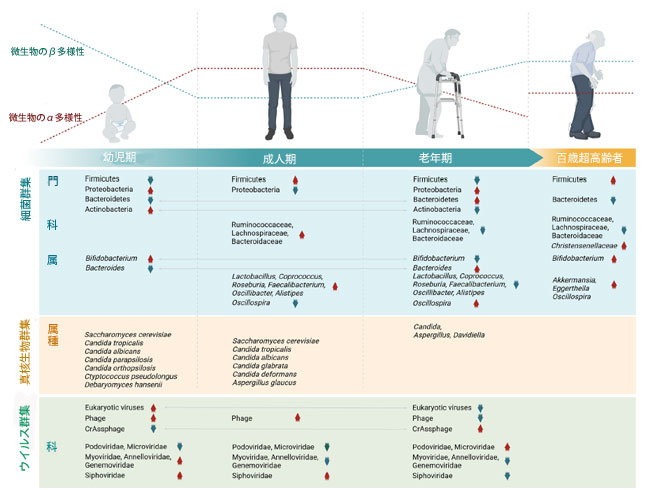 |
図2. 生涯にわたる腸内マイクロバイオーム構成の動的な変化。 乳児期から成人期、老年期、そして百歳以上の高齢者に至るまで、腸内細菌叢、真菌群集の変化。 BioRenderで作成。Nagpal, R. (2025) (https://BioRender.com/dyakwuj) |
| 世界的な高齢化が加速する中、老化関連疾患の特徴を予測し、健康的な老化を促進するために、老後の微生物の遷移を理解することに研究の焦点がますます当てられています。 近年、若年成人期(22〜48歳)からセミスーパーセンテナリアン(105〜109歳)への移行は、バクテロイデス科、ラコノスピラ科、およびルミノコッカス科に属する微生物群の顕著な減少によって特徴付けられる一方で、オシロスピラ、アッカーマンシア、クリステンセネラ科、およびビフィズス菌は加齢と正の相関関係にあることが発見されました[27]。 特にクリステンセネラ科は宿主の遺伝学の影響を受けやすく、遺伝子型はその存在量の30〜40%を説明することから、宿主の遺伝学とヒトの長寿の促進との間の潜在的な関連が示唆されています[28]。腸内ムチン分解菌として著名なアッカーマンシア・ムシニフィラは、腸管炎症や代謝機能障害を予防しながら上皮細胞の完全性を維持することが分かっています[29]。ビフィドバクテリウム属は、炎症性微生物群に拮抗し、相互摂食機構を介して短鎖脂肪酸(SCFA)の産生に寄与することが分かっています[23]。これらの微生物群は健康的な生活と長寿と関連していますが、これが生活習慣に起因するのか、それとも個人特有のものなのかは依然として不明です。しかしながら、失われた有益な微生物群を回復させることは、健康的な老化と長寿を促進するための介入策の開発に役立つ可能性があります。長寿が主要なマイクロバイオームの特徴と関連しているという考えは、100歳以上の高齢者(66~85歳)と比較して、微生物の多様性と種の豊富さが維持されていることを報告した縦断的研究によってさらに裏付けられています[2]。興味深いことに、驚くことではないが、バクテロイデス属、具体的にはB. テタイオタオミクロンやB. ユニフォミティスなどのより有益な常在菌種の腸内保菌率は、100歳以上の人の方が著しく高いことがわかりました。別の研究では、健康的な老化と、バクテロイデス属の存在量の加齢依存的な減少と、インドールなどの生理活性微生物由来代謝物を合成できる希少な分類群によって引き起こされる腸内マイクロバイオームの独自性の増加を特徴とするマイクロバイオームの老化軌道が関連付けられました[3]。特筆すべきことに、バクテロイデス属は機能的に多様な属であり、その種は健康と疾患の両方で役割を果たしており、これは他のレビューでレビューされているように[30]。したがって、種レベルで老化の軌跡を解析することで、老化に伴うマイクロバイオームの動態についてより深い洞察が得られると考えられる。理想的な老化マイクロバイオームは、有益な分類群を維持しながら、フレイルに関連する病原性微生物群を抑制すると考えられる。フレイルは、握力の低下、エネルギー不足、身体活動の低下、体重減少といった症状を呈し、高齢者の障害、入院、死亡率を高める。これらの基準は、生涯にわたる特定の微生物分類群の減少および/または増加とも相関している。例えば、高いフレイルスコアは、腸内における特定の共生菌および有益な分類群(コプロコッカス・ユータクタス、プレボテラ・コプリ)の減少と、潜在的に有害なクレード(クロストリジウム・ハテワイ、バクテロイデス・フラギリス)の優勢と関連している[31]。 エンテロクロスターボルトエ、E.アスパラギフォルメ、ラクリミスポラ・ハザウェイ、クロストリジウム・シトロニアエ、C.シンビオサム、ストレプトコッカス・パラサンギニスなどの細菌群の腸内保菌量の増加は加齢と関連しており、高フレイルスコアの特徴として報告されている[4]。メカニズム的には、これらのマイクロバイオームの変化は、短鎖脂肪酸(SCFA)とトリプトファンの減少、スレオニン、疎水性二次胆汁酸(リトコール酸およびデオキシコール酸)、トリメチルアミンオキシド(TMAO)、p-クレゾール、エタノール、アンモニアの増加など、加齢関連疾患に関連する代謝変化と関連している。同時に、フルクトオリゴ糖およびキシロオリゴ糖に依存する主要な繊維発酵分類群も減少する傾向がある[4]。これらの知見は、バイオーム老化のメカニズムを支持するものであり、日和見菌/炎症性微生物の増加と常在菌/有益菌の減少を特徴とする微生物多様性の減少が、老化の加速とフレイルの増加に関与していることが示唆されています。次のセクションでは、このような微生物の不均衡、特にディスバイオシスに関連する不均衡が、高齢者を様々な全身性疾患や慢性疾患に罹患しやすくする要因となる可能性について考察します。 |
| 4.バイオーム老化、腸内ディスバイオシス、および関連する疾患素因 |
| ますます多くの研究により、腸内マイクロバイオームと全ての臓器系の間に、主に内分泌、神経(迷走神経など)、代謝、免疫経路を介して複雑な双方向コミュニケーションネットワークが存在することが明らかになっています。ディスバイオシスの状態でもユーバイオシス(訳者注:正常な微生物バランス)の状態でも、微生物は短鎖脂肪酸(SCFA)、神経伝達物質(γ-アミノ酪酸 [GABA]、ドーパミン、セロトニン)、サイトカイン、リポ多糖類(LPS)、ホルモン、神経ペプチド、アミノ酸の合成に影響を与えます。これらの腸管系コミュニケーションの破綻は、腸管、免疫、心血管、認知機能の障害との関連性がますます高まっています(表1および図3参照)。 |
| 表1. 加齢に伴うマイクロバイオームの乱れが様々な病態に及ぼす影響を示唆するエビデンスの要約 |
 |
 |
 |
| FadA フソバクテリウム接着因子A、TLR Toll様受容体、TNFα 腫瘍壊死因子α、IL インターロイキン、SCFA 短鎖脂肪酸、OMV 外膜小胞、CD25 分化クラスター25、TMA トリメチルアミン、TMAO トリメチルアミンN-オキシド、LPS リポ多糖 |
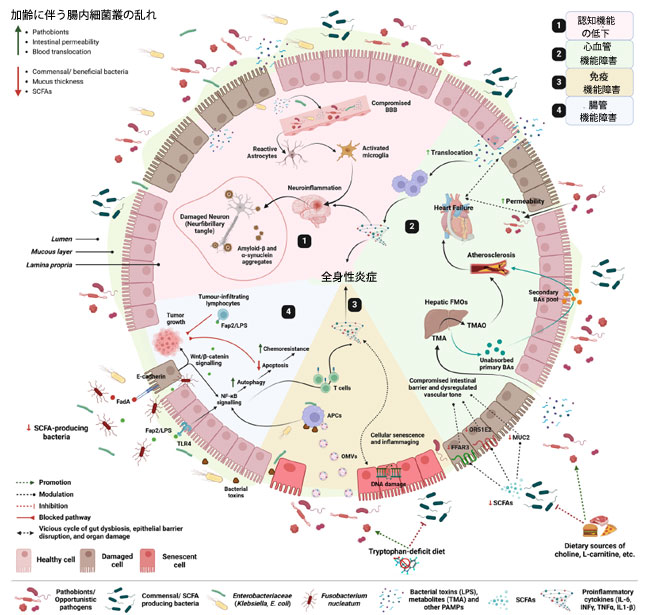 |
図3. 腸内細菌叢の乱れと加齢関連疾患のメカニズムに関する考察の概要。 加齢に伴う腸内細菌叢の乱れは、病原性微生物の漸進的な増加と、共生・有益微生物群の減少を特徴とし、代謝プールの変化(例えば、短鎖脂肪酸の減少とトリメチルアミンなどの有害代謝物の増加)を招き、同時に腸管透過性の増加、粘液産生の減少、微生物、その代謝物、および病原体関連分子パターン(PAMP)の血中移行の増加が起こります。(1) これらの撹乱は、血液脳関門(BBB)の機能低下を介してアストロサイトとミクログリアを活性化し、神経炎症、タンパク質凝集体(β-アミロイド/α-シヌクレイン)の形成、タウ萎縮を引き起こし、高齢者の認知障害(アルツハイマー病およびパーキンソン病)のリスクを高めます。 (2) 短鎖脂肪酸(SCFA)の産生低下はムチン産生にも悪影響を及ぼし、血管緊張の調節を阻害し、心血管系の健康にリスクをもたらします。さらに、腸内細菌叢の乱れは有害代謝物(例:トリメチルアミン、二次胆汁酸)の産生を促進し、状況をさらに悪化させ、動脈硬化、ひいては心不全につながります。心不全は腸の虚血と浮腫を引き起こし、腸管の漏れをさらに促進し、間接的に炎症誘発反応を高めます。(3) 腸内細菌叢の乱れは、細菌性病原体関連分子パターン、外膜小胞(OMV)などを介して炎症性老化と免疫老化を促進し、NF-κB経路を誘導して炎症誘発性サイトカインを分泌します。そして、これがDNA損傷修復機構の遅延によって細胞老化を促進します。 (4) 特定の細菌種(例:フソバクテリウム・ヌクレアタム)の病原体関連分子パターン(例:FadA、Fap2、LPS)を介しての促進は受容体(TLR4、E-カドヘリン)と相互作用し、それによって腫瘍シグナル伝達を増強し、オートファジーを抑制し、大腸癌などの腸疾患の発症につながります。 SCFA、短鎖脂肪酸。FadA/Fap2、Fusobacterium アドヘシン。TLR4、Toll 様受容体 4。NF-κ、核因子 κ。Wnt、wingless/integrated 経路。LPS、リポ多糖。OMV、外膜小胞。APC、抗原提示細胞。MUC2、ムチン 2。OR51E2、嗅覚受容体 51E2。FFAR3、遊離脂肪酸受容体 3。TMA、トリメチルアミン。TMAO、トリメチルアミン N-オキシド。 FMO(フラビンモノオキシゲナーゼ)、BA(胆汁酸)、PAMP(病原体関連分子パターン)、IL(インターロイキン)、INF(インターフェロン)、TNFα(腫瘍壊死因子α)。BioRenderで作成。Nagpal, R. (2025) (https://BioRender.com/5xglc1b) |
| 5.バイオーム老化と腸疾患 |
| 腸疾患は、腸内細菌叢の乱れ、および腸内環境の乱れに伴う細胞・分子レベルのシグナル伝達の異常と密接に関連しています[6, 32]。このようなマイクロバイオームの異常は、しばしば腸管上皮透過性亢進(「リーキーガット」、腸漏れ)、粘液産生および粘膜免疫の低下、炎症誘発反応の亢進を引き起こし、炎症性腸疾患(IBD)、過敏性腸症候群(IBS)、大腸がん(CRC)などの腸管病態に関与しています[6]。例えば、特定の疾患関連菌群(例:フソバクテリウム、パルビモナス、ポルフィロモナス、バクテロイデス、ゲメラ、エンテロバクター、ペプトストレプトコッカス)が大腸がん患者において異常に増加していることが分かっています[33]。 フソバクテリウム・ヌクレアタムは、腫瘍シグナル伝達経路の活性化、免疫監視の抑制、化学療法抵抗性およびオートファジーの増強を通じて大腸癌の進行を促進する[34]。さらに、早期発症型大腸癌患者において、多様性および酪酸/γ-アミノ酪酸生合成の減少と並行してF.ヌクレアタムが増加することが報告されている[35]。炎症性腸疾患の病態は、特定の有益な分類群(フェカリバクテリウムおよびローズブリア)の減少、病原性細菌(大腸菌およびクレブシエラ)および細菌毒性因子の増加とも関連付けられており[32]、微生物由来の毒性因子が疾患の重症化に関与している可能性をさらに強調している。今後、臨床研究および大規模縦断研究によって、これらの腸疾患の仮説と観察の根底にあるより深いメカニズムが明らかになり、検証されることが期待される。 |
| 6.バイオーム老化と免疫機能障害 |
| 炎症老化は、加齢に伴う慢性炎症を特徴とし、酸化ストレス、免疫細胞老化(免疫老化)、腸内細菌叢の乱れなど、複数の因子によって制御・増悪されます。これらの因子は、腸管免疫系の機能を総合的に阻害し、最終的には加齢に伴う炎症プロセスを激化させます[6, 11, 36]。加齢に伴う微生物叢の乱れは、腸管上皮透過性とマクロファージ機能不全を刺激し、その結果、細菌産物が血流に移行し、全身性の過剰炎症(例:TNFαレベルの上昇)を促進する可能性があります[36]。例えば、研究では、加齢に伴う食生活の変化や 短鎖脂肪酸合成の低下に伴って起こる食物繊維の欠乏が、腸内細菌叢の乱れとムチン分解細菌の増加 [37] を引き起こし、粘膜層の厚さの減少、炎症性サイトカイン (IL-33 および IL-25) および免疫グロブリン E (IgE) を介した免疫応答の増加につながることが実証されています [37]。もう 1 つの例はトリプトファンで、これは腸の健康と腸の恒常性の維持に不可欠なマイクロバイオーム由来の代謝物です。トリプトファン欠乏食も腸内細菌叢の乱れを誘発し、前臨床の老齢マウスモデルで炎症老化を促進する可能性があることが報告されています [38]。HIV 患者におけるリンパ球 (CD4 + T 細胞など) の変性によって引き起こされる免疫老化も、腸内細菌叢の乱れによって誘発されるのではないかと推測されています [39]。閉経後参加者から採取した微生物叢を、カロリー制限前後のノトバイオートマウスに移植した最近の研究では、カロリー制限に関連する微生物叢がナイーブB細胞とT細胞を促進し、エフェクターメモリー細胞を減少させることが示され、カロリー制限が宿主免疫-微生物叢軸を介して免疫老化を遅らせる可能性が示唆されました[40]。これは、微生物叢を介した宿主免疫系のリモデリングが、短鎖脂肪酸の産生と自然免疫の直接活性化という2つの主要なメカニズムによって制御されているため、特に重要です。微生物叢由来の短鎖脂肪酸は、免疫細胞の分化と分極に影響を与え、Gタンパク質共役受容体(GPCR)を活性化し、ヒストン脱アセチル化酵素を阻害することで宿主免疫を調節することが知られています[1]。さらに、自然免疫の直接的な活性化、特に病原菌による外膜小胞(OMV)の放出に関連する活性化も、マクロファージの機能不全につながることが知られています[1]。これらの報告とメカニズムを合わせると、「健康」または「若々しい」マイクロバイオームが、老化や炎症老化に対する防御において抗老化の役割を果たす可能性が示唆されます[6]。 |
| 7.バイオーム老化と心血管疾患 |
| 腸内細菌叢の乱れが心血管疾患(CVD)、心不全、および動脈硬化の促進に重要な役割を果たすことが明らかになりつつある[41]。腸-心臓仮説は、心筋症誘発性の腸管虚血および浮腫がリーキガット(腸漏れ)を促進し、血流中の細菌成分の増加とそれに続く炎症反応の亢進を引き起こすと仮定している[42]。必然的に、腸機能障害は腸内細菌叢および代謝物のプロファイルを変化させる。例えば、腸内細菌叢由来のトリメチルアミン N-オキシドは、動脈硬化性心血管疾患のリスク増加と一貫して相関していることが報告されている[43]。さらに、CD25マーカーは心不全と正の相関関係にあり、心不全はラコノスピラ科と逆相関している[44]。マイクロバイオーム由来の短鎖脂肪酸は、Gタンパク質受容体(GPR41およびGPR43)の調節、嗅覚受容体51E2の活性化、ヒストンアセチルトランスフェラーゼおよびヒストン脱アセチル化酵素のアップレギュレーション、粘液産生の促進によって、血圧および血管緊張を調節することも知られています。腸内微生物によるコリン、ホスファチジルコリン、L-カルニチンの代謝によるトリメチルアミン(TMA)/ トリメチルアミン N-オキシド(TMAO)および二次胆汁酸の産生は、心血管リスクの増加と関連付けられています[42]。腸管上皮細胞の透過性亢進または「リーキー」な環境下でのリポ多糖の腸管から血液への移行は、TLR4/NF-κBシグナル伝達を介した炎症性サイトカイン分泌を介してアテローム性動脈硬化を促進することも知られています[41]。腸内細菌叢は吸収されなかった一次胆汁酸を二次胆汁酸に変換し、腸肝循環に入り、全身の炎症および線維化プロセスに影響を及ぼす可能性がある[42]。さらに、歯周炎に見られるように、口腔マイクロバイオームのディスバイオーシスは、病原体(例:S.ミュータンス、ポルフィロモナス・ジンジバリス)の全身循環への移行を促し、炎症を誘発して動脈硬化性毒素を放出することで、アテローム性動脈硬化性プラークの形成を促進する[45]。 |
| 8.バイオーム老化と認知障害 |
| 腸内マイクロバイオームは、腸-脳軸を介して神経認知機能に影響を及ぼすこともよく知られています。例えば、アルツハイマー病(AD)は、アミロイドβプラークの細胞外蓄積と、高リン酸化タウタンパク質の神経原線維変化の細胞内沈着を特徴とする神経変性疾患です。この不均衡な状態は、腸管ユーバイオシス下の脳実質におけるアストロサイトとミクログリアの恒常性維持により回避されます[46]。しかし、腸管上皮透過性と血液-脳関門(BBB)の完全性の低下による腸内細菌叢の乱れは、細菌性神経毒素(リポ多糖など)や病原体によって誘発される炎症性サイトカインストームを刺激し、アストロサイトとミクログリアの過剰活性化を引き起こす可能性があります。アルツハイマー病患者では、腸内細菌叢の減少とフィルミクテス属とバクテロイデス属の比率の上昇が一般的に認められます[47]。アルツハイマー病患者では、健常者と比較して、特定の病原性および炎症性細菌属(例:大腸菌、赤痢菌)の菌数が増加し、常在抗炎症細菌(例:ユーバクテリウム・レクタル)が減少しています[48]。パーキンソン病もまた、黒質緻密部におけるドーパミン作動性ニューロンの減少とレビー小体(α-シヌクレインの蓄積)の出現を特徴とする一般的な疾患です。パーキンソン病患者では酪酸産生菌(プレボテラ科およびラクノスピラ科)の存在量が減少しているが、同時に特定の有益な菌(ビフィドバクテリア科、ルミノコッカス科、ラクトバチルス・アシドフィルス)が増加することも報告されており[49]、パーキンソン病の病理に関連する主要な菌の発見を複雑にしている。しかし、有益な菌の増加は疾患期間と相関しており、ルミノコッカス科は10年以上の疾患歴を持つ患者と正の相関があるのに対し、10年未満の疾患歴を持つ患者とは相関が弱いことがわかった[50]。さらに、神経認知障害患者では、2つの神経伝達物質(ホスファチジルコリンおよびアセチルコリン)の前駆体であるコリンが減少する一方で、脳脊髄液中のトリメチルアミン N-オキシドレベルが上昇することがわかっている[49]。これらの発見は、腸内微生物叢によるコリンのトリメチルアミン(TMA)/ トリメチルアミン N-オキシド(TMAO)経路への変換に関連する悪影響をさらに強調しています。 |
| 9.バイオーム老化とその他の全身的健康への影響 |
| バイオーム老化は、加齢に伴う筋肉、骨、肝臓、皮膚の健康にも関連しています。筋肉の消耗を特徴とするサルコペニアは、腸内細菌叢および腸内代謝産物の構造に影響を受けると考えられています[51]。腸内細菌叢の乱れは骨格筋代謝を変化させ、筋萎縮を促進する可能性があります。加齢に伴う腸肝軸の双方向クロストークの乱れは、宿主の肝機能障害を招き、老年性非アルコール性脂肪性肝疾患(NAFLD)の発生につながる可能性があります[52]。老年性非アルコール性脂肪性肝疾患患者に多くみられる細菌群には、バクテロイデス属やルミノコッカス属などがあり、プレボテラ属、フェカリバクテリウム属、アッカーマンシア属、ビフィドバクテリウム属は減少していることが分かっています[52]。骨密度の低下や骨折リスクの増加などの加齢に伴う骨格異常も、腸内細菌叢の異常に関連していることが示されています [53]。腸内細菌叢の乱れは皮膚機能を障害し、腸管皮膚軸を介して皮膚疾患に寄与する可能性があります。自己免疫性皮膚水疱性疾患である水疱性類天疱瘡の高齢者では、アルファ多様性の低下と腸内細菌叢の構成と機能の変化(フェカリバクテリウム・プラウスニッツィの存在量の減少と γ-アミノ酪酸(BABA)代謝経路の濃縮を含む)が報告されています [54]。逆に、皮膚損傷も皮膚腸軸を介して腸内細菌叢に影響を及ぼす可能性があり、Dokoshi ら [55] は、皮膚損傷後の皮膚ヒアルロン酸の放出が結腸細菌叢を変化させ、実験マウスモデルで大腸炎を誘発することを示しました。 |
| これを理解し、次のセクションでは、マイクロバイオームに基づく治療介入がどのようにしてこれらの老化関連の影響を打ち消し、健康的な長寿を促進するのかに焦点を当てます。 |
| 10.老化を緩和し、長寿を促進するマイクロバイオームに基づく治療法 |
| 腸内マイクロバイオームを標的とし、腸内細菌叢の乱れから腸内細菌叢の正常な状態(ユーバイオシス)を回復させる治療介入は、腸内環境の改善だけでなく、全身の健康状態の改善、そして加齢関連疾患の緩和による健康的な老化と長寿の促進にも期待が寄せられています。この前提を裏付ける最近の発見とその根底にあるメカニズムのいくつかは、表2と図4にまとめられており、以降のセクションで考察されます。 |
| 表2. マイクロバイオームベースの治療薬の微生物相互作用と代謝効果に焦点を当てた研究の要約 |
 |
 |
 |
 |
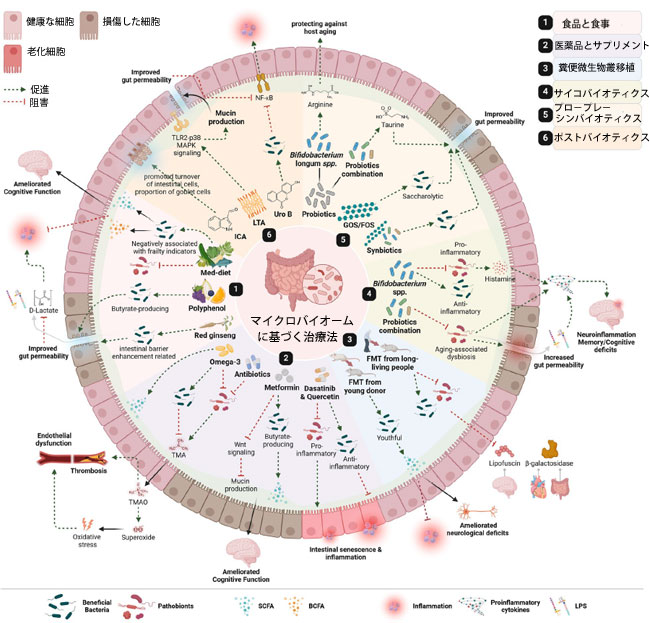 |
図4. 不健康な老化を防ぎ、より健康で病気のない老化と長寿を育むための、潜在的なマイクロバイオームベースの治療法。 加齢に伴う疾患における腸内マイクロバイオームの重要な役割が認識され、加齢に伴う疾患を改善または予防するためのマイクロバイオームベースの治療法が積極的に研究されています。これらの治療法は、有益な微生物叢とその機能を回復または促進し、あるいは病原性微生物叢を減らすことで、腸内微生物群集のバランスを取り戻し、疾患のサイクルを断ち切るように設計されています。特定の食事や食品の摂取、プロバイオティクス、プレバイオティクス、シンバイオティクス、ポストバイオティクス、薬剤、サプリメントの補給、腸内微生物叢の移植など、さまざまな治療法が実証されています。 BCFA、分岐鎖脂肪酸、FMT、糞便微生物叢移植、FOS、フラクトオリゴ糖、GOS、ガラクトオリゴ糖、ICA、インドール-3-カルボキシアルデヒドLTA(リポテイコ酸)、Med-diet(地中海ダイエット)、NF-κB(核因子κB)、SCFA(短鎖脂肪酸)、TLR2(Toll様受容体2)、MAPK(マイトジェン活性化プロテインキナーゼ)、TMA(トリメチルアミン)、TMAO(トリメチルアミンN-オキシド)、Uro B(ウロリチンB)。BioRenderで作成。Nagpal, R. (2025) (https://BioRender.com/heaxrmr) |
| 11.栄養と食事要素 |
| 腸内マイクロバイオームと腸の健康に影響を与える要因の中で、食事は最も重要な役割を果たします。生物学的老化は必然的に様々な生理学的および微生物学的変化をもたらしますが、いくつかの短期および長期の食事介入研究は、老化に関連する罹患率および死亡率を軽減する大きな可能性を示しています。例えば、長期かつ大規模な臨床研究(ClinicalTrials.gov 識別子 NCT01754012)では、地中海式の慎重な食事パターンとマイクロバイオームの調節を介した虚弱性の軽減との間に密接な関連性が示されました[56]。虚弱性の指標は、F.プラウスニッツィー、ローズブリア・ホミニス、ユーバクテリウム属 などの腸内常在菌の豊富さと負の相関関係にあることがわかった。一方で、これまで様々な病態生理(2型糖尿病、大腸がん、炎症性腸疾患など)と関連付けられていた潜在的な病原菌(ルミノコッカストルク、コリンセラ・エアロファシエンス、クロストリジウム・ラモスム、ベイヨネラディスパー)とは正の相関関係を示した。同様に、軽度認知障害のある高齢者を対象とした、修正地中海ケトン食(MkD)を用いた最近の介入試験(ClinicalTrials.gov 識別子 NCT02984540)では、腸内マイクロバイオームの調節を介して特定の微生物代謝物(プロピオン酸および酪酸の増加)に顕著な変化が見られ、糞便中のプロピオン酸および酪酸はアルツハイマー病バイオマーカーと負の相関関係にあった[8]。その後、前臨床モデルを用いて修正地中海ケトン食が腸内細菌叢-脳軸に及ぼす細胞・分子レベルでの影響を検証するメカニズム研究を進め、腸内細菌叢由来の乳酸レベルと、海馬インフラマソーム経路の調節を介して神経保護効果を媒介する乳酸受容体の発現が上昇することが明らかになった[57]。軽度認知障害のある前糖尿病成人を対象とした同様の修正地中海ケトン食摂取パターンを用いた別の介入研究(ClinicalTrials.gov identifier NCT02984540)でも、腸内細菌叢(アリスティペス属 CAG:514)やA. ムシニフィラなどの腸内細菌の影響を受けるγ-アミノ酪酸レベルの上昇に起因する有益な効果が報告されている[58]。 |
| 食物ポリフェノールは、抗酸化作用、抗炎症作用、神経保護作用でよく知られたもう一つの機能性食物成分であり、てんかん、パーキンソン病、がん、心血管疾患、糖尿病、神経変性プロセスなどの慢性疾患の予防・改善に効果があるとされています。ポリフェノールの構造の複雑さと糖化により小腸での吸収が低下し、治療効果が制限されるものの、大腸に蓄積されたポリフェノールは、結腸でのポリフェノール代謝によって生成される代謝物の抗菌作用やプレバイオティクス様作用を介して、腸内細菌叢の構成を調整することが分かっています。例えば、アントシアニン[59]やプロシアニジンB2[60]を多く含む食事を摂取すると、酪酸産生細菌が増加し、高齢げっ歯類モデルの加齢に伴う変化が緩和されることが知られています。さらに、特定のプロバイオティクスを補充したポリフェノール豊富な食事は、慢性の低度炎症を緩和し、それによって生物学的炎症を軽減し、50歳以上の成人の腸内マイクロバイオーム中のプロバイオティクス細菌と短鎖脂肪酸の増加を伴うことがわかった[61]。同様に、抗酸化物質が豊富なハーブである紅参は、酸化ストレスを軽減し、有益な腸内細菌分類群を促進することで、また腸内バリア強化に関連する代謝経路を通じて、抗老化効果をもたらす可能性がある[62]。特定のプロバイオティクス発酵高麗人参介入に関する研究でも、抗酸化活性に関連する特定の遺伝子の上方制御と腸内マイクロバイオームコミュニティの正の調整に起因する抗老化特性が実証されている[63]。したがって、繊維、一価/多価不飽和脂肪酸、ポリフェノールが豊富な、慎重でバランスのとれた食事パターンを順守すると、より健康な微生物叢を育むことによって、少なくとも部分的には、腸、心臓代謝、神経認知の健康に永続的な利点が得られるということが十分に立証されています。 |
| 12.プロバイオティクス、プレバイオティクス、シンバイオティクス |
| 新たなエビデンスは、特定のプロバイオティクス、プレバイオティクス、シンバイオティクスが腸の恒常性と機能を回復させることで、免疫、腸管、代謝の健康を高めることを示唆しています[64–66]。このエビデンスは、加齢した腸内環境において、これらのプロバイオティクス/プレバイオティクスが腸内細菌叢と上皮細胞の健康にプラスの効果をもたらすことも示唆しています。例えば、ビフィドバクテリウム・ロンガム株の特定のアルギニン生合成経路陽性遺伝子型(278、RG4-1、FJSWXJ10M2など)を投与することで、高齢マウスにおけるアルギニンフラックスの変動に関連する老化関連行動障害が軽減されたことが報告されています[67]。同様に、高齢マウスを用いた最近の研究では、ラクトバチルス(L.パラカゼイD3-5、L. ラムノサスD4-4およびD7-5、L. プランタラムD6-2およびD13-4)とエンテロコッカス(E.ラフィノサスD24-1、E. INBio D24-2、E. アビウムD25-1、D25-2、D26-1)株を含むヒト由来プロバイオティクスカクテルを投与したところ、特定の腸内有益細菌および常在細菌と微生物代謝産物が増加したことを報告しました[65]。これらの好ましい変化は、腸内上皮の完全性の改善およびインフラマソーム活性化の減少と相関しており、その後、短鎖脂肪酸やタウリンなどの代謝産物によって調節されることが明らかになりました[65]。同様の研究では、100歳以上の高齢者の糞便から分離された特定のプロバイオティクス株(L. ファーメンタムSX-0718、L. カゼイSX-1107、B. ロンガム SX-1326、B.アニマリス SX-0582)が、高齢マウスの腸管上皮の完全性を改善し、全身性炎症を軽減することが明らかになった[66]。さらに、特定のプロバイオティクス株は、腸管脳相関の調節を介して宿主の神経病理にプラスの影響を与えることも示されている。「サイコバイオティクス」として知られるこれらの株は、腸管脳相互作用を調節することで精神的健康を改善する可能性がある。サイコバイオティクスの補給による腸内微生物叢の調節を調査した最近のいくつかの研究では、特定の臨床症状と行動転帰の改善が報告されている。例えば、B. ビフィダムBGN4とB. ロンガム BORIを含むプロバイオティクスの摂取を検討した研究(CRiS: KCT0003929)では、炎症誘発性の腸内細菌叢とサイトカインを抑制し、抗炎症性の腸内細菌叢とサイトカインを促進し、海馬のシナプス可塑性と認知機能に重要な脳由来神経栄養因子(BDNF)を上方制御することで、高齢者(65歳以上)の全体的なメンタルヘルスが改善したことが報告されています[68]。臨床研究でも、プロバイオティクス介入と、食物繊維を分解し短鎖脂肪酸を産生する腸内細菌であるF. プラウスニッツィの個体数増加が、特に不安、うつ病、神経精神症状に関連するメンタルヘルスの改善に寄与したことが報告されています[69]。老化促進マウスモデルを用いた研究では、加齢とともに増加する潜在的な病原菌の個体数の減少や、プロバイオティクス混合物の投与後の腸管上皮および血液脳関門の透過性の改善といった、マイクロバイオームの肯定的な調節も報告されている[70]。 |
| 近年、プレバイオティクス(食物繊維、難消化性デンプン、ガラクトオリゴ糖/フラクトオリゴ糖など)も、腸内マイクロバイオームの構成と機能に総合的かつ有益な影響を与えることから、研究や公衆衛生の分野で注目を集めています。プレバイオティクスであるガラクトオリゴ糖の摂取は、加齢腸管において、糖分解細菌と酵素(β-ガラクトシダーゼ)の量を回復・増強し、腸上皮の完全性と粘液産生を改善することで、腸内恒常性を調節することが示されています[71]。さらに、難消化性デンプンにはプレバイオティクス効果をもたらすことが示されており、マイクロバイオームを正確に調節する可能性を示唆しています[72]。例えば、私たちの最近の研究では、難消化性デンプンが高齢マウスの腸内細菌叢とメタボロームに強い変化を引き起こすことを示しましたが、これらの変化のプロファイルは、異なる種類の食品源から抽出された特定の難消化性デンプンによって異なります [64, 73, 74]。また、加齢に伴う合併症を軽減するためのシンバイオティクスの組み合わせの相乗的および/または補完的な特性についても研究されています。臨床研究では、プロバイオティクス(B.アニマリス種ラクティス HY8002、L. カゼイ HY2782、およびL.プランタルム HY7712)とさまざまな食物繊維で構成されるシンバイオティクス製品MPRO3を摂取した高齢女性の血中代謝プロファイル、腸内細菌叢、および全体的な腸の健康に肯定的な変化が見られたことが報告されています [75]。これまでの研究は、ラクトバチルス属やビフィドバクテリウム属などの伝統的なプロバイオティクスが中心でしたが、A.ムシニフィラ、F.プラウスニッツィー、ルミノコッカス・ブロミー、アナエロブチリクム・ホールリイ、ローズブリア・インテスティナリスなど、次世代プロバイオティクス(NGP)として大きな可能性を秘めているとされる新たに発見された腸内常在菌の健康への有益な側面を探ることに関心が高まっています[76]。これらのうち、A. ムシニフィラとF. プラウスニッツィは特に注目すべき次世代プロバイオティクスとして浮上しており、加齢に伴う変性を軽減する役割を果たすと考えられています。研究によると、アルツハイマー病または軽度認知障害の患者はF. プラウスニッツィのレベルが低い傾向があり、健常者から分離されたF. プラウスニッツィを投与するとアルツハイマー病マウスモデルの認知障害が改善することが確認されています[77]。さらに、A. ムシニフィラとF. プラウスニッツィの両方の投与は、骨格筋の成長阻害因子であるミオスタチンを減少させることで、筋萎縮の症状を改善することが実証されています[78]。しかしながら、65歳以上の人口コホートにおいて、プロバイオティクス/プレバイオティクスを用いた複数のランダム化臨床試験が実施されているにもかかわらず、これらのサプリメントの正確な効果とメカニズムを理解するためには、特にマイクロバイオームの構成、定着抵抗性、そしてこれらの介入に対するマイクロバイオームの反応の個人差が大きいことを考慮すると、さらなる大規模な試験が必要であり、待たれています[79]。 |
| 13.ポストバイオティクス |
| プロバイオティクスとプレバイオティクスの健康効果に関する関心の高まりとメカニズムのエビデンスにより、近年、「ポストバイオティクス」と呼ばれる新たなバイオティクスの分類が出現しました。これは、健康効果をもたらす微生物の代謝物、細胞成分、および/または無傷だが生育不能な微生物(典型的にはプロバイオティクス)を指します[80]。プロバイオティクスの健康効果の多くは、細胞分画または代謝物を介してもたらされるため、生菌を介さずにこれらの成分を治療に使用することができます。例えば、私たちは最近、加熱殺菌したプロバイオティクス株L. パラカゼイD3-5から抽出した細胞壁成分リポテイコ酸(LTA)が、NF-κB阻害による炎症の軽減、およびTLR2-p38 MAPKシグナル伝達経路の活性化を介したムチン産生の促進による腸管上皮透過性亢進に十分であることを報告しました[10]。別の研究では、常在微生物叢によって分泌されるインドールまたはその誘導体であるインドール-3-カルボキシアルデヒド(ICA)が、おそらくはアリル炭化水素受容体を介した腸管細胞の高回転と杯細胞の濃縮を介して、老化関連の健康を改善するポストバイオティックな可能性を特定しました[81]。最近、エラジタンニン由来の腸内微生物代謝物であるウロリチンB(Uro B)は、HMGB1-TLR4-NF-κB経路のダウンレギュレーション、酸化ストレスの緩和、およびD-ガラクトース誘発老化モデルの腸内微生物叢の正の調整によって腸機能を改善することがわかりました[82]。特定のラクトバチルス・ロイテリ株の加熱殺菌した分泌成分と細胞表面タンパク質も、試験管内試験で腸上皮バリア機能とパソバイオームにプラスの効果をもたらすことがわかりました[83]。さらに、B.ロンガム株およびL. アシドフィルス株のティンダル化型は、運動介入と併用することで、アミロイドβ前駆体タンパク質(APP)遺伝子発現のダウンレギュレーションとミトコンドリア機能の改善により、アミロイドβ凝集体などのアルツハイマー病病態の改善に役立つことが最近明らかにされました[84]。これらの新たなメカニズム研究に基づき、ポストバイオティクスに関する今後の研究は、加齢関連疾患の予防・改善のための新規治療薬や補助的なヘルスケア製品の開発に向けた有望な道筋を提供することが期待されます。 |
| 14.マイクロバイオーム関連薬剤およびサプリメント |
| 抗生物質は腸内細菌叢の構成を乱し、微生物多様性を減少させることがよく知られていますが、特定の薬剤(例:メトホルミン)は、特に高齢者において、腸内細菌叢による代謝(または生体内変換)を通じて多面的効果を発揮する可能性があります[85]。例えば、我々は最近、老化マウスモデルを用いた研究で、メトホルミン投与がWntシグナル伝達とMuc2および杯細胞分化遺伝子(Spdef、Atoh、Gfi)の発現を抑制することで腸内ムチン産生を促進し、最終的に神経認知機能に影響を与えることを示しました[7]。同様の研究で、我々は特定の老化抑制薬、すなわちダサチニブとケルセチンが、高齢マウスにおいて抗炎症作用を促進し、炎症誘発性の腸内細菌叢を抑制することで、腸の老化と炎症を軽減することを示しました[9]。このような発見は、老化防止薬の抗老化効果が少なくとも部分的には微生物叢の調節を介して媒介される可能性があることを示唆しています。 |
| 栄養補助食品は、栄養素欠乏症や健康全般の改善を目的として広く利用されており、特に消化、代謝、免疫力の加齢による低下により欠乏リスクが高まる高齢者の間で広く使用されています [86]。しかし、最近の研究では、腸内微生物叢の調節がこれらの成分の抗老化効果の根底にある可能性があることが示されています。例えば、植物由来のα-リノレン酸(ALA)は、マウスの老化モデルにおいて抗血栓作用を示し、血小板過敏症を減少させることが示されました [87]。この研究では、α-リノレン酸を多く含む食事が微生物叢を調節し、酢酸濃度を回復させ、トリメチルアミン還元微生物(リケネラ_RC9_グループおよびインテスティニモナス属)の再定着とトリメチルアミン/トリメチルアミンN-オキシド関連微生物(デサルフォビブリオおよびクロストリジウム)の減少によって血漿トリメチルアミンN-オキシド濃度を減少させることが示されました [87]。さらに、ニコチンはNAD+経路を活性化し、NAD+恒常性のバランスを整えることで、加齢に伴う症状に影響を与えることが確認されています[88]。同様に、ニコチンアミドアデニンジヌクレオチド(NMN)の投与は、臓器や組織におけるNAD+レベルを維持することで、動脈硬化などの加齢に伴う疾患に有益な効果をもたらすことが示されています[89, 90]。これらの研究では、これらの抗老化効果におけるマイクロバイオームの役割は調査されていませんが、ニコチンアミドアデニンジヌクレオチドが腸内マイクロバイオームを調節することで腸内恒常性の維持に役立つことが知られていることは注目に値します。さらに、腸内マイクロバイオームは、哺乳類宿主には見られないNAD+代謝に寄与する独自の酵素活性を有していることから、ニコチンまたはニコチンアミドアデニンジヌクレオチドの抗老化効果は、腸内マイクロバイオームの変化と直接的または間接的に関連していると仮定されています。しかしながら、この潜在的な関連性を検証し、その知見を得るには、さらなる包括的、メカニズム的、およびトランスレーショナルな研究が必要です[91, 92]。 |
| 15.糞便微生物移植 |
| 糞便微生物移植(FMT)は、老化関連疾患の予防と治療のための新たな戦略です。再発性クロストリジウム・ディフィシル感染症や過敏性腸症候群(IBS)、クローン病、潰瘍性大腸炎などの疾患の治療に効果があるだけでなく、糞便微生物移植は健康的な老化と長寿を促進する可能性も示唆されています。例えば、ある研究では、糞便微生物移植は腸内微生物叢を調節し、短鎖脂肪酸の産生を促進することで、アルツハイマー病を患う高齢者の認知機能を改善することが明らかになっています[93]。前臨床研究では、糞便微生物移植治療により、高齢マウスにおいて短鎖脂肪酸濃度とムチン遺伝子の発現が促進され、老化に関連する神経学的欠損や炎症が改善されることが示されています[94]。その後の研究では、短鎖脂肪酸産生菌(B. ロンガム、クロストリジウム シンビオサム、F.プラウスニッツィー、L.ファーメンタム)の補給を通してこれらの結果が検証され、最終的にはボトムアップ(腸から脳への)シグナル伝達アプローチが脳卒中後の回復を促進することが示唆されました。また、長寿高齢者ドナーからの糞便微生物移植をマウスに移植すると、有益な細菌と代謝産物の産生が促進され、老化関連指標が改善されることも研究で実証されています[95]。これらのエビデンスに基づき、健康で長寿なドナーを用いて、特性が十分に解明された糞便微生物移植バイオバンクを開発するための体系的な研究は、老化に関連する健康障害を軽減するための効果的な治療法となる可能性があります。 |
| 16.今後の方向性 |
| 腸内マイクロバイオームと健康的な老化を関連付け、老年疾患における腸内細菌叢の乱れやバイオーム老化を示唆する研究は大きく進歩しているものの、特定の微生物分類群やマイクロバイオーム由来の代謝物が健康的な老化と長寿に果たす正確な役割は依然として不明瞭であり、特にこれらのマイクロバイオームの特徴が先天的なものなのか、それともライフスタイルによって形成されるものなのか、またどの特徴があるのかは依然として不明瞭である。個人差の影響を最小限に抑えながら、「健康な」マイクロバイオームを正確かつ個別に理解するには、バイオーム老化の軌跡を予測し、マイクロバイオームを標的とした介入を体系的に評価するために、多様な人口統計層を対象とした大規模な縦断的研究が必要である[2, 96, 97]。世界的な研究コンソーシアムや共同ネットワークを通じた包括的なマイクロバイオーム・バイオバンク・プロジェクトの設立と拡大は、多様な年齢層、健康な100歳以上の高齢者、多様なライフスタイルを持つ人々、そして地理的・社会経済的背景の異なる集団から、特性が明確にされた微生物サンプルの収集を加速させます。これにより、健康な老化や疾患状態に関連する普遍的かつ固有の微生物シグネチャーを特定するための強固な参照枠組みが提供されます。 |
| さらに、臨床研究では治療効果の評価にとどまらず、メタゲノミクス、メタボロミクス、メタトランスクリプトミクス、メタプロテオミクスといった高度なマルチオミクス技術を統合したメカニズム探究を組み込むことで、マイクロバイオーム由来の細胞・分子経路が細胞老化、炎症、代謝調節にどのように影響するかを解明する必要があります。これらの研究は、関連する実験動物モデル、特に無菌またはノトバイオートシステムを用いたメカニズム検証によってさらに強化されます。これらのモデルは、ヒトデータで特定された関連性の背後にある因果関係を検証するための強力なプラットフォームを提供します[98, 99]。これらの取り組みを支援し、規模を拡大するためには、人工知能(AI)や機械学習(ML)などの高度な計算手法を用いて、複雑なマイクロバイオームデータセットを臨床転帰、環境曝露、宿主の遺伝子プロファイルと統合する必要があります。これらのツールは、予測バイオマーカーの特定、主要な微生物叢と宿主の相互作用ネットワークのマッピング、そして個別化された治療戦略の設計能力を高めるでしょう。総合的に、これらの統合されたシステムレベルのアプローチは、トランスレーショナルリサーチを加速し、健康的な老化を促進し、健康寿命を延ばすマイクロバイオーム情報に基づいた臨床ソリューションへの道を開きます。 |
| 17.結論 |
| 老化生物学の研究は、老化の多面的な性質ゆえに、本質的に複雑です。細胞、分子、遺伝、エピジェネティックな因子が独立して、あるいは集合的に老化プロセスを駆動しますが、特に過去10年間は、老化と加齢関連疾患における腸内マイクロバイオームの直接的および間接的な役割を強調する説得力のある研究が急増し、有望なマイクロバイオームに基づく治療戦略の基盤を確立しました。マイクロバイオーム調節食、健康な若年者または100歳以上のドナーからの糞便微生物移植バイオバンク、そしてテーラーメイドプロバイオティクス/プレバイオティクス/ポストバイオティクスなど、革新的なマイクロバイオーム調節戦略は、生物学的老化を軽減する可能性を示しています。人工知能や機械学習を組み合わせた高度なハイスループットマルチオミクス技術の精度向上により、将来の研究は、腸内マイクロバイオームシグネチャーとバイオーム老化メカニズムの生物学的老化における関連性と因果関係を解明する上で有利な立場にあります。これらの知見は、健康寿命の延伸と無病長寿の実現に向けた取り組みに大きく貢献すると予想されます。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Genome Med. 2025 Jul 1;17:75.に掲載されたMicrobiome-based therapeutics towards healthier aging and longevity.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |