
Wenhui Lei et al., |
要約 |
| アルツハイマー病(AD)は、アミロイドβ(Aβ)プラーク、タウの過剰リン酸化、および慢性神経炎症を特徴とする進行性神経変性疾患です。ミクログリアおよびアストロサイトの活性化によって引き起こされる神経炎症は、長らくアミロイドβ病変に対する二次的な反応と考えられてきましたが、新たなエビデンスにより、認知機能低下の主な原因であることが示唆されています。特に、腸内細菌叢は、腸内細菌叢-腸管-脳軸(MGBA)を介して神経炎症の調節に重要な役割を果たしています。腸内細菌叢の乱れは、腸管バリアの完全性を破壊し、全身性炎症を促進し、神経炎症反応を増悪させ、アルツハイマー病の進行を加速させます。近年の進歩により、腸内細菌叢由来の代謝物(短鎖脂肪酸、リポ多糖など)が、ミクログリアの活性化とアミロイドβ凝集に直接影響を与えることが明らかになっています。これらの知見は新たな治療の可能性を切り開き、プロバイオティクス、プレバイオティクス、糞便微生物移植といった微生物叢を標的としたアプローチは、前臨床研究において神経炎症を軽減し認知機能を維持するという有望な神経保護効果を示している。しかしながら、これらの知見を臨床応用するには、ランダム化比較試験による更なる検証が必要である。本レビューでは、アルツハイマー病における腸内微生物叢に起因する神経炎症に関する分子メカニズムから潜在的な治療戦略まで、現在の知見をまとめる。腸内細菌叢-腸管-脳軸を標的とすることは、アルツハイマー病治療におけるパラダイムシフトであり、腸内微生物叢介入による神経炎症と病理学的進行の調節に重点が置かれている。本稿では、既存の研究課題にも触れ、この有望な分野を発展させるための今後の方向性についても概説する。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. アルツハイマー病病態における神経炎症の役割 |
| 2.1. アルツハイマー病における神経炎症のエビデンス |
| 2.2. アルツハイマー病における神経炎症の分子メカニズム |
| 2.2.1. サイトカイン |
| 2.2.2. 補体系 |
| 3. 腸内細菌叢が引き起こす神経炎症 |
| 3.1. 腸内細菌叢と腸内細菌叢-腸-脳軸 |
| 3.1.1. 腸内細菌叢の構成と機能的ダイナミクス |
| 3.1.2. 腸内細菌叢-腸-脳軸のメカニズム |
| 3.2. アルツハイマー病に関連する腸内細菌叢の変化 |
| 3.3. 腸内細菌叢-腸-脳軸を介した神経炎症 |
| 4. 腸内細菌叢を標的としたアルツハイマー病における神経炎症の緩和 |
| 4.1. プロバイオティクス |
| 4.2. プレバイオティクス |
| 4.3. シンバイオティクス |
| 4.4. ポストバイオティクス |
| 4.5. 糞便微生物叢移植(FMT) |
| 4.6. その他 |
| 5. 結論 |
| 本文 |
| 1.はじめに |
| アルツハイマー病は、主に高齢者に発症する慢性神経変性疾患であり、認知症の主な原因の一つです(1)。記憶喪失、認知機能の低下、行動の変化を特徴とします。現在、65歳以上の米国人約670万人がアルツハイマー病を患っており、2060年までに1,380万人に達すると予測されています(1)。アルツハイマー病および関連認知症の世界的有病率は、1990年から2019年の間に160.8%という驚異的な増加を記録し、この期間にほぼ3倍に増加しました。特に、年齢標準化有病率の上昇が最も顕著だったのは、ブルネイ、日本、韓国、シンガポールを含む東アジアおよび高所得のアジア太平洋地域です(2)。有病率の増加は、重度のアルツハイマー病患者が長期にわたるケアを必要とするため、大きな経済的課題をもたらします(3)。2015年には、認知症による世界の経済的負担は8,180億ドルと推定されました(4)。 |
| 「アミロイド仮説」は、ミスフォールドしたβ-アミロイド(Aβ)ペプチドがアミロイドプラークとタウタンパク質の沈着を引き起こし、神経原線維変化(NFT)につながると示唆しています。しかし、証拠は、これだけではアルツハイマー病を完全に説明できないことを示しています。アルツハイマー病患者における炎症の増加と、アルツハイマー病リスク遺伝子と免疫機能との関連性は、神経炎症が疾患進行の重要な因子であることを浮き彫りにしています(5)。神経炎症は、神経細胞の損傷によって引き起こされる中枢神経系(CNS)の炎症反応であり、当初はミクログリアやアストロサイトなどのグリア細胞を介して保護的な役割を果たします(6)。しかし、慢性的な損傷はグリア細胞の持続的な活性化につながり(7)、炎症性サイトカインや損傷分子の放出を引き起こし、それによって神経細胞の損傷を永続化させます(8)。 アルツハイマー病では、アミロイドβ蓄積によりミクログリアとアストロサイトが活性化し、活性酸素種(ROS)、一酸化窒素(NO)、サイトカイン(6)が放出され、神経炎症を悪化させるだけでなく、さらなるアミロイドβ沈着とタウ関連の神経原線維変化形成を促進します。 |
| 最近の研究では、腸内細菌叢がアルツハイマー病に関与していることが強調されており、腸内細菌叢の乱れは炎症誘発性代謝物を介して神経炎症と関連していることが示されています。腸内細菌叢-腸-脳軸は、腸と脳の間の恒常性維持に不可欠な双方向コミュニケーションネットワークです(9)。アルツハイマー病では、微生物叢の不均衡が有害な細菌の増殖を促進し、リポ多糖類(LPS)などの代謝物が血液-脳関門(BBB)を破壊し、脳炎症を引き起こします(10)。酪酸などの短鎖脂肪酸(SCFA)の産生低下は、慢性神経炎症を悪化させます(11)。さらに、腸内由来の代謝物はミクログリアを活性化し、神経炎症を増幅させ、アミロイドβプラークとタウタングルの蓄積を促進します(12)。 |
| 本レビューでは、アルツハイマー病における腸内細菌叢と神経炎症の相互作用を検証し、慢性的な神経炎症が疾患の進行を加速させる仕組みに焦点を当てています。腸内細菌叢とその代謝物が神経炎症プロセスの調節に果たす役割を探求し、腸-脳相関の重要性を明らかにしています。これらの相互作用を分析することで、本レビューは、腸内細菌叢-腸-脳相関を標的とした治療戦略が、神経炎症を軽減し、アルツハイマー病の進行を遅らせる可能性を強調しています。 |
| 2. アルツハイマー病の病態における神経炎症の役割 |
| アルツハイマー病の初期段階では、アミロイドβおよびタウタンパク質の蓄積がミクログリアおよびアストロサイトを活性化します。これらの細胞は、貪食によってこれらのタンパク質を除去することで保護的な役割を果たし、一時的に疾患の進行を遅らせます(13–15)。しかし、アルツハイマー病が進行するにつれて、これらのグリア細胞によるアミロイドβおよびタウの除去効率が低下し、その反応は脳にとってますます有害になります。その結果、これらのタンパク質が蓄積し、神経プラーク(NP)および神経線維芽細胞(NFT)が形成されます。アミロイドβおよびタウの持続的な蓄積は、ミクログリアおよびアストロサイトを慢性的に活性化し、サイトカイン、補体成分、神経毒性分子などの炎症誘発性メディエーターの放出を引き起こします。この継続的な神経炎症は、神経細胞の機能不全と細胞死をもたらし、アルツハイマー病の進行を加速させる悪循環を形成します(16)(図1)。 |
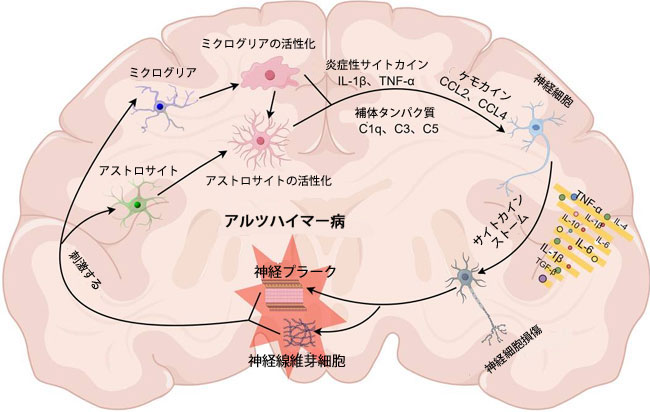 |
図1 アルツハイマー病における神経炎症とそのフィードバックループ。 脳損傷においては、アミロイドβやタウタンパク質などの病理学的シグナルが、休止期のミクログリアやアストロサイトを活性化する可能性があります。この活性化は、炎症性サイトカインの放出と補体系の活性化を引き起こし、神経細胞損傷の一因となります。その結果、損傷を受けたニューロンはより多くのアミロイドβとタウを放出し、それらの凝集を促進してアミロイドプラーク(NP)や神経原線維変化(NFT)を形成します。これらの病理学的産物は神経細胞損傷のシグナルとして作用し、神経変性をさらに悪化させる正のフィードバックループを引き起こします。 |
| 2.1. アルツハイマー病における神経炎症のエビデンス |
| アルツハイマー病における中枢神経系(CNS)の神経炎症は、ミクログリアとアストロサイトの複雑な相互作用によって特徴付けられます。中枢神経系細胞の約10%を占めるミクログリアは、常在マクロファージとして機能し、炎症誘発性(M1)状態と抗炎症性(M2)状態の間を移行することができます(17)。リポ多糖類やインターフェロンγ(IFN-γ)などの刺激によって活性化された炎症誘発性ミクログリアは、IL-1β、TNF-α、誘導性一酸化窒素合成酵素(iNOS)などの炎症誘発性サイトカインを放出し、慢性炎症を引き起こします。一方、抗炎症性ミクログリアは炎症の解決を支援し、免疫応答を制御し、そのサブタイプ(M2a、M2b、M2c)は炎症誘発性サイトカインの抑制に関与しています(18, 19)。アルツハイマー病において、神経炎症は疾患進行において重要な役割を果たします。例えば、Yan et al. はアミロイドβが終末糖化産物受容体(RAGE)に結合してミクログリアを活性化し、TNF-αやIL-6などのサイトカインの放出につながることが実証されています(20)。さらに、アミロイドβへの曝露は終末糖化産物受容体発現ニューロンを刺激し、マクロファージコロニー刺激因子(M-CSF)を産生させ、それが蓄積部位に末梢ミクログリアをリクルートします。これらのミクログリアはさらに、マイトジェン活性化プロテインキナーゼ(MAPK)経路やNF-κBなどの炎症性シグナル伝達経路を活性化し、それによって炎症反応を増幅させます(21)。アミロイドβはまた、NLRP3インフラマソームを活性化し、それがカスパーゼ-1の活性化とIL-1βの放出につながり、神経炎症を増悪させます(22)。さらに、タウ病理もPQBP1-cGAS-STINGシグナリングを介してミクログリアの活性化に寄与しています。 PQBP1の欠失は炎症と認知機能低下を悪化させ、神経炎症におけるタウの役割を浮き彫りにする(13)。アミロイドβとタウの病態はどちらも、ミクログリアの活性化と炎症経路の誘導に重要な役割を果たし、アルツハイマー病の進行を加速させる(23–25)。 |
| アストロサイトは中枢神経系で最も豊富なグリア細胞であり(脳容積の約25%を占める)、アルツハイマー病においても、特にアミロイドプラーク周辺で顕著に活性化する。アストロサイトは、中枢神経系の恒常性の維持、シナプス形成の補助、ニューロンへの栄養および神経栄養因子の供給、細胞外イオンバランスおよび血液-脳関門の完全性の調節に不可欠である(26, 27)。Wyss-Corayらは、アストロサイトが脳内のアミロイドβ沈着物を除去できることを実証した。しかし、アミロイドβプラーク周辺へのアストロサイトの蓄積は、反応性アストロサイトへの変化を誘発する可能性がある(28)。反応性サブタイプであるA1アストロサイトは、アルツハイマー病脳で発見されている。これらの細胞は恒常性維持機能を失い、ニューロンおよびオリゴデンドロサイトのアポトーシスに寄与し、神経炎症をさらに悪化させる(29)。さらに、A1アストロサイトは微小循環を阻害し、血液-脳関門を損傷することでアミロイドβの蓄積を促進し、疾患の進行を促進する(30, 31)。インテグリンαV/β1受容体を介したタウの内在化は、アストロサイトのNF-κBシグナル伝達を活性化し、炎症性メディエーターの発現を上昇させる。一方、ミクログリア由来のシグナルは、A1アストロサイトの分化をさらに促進する(32, 33)。このように、アルツハイマー病の進行には、ミクログリア炎症誘発性(M1)/抗炎症性(M2)分極の調節異常と、アストロサイトの恒常性状態から神経毒性状態への移行が関与している。ミクログリアとアストロサイトの相互作用は、自己永続的な炎症カスケードを形成し、神経損傷と認知機能低下を加速させる。 |
| 2.2. アルツハイマー病における神経炎症の分子メカニズム |
| アルツハイマー病では、神経炎症は自然免疫系の活性化によって引き起こされ、主にアミロイドβプラーク、タウタンパク質の病態、および補体系の調節異常によって媒介されます。アミロイドβおよびタウタンパク質の凝集は炎症性サイトカインの放出を刺激し、神経細胞障害を悪化させます。補体タンパク質はアミロイドβ沈着物と相互作用し、ミクログリアを動員してその除去を促進します。しかし、慢性的な補体活性化は、病的なシナプス刈り込みと神経毒性炎症につながる可能性があります。この炎症カスケードは、サイトカイン駆動型のフィードフォワードループによってさらに増幅され、神経変性を加速させます。結果として、アミロイドβ/タウ病態、補体活性化、およびサイトカインシグナル伝達の相互作用は、持続的な神経炎症とシナプス喪失を通じてアルツハイマー病(の進行を促進する自己永続的なサイクルを形成します。 |
| 2.2.1. サイトカイン |
| サイトカインは、アルツハイマー病における神経炎症の発生、進行、そして免疫クロストークの制御において極めて重要な役割を果たし、局所的な中枢神経系反応と全身的な免疫シグナル伝達の両方に影響を及ぼす(34)。TNF-αやIL-1βなどの炎症性サイトカインは、免疫細胞を活性化し、サイトカインカスケードを増幅させ、神経細胞損傷を誘導することで神経炎症を悪化させる。一方、IL-10などの抗炎症性サイトカインは、この炎症を相殺し、神経保護を促進する(35)。この繊細なバランスが崩れると、傍観者効果(炎症性メディエーターが隣接するニューロンを無差別に傷害する)などのメカニズムを通じて神経変性が加速される。 CXCL1、CCL2、CX3CL1などのケモカインは、アミロイドβプラークへの免疫細胞の走化性を誘導し、アミロイドの除去を助けるが、慢性活性化下では神経毒性を永続させる(17)。 |
| アルツハイマー病において、ミクログリアとアストロサイトは、TNF-α、IL-1β、IL-6、IL-2、IL-12、IFN-γなどのサイトカインの主な供給源であり、神経炎症カスケードを促進します(35)。炎症誘発性極性ミクログリアは、神経変性と強く関連する炎症性サイトカイン(IL-1β、TNF-α、IL-6など)の分泌と活性酸素種(ROS)の産生を介して炎症を悪化させます。対照的に、抗炎症性極性ミクログリアは、炎症誘発性メディエーターを抑制しながら抗炎症性サイトカイン(IL-10、IL-4、IL-13、TGF-β)を分泌することで炎症を緩和し、組織修復を促進します。炎症誘発性ミクログリアと抗炎症性ミクログリアの状態間の表現型シフトは、アルツハイマー病脳における炎症反応と修復プロセスのバランスを維持するために重要です。 Chen らによる 2,629 人の アルツハイマー病患者と 2,049 人の対照群を対象としたメタ分析では、アルツハイマー病患者の脳脊髄液 (CSF) 中の IL-1β、IL-6、IL-8、TNF-α、TGF-β、MCP-1 のレベルが対照群と比較して有意に高かったことがわかりました (36)。 |
| ケモカイン(訳者注:サイトカインの一種で、主に白血球を遊走させる(特定の場所に移動させる)活性を持つタンパク質のことです。炎症部位で大量に産生され、白血球を炎症組織に集めることで、免疫応答や炎症反応に関与します)は、ミクログリア細胞の神経炎症部位への遊走を制御し、炎症反応を増幅させることで、アルツハイマー病において極めて重要な役割を果たします。アルツハイマー病患者では、CCL2やその受容体であるCCR3、CCR5などのケモカインが反応性ミクログリア細胞で亢進し、免疫細胞の動員が増加して神経損傷がさらに悪化します。さらに、アミロイドβプラーク周囲のアストロサイトで発現するCCL4は、炎症プロセスにおけるグリア細胞相互作用の関与を強調しています。この慢性炎症環境は、アミロイドβやタウなどの毒性物質の蓄積を促進します。トランスジェニックマウスでは、CCL2の過剰発現によって神経炎症部位におけるミクログリア細胞の蓄積が増加し、炎症反応が悪化しました。この過剰発現は、アミロイドβ沈着の増加とも関連しており、アミロイドβ代謝とクリアランスに影響を及ぼすタンパク質であるアポリポタンパク質E(ApoE)レベルの上昇と関連している可能性があります(37、38)。これらの研究結果は、ケモカイン、炎症、アミロイドβ蓄積の複雑な関係を浮き彫りにし、ケモカインシグナル伝達を標的とすることが、アルツハイマー病の進行を遅らせる有望な治療戦略となる可能性があることを示唆しています。 |
| 2.2.2. 補体系 |
| 自然免疫の要である補体系(訳者注:生体内に侵入した病原体や異常な細胞を排除するために働く免疫システムのひとつです。約50種類のタンパク質が関与し、カスケード反応によって活性化され、病原体のオプソニン化、炎症の促進、細胞溶解など、様々な生体防御機能を担います)は、免疫監視とシナプスリモデリングを通じてアルツハイマー病病態に決定的に寄与しています(39)。古典経路、レクチン経路、あるいは代替経路を介して活性化される補体系は、炎症を増幅させ、病原体の除去を促進し、シナプス除去を媒介します。古典経路は、病原体またはアポトーシス細胞にC1qが結合することで開始され、プロテアーゼカスケードを誘導し、最終的にC3の沈着を引き起こします。C3の切断産物(C3b、iC3b)は、ミクログリア受容体を介して貪食を促進したり、膜侵襲複合体(MAC)を介して細胞溶解を誘導したりします(40)。補体系はまた、皮質ニューロンの移動(41)、中枢神経系の発達(42)、シナプス刈り込み(43)など、脳の発達もサポートしています。脳内ではミクログリアが主に補体タンパク質を産生し、アストロサイトも関与しています。補体系の調節異常は、様々な神経変性疾患と関連しています。成熟脳では、多くの疾患において早期のシナプス喪失が一般的であり、研究では、ニューロン喪失に先立って補体タンパク質の発現が亢進することが多いことが示されています(44)。これは、補体介在性シナプス除去の再活性化が疾患の進行に寄与する可能性があることを示唆しています。 |
| アルツハイマー病において、補体系の活性化はアミロイドβ沈着と密接に関連しています。C1q、C3(活性化型C3b、C3c、C3dを含む)、C4といった補体タンパク質は、これらのプラークを取り囲むグリア細胞によって産生され、疾患の進行に寄与します(40)。これらのタンパク質は、記憶に関連する脳領域のアミロイドβプラークや神経線維束(NFT)の近傍に多く見られ、補体活性化がこれらの病理学的特徴の持続と拡散を促進する可能性を示唆しています(43, 45)。補体成分が他の炎症経路と相互作用すると、炎症性サイトカインや毒性分子の産生を増加させる一連のイベントが引き起こされ、ニューロンへのさらなる損傷と認知機能低下の加速につながります(46)。 |
| したがって、神経炎症はアルツハイマー病の中核を成しており、アミロイドβとタウの蓄積によるミクログリアとアストロサイトの活性化によって引き起こされます。当初は保護的であったこれらの細胞は、最終的には炎症誘発性状態に移行し、神経損傷と認知機能低下を悪化させます。ミクログリアの炎症誘発性から抗炎症性への分極は、炎症と修復における二重の役割を示しています。神経毒性を持つA1アストロサイトはさらに炎症を増強し、神経細胞死と血液脳関門の破壊を引き起こします。炎症誘発性サイトカインと補体タンパク質は神経変性の重要なメディエーターであり、炎症サイクルを永続させます。これらの免疫経路を標的とすることで、疾患の進行を緩和する治療の可能性が示唆されます。今後の研究では、グリア活性化の背後にあるシグナル伝達機構を解明し、神経保護を維持しながら炎症を調節する治療法を開発する必要があります。 |
| 3. 腸内細菌叢が引き起こす神経炎症 |
| 近年の研究では、腸内細菌叢が健康全般と疾患予防において重要な役割を果たすことが強調されています(47~50)。腸内には、消化、代謝、免疫機能に寄与する細菌、真菌、古細菌、ウイルスといった多様な微生物の生態系が存在します。これらの伝統的な役割に加え、腸内細菌叢は脳や神経系にも影響を与え、特に神経精神疾患において顕著です。腸内細菌叢の変化は、アルツハイマー病などの神経変性疾患と関連付けられています。これらの微生物は、代謝産物の産生、免疫応答の調節、腸管バリアの完全性の維持など、様々なメカニズムを通じて神経炎症に影響を与えます。 |
| 3.1. 腸内細菌叢と腸内細菌叢-腸-脳軸 |
| 3.1.1. 腸内細菌叢の構成と機能的ダイナミクス |
| 腸内には、神経精神疾患のリスクに影響を及ぼす可能性のある多様な微生物叢が生息しています(51)。腸内細菌叢は約3.8×10¹³の微生物から構成され、これはヒト細胞の数とほぼ等しく、400万個以上の遺伝子を含んでいます。これはヒトゲノムの150倍に相当します(52, 53)。腸内には約1,000種の細菌と7,000株が存在し、フィルミクテス門とバクテロイデス門が最も優勢です(54)。腸内細菌叢は、代謝の調節、複雑な食物多糖類の分解、腸管運動の調整、腸管バリアの維持、脂肪分布への影響など、健康に重要な役割を果たしています。さらに、腸内細菌叢は、腸内細菌叢-腸-脳軸を介して中枢神経系と相互作用し、神経機能に影響を与え、アルツハイマー病やパーキンソン病などの神経変性疾患の一因となる可能性があります。新たな研究では、腸内細菌叢の構成は食事、ライフスタイル、さらには環境要因によっても影響を受け、細菌叢の多様性の変化は様々な神経学的および精神医学的疾患に関連していることが示されています。例えば、最近の研究では、ディスバイオーシス(細菌叢構成の不均衡)が腸管透過性の増加、いわゆる「リーキーガット」と呼ばれる状態につながる可能性があることがわかりました。これにより有害物質が血流に入り込み、全身性炎症を引き起こし、それが脳機能に影響を与え、自閉症スペクトラム障害や多発性硬化症などの疾患の一因となる可能性があります(55–57)。さらに、最近の研究では、微生物代謝物、特に酢酸、プロピオン酸、酪酸などの短鎖脂肪酸の役割が強調されています。これらは腸内細菌によって食物繊維の発酵中に生成され、顕著な抗炎症作用があることが示されています。短鎖脂肪酸は腸の健全性を維持するのに役立つだけでなく、中枢神経系における神経活動や免疫反応の調節に影響を及ぼすことで、脳機能の調節にも重要な役割を果たします(58, 59)。こうした知見を踏まえ、現在の研究では、腸内細菌叢の多様性と構成が腸と脳の健康にどのように影響するかを理解することにますます重点が置かれています。この知見は、腸内細菌叢の調節を通じて神経精神疾患の予防または治療を目的とした新たな治療法への期待を抱かせます。 |
| 3.1.2. 腸内細菌叢-腸-脳軸のメカニズム |
| 腸は、体全体で最大の免疫器官の一つであり、免疫細胞の70%以上を収容しているだけでなく、脳と同様の神経機能も有しています。腸内には多様な微生物が生息し、全身の健康に大きな影響を与える代謝副産物を産生します。近年の研究では、腸と脳の双方向コミュニケーションを支える複雑なメカニズム、すなわち腸-脳軸(GBA)が明らかにされています(60, 61)。このコミュニケーションは、生理学的恒常性の維持に不可欠な神経系、内分泌系、免疫系の経路を介して行われます。腸内細菌叢-腸-脳軸(MGBA)は、腸と脳の間の継続的な対話を表しており、自律神経系、神経内分泌系、迷走神経、免疫反応、腸内細菌叢によって産生される代謝物など、相互に関連したシステムが関与しています(62)。腸管神経系(ENS)はしばしば「第二の脳」と呼ばれ、双方向の腸-脳軸シグナル伝達における主要な統合ハブとして機能します。ニューロンとグリア細胞の稠密なネットワークで構成される腸管神経系は、末梢神経系の特殊化した半自律的な下位区分です(63, 64)。消化管に沿って分布する腸管神経系ニューロンは神経節叢を形成し、最も顕著なのは筋層間神経叢と粘膜下神経叢です(63–65)。これらの神経節叢は運動、分泌、吸収を制御して消化効率を確保し、腸内細菌叢の恒常性を維持します(66)。腸内細菌叢と中枢神経系の重要なインターフェースとして、腸管神経系は代謝物との直接的な相互作用、および腸内分泌シグナル伝達、免疫メディエーター、双方向迷走神経求心性神経を含む間接的な経路を通じて微生物シグナルに応答します(67)。この相互作用により、脳と腸の間の継続的なコミュニケーションが可能になり、腸内細菌叢はその調節において中心的な役割を果たしています。特に、腸内細菌叢は神経伝達物質の合成と神経調節に影響を及ぼし、腸と脳の間のシグナル伝達や、認知、感情の調節、ストレス反応といったより広範な脳機能に影響を与えます(68, 69)。 |
| 腸内細菌叢が、主に特定の代謝産物の産生を通じて、脳機能の調節に重要な役割を果たしていることを示す証拠が増えています。腸内細菌叢はまた、Toll様受容体(TLR)を介して免疫反応や腸内微小環境にも影響を与えます。Toll様受容体は微生物成分を検知し、腸管を越えて脳を含む他の臓器にまで及ぶ免疫反応を引き起こします。この免疫活性化は全身性炎症を引き起こす可能性があり、これはアルツハイマー病などの神経変性疾患の発症に関連するプロセスです(70)。動物実験、特にげっ歯類を用いた研究は、特定の腸内細菌叢が脳機能と免疫活動の両方にどのように影響するかについて貴重な知見をもたらしています(71, 72)。例えば、ビフィドバクテリウム・インファンティスは神経免疫反応を促進し、神経炎症から脳を保護することが示されています(73)。同様に、ラクトバチルス・カゼイ、アナプラズマ・フラギリス、ストレプトコッカス・サーモフィラスの菌数増加は、脳活動と認知機能にプラスの影響を与えます(74–76)。一方で、フソバクテリウム・レクタム、ポルフィロモナス・ジンジバリス、ラクトバチルス・ラムノサスといった特定の病原細菌は、アルツハイマー病の発症に関与していることが示唆されており、脳の健康に悪影響を及ぼす可能性を示唆しています(77, 78)。これらの知見は、腸内細菌叢が神経変性疾患と脳機能に重要な影響を及ぼすことを明らかにし、腸内細菌叢の調節が脳の健康改善と関連疾患の管理のための潜在的な治療戦略となる可能性を示唆しています(9, 79, 80)。 |
| 3.2. アルツハイマー病に関連する腸内細菌叢の変化 |
| 腸内細菌叢はアルツハイマー病の病態形成において重要な役割を果たしています。近年の研究では、腸内細菌叢の乱れがアルツハイマー病、肥満、糖尿病、神経精神疾患など様々な疾患と関連していることが示されています(81~83)。この不均衡は正常な微生物生態系を破壊し、不適切な代謝産物や有害な副産物の生成につながり、中枢神経系を含む全身の健康に悪影響を及ぼす可能性があります。アルツハイマー病においては、腸内細菌叢の乱れが認知機能低下の一因となることが示されており、アルツハイマー病の発症と進行の両方において中心的な役割を果たしていることが示唆されています(11, 84)。 |
| アルツハイマー病患者の腸内細菌叢に関する研究では、健常者と比較して大きな違いが見られています。例えば、Vogtらは、フィルミクテス属の減少、シアノバクテリアの増加、有益なビフィズス菌の減少など、細菌組成の変化を発見しました。これは、アルツハイマー病においてより炎症性の微生物叢へとシフトしていることを示唆しています(85)。さらに、研究では、アルツハイマー病患者は腸内細菌叢の多様性が低く、炎症誘発性細菌が増加し、有益な菌種が減少することが示されています(84、86、87)。Lingらも、フェカリバクテリウム属の減少と、ラクトバチルス属およびビフィズス菌の増加を観察しており、これらの変化がアルツハイマー病で見られる神経炎症に寄与している可能性を示唆しています(11)。さらに、軽度認知障害(MCI)の患者と進行期アルツハイマー病の患者の間では細菌叢の構成に違いが見られ、病気の進行に伴って細菌叢が徐々に変化することを示唆しています(87)。この進行は、腸内細菌叢の変化がアルツハイマー病の特徴であるだけでなく、病気の初期段階や進行についての洞察も提供できることを示唆しています。 |
| 腸内細菌叢の乱れは、免疫老化、サイトカインの不均衡、神経炎症を促進することで、アルツハイマー病の初期病態に寄与すると考えられています(88)。例えば、Cattaneoらは、大腸菌/赤痢菌などの炎症誘発性細菌の増加と、腸内細菌科などの抗炎症性細菌の減少が、アミロイドプラークの蓄積と炎症反応の亢進と相関していることを発見しました(84)。酪酸を産生する腸内細菌などの有益な腸内細菌の減少は、アルツハイマー病における炎症状態をさらに悪化させます。動物実験では、アルツハイマー病マウスでは酪酸産生細菌のレベルが低く、酪酸、プロピオン酸、酢酸などの短鎖脂肪酸が減少することが示されています(89, 90)。これらの短鎖脂肪酸は、エネルギー産生、免疫調節、腸内恒常性維持に不可欠です(91)。 短鎖脂肪酸産生障害は、アミロイドプラークの蓄積、代謝機能障害、ミクログリア細胞の障害につながり、これらはすべて認知機能の低下を加速させます (92–94)。 |
| さらに、酪酸産生細菌の減少は炎症誘発性細菌の増加を伴うことが多く、局所炎症と全身炎症の両方を引き起こし、神経炎症をさらに悪化させます (95)。 この微生物相の変化は、T細胞機能の変化、腸管透過性の増加、細菌の転座にも関連しています (96, 97)。 これらの変化は、リポ多糖などの炎症誘発性物質が血流に入りやすくなり、全身炎症を引き起こし、血液-脳関門を破壊して神経炎症を激化させます (98)。 さらに、腸内細菌叢の多様性の低下は、トリプトファンとセロトニンのレベルを変化させ、ドーパミンや脳由来神経栄養因子(BDNF)などの重要な脳分子の産生に影響を及ぼす可能性があります (96, 99, 100)。 全体として、これらの微生物の不均衡はアルツハイマー病の神経変性プロセスに重要な役割を果たしており、腸内細菌叢の乱れは病気の進行と神経炎症に密接に関連しています。 |
| 3.3. 腸内細菌叢-腸-脳軸を介した神経炎症 |
| 近年の研究で、炎症性腸疾患(IBD)患者におけるアルツハイマー病リスクの上昇が明らかにされています。1,742人の炎症性腸疾患患者と17,420人の健常者を対象とした台湾の研究では、炎症性腸疾患患者の5.5%が認知症を発症したのに対し、健常者ではわずか1.4%でした(101)。この有意差は、腸の炎症が脳の炎症に影響を与える可能性を示唆しています。この関連性の重要な要因は、腸管血液バリアの破壊です。研究により、オクルディンやゾヌラ・オクルデンス-1(ZO-1)などのタイトジャンクションタンパク質がアルツハイマー病動物モデルで減少し、腸管透過性が高まることが示されています(102–105)。この破壊により、有害な細菌代謝物が血流に入り込み、中枢神経系に影響を与え、アルツハイマー病の発症に寄与する可能性があります。 |
| 腸内細菌叢は、リポ多糖、アミロイド、トリメチルアミンN-オキシド(TMAO)など、さまざまな微生物副産物を生成します。バクテロイデス・フラギリスや大腸菌などのグラム陰性細菌はリポ多糖を分泌します(106, 107)。これが破壊されたり、外膜小胞から放出されたりすると、腸-血液関門が損傷する可能性があります(108)。この損傷はE-カドヘリンなどの細胞間タンパク質に影響を与え、リポ多糖が循環血中に侵入することを可能にします。血流に入ると、リポ多糖は血液-脳関門を通過し、炎症誘発物質が中枢神経系に侵入するリスクが高まります。アルツハイマー病患者の海馬、大脳皮質、血漿では、健常者と比較してリポ多糖レベルが上昇していることがわかっています(109)。リポ多糖は免疫原性が高く、ニューロンに対して強力な炎症誘発作用を引き起こします(110)。 アルツハイマー病では、リポ多糖への曝露によってミクログリア上のToll様受容体が活性化され、CD14やMD-2などのタンパク質との相互作用を通じて炎症反応が誘発されます。CD14によって活性化されるTLR4受容体は、脳のアミロイドβに対する反応において重要な役割を果たします(111, 112)。この炎症カスケードは免疫反応を調節するだけでなく、神経炎症を悪化させ、アルツハイマー病の進行を加速させます。 |
| 最近の研究では、バクテロイデス・フラギリス由来のリポ多糖(BF-LPS)が、アルツハイマー病に関連する神経炎症経路を活性化することが明らかになっています。バクテロイデス・フラギリス由来のリポ多糖は、ヒト脳細胞においてNF-κBシグナル伝達経路を著しく活性化することが示されており、これがアルツハイマー病に関連する神経炎症に寄与する炎症カスケードを引き起こします(113)。アミロイドプラーク中のリポ多糖の存在は、微生物由来のリポ多糖とアミロイドβが相互作用し、神経炎症反応をさらに強めることを示唆しています(114)。アルツハイマー病においては、大腸菌由来のリポ多糖が、記憶と学習に不可欠な海馬や大脳皮質などの重要な領域で検出されています。これらの領域は、リポ多糖の存在により、特に神経炎症による損傷を受けやすい領域です(115)。動物実験ではこれらの知見が確認されており、リポ多糖注射は学習と記憶を含む海馬依存性の認知機能を障害することが示されています。また、リポ多糖の反復投与は、海馬におけるアミロイドβ蓄積とプラーク形成の増加につながります(116)。さらに、マウスの第四脳室へのリポ多糖注射は、ミクログリア活性化や神経機能障害など、アルツハイマー病で見られるものと同様の炎症反応や脳変化を引き起こします。リポ多糖はまた、脳内および血流中の両方で、IL-1β、IL-6、IL-10、TNF-αなどの炎症性サイトカインのレベルを高めます(117)。これらのサイトカインは、アミロイドβ産生に重要なステップであるβアミロイド前駆体タンパク質(β-APP)の発現を促進し、βセクレターゼ1(BACE1)の活性を高めることでアルツハイマー病に寄与します(118)。さらに、リポ多糖はミクログリア内のNLRP3インフラマソームを活性化し、IL-1βやIL-18などの炎症性サイトカインの処理を促進し、神経炎症とアミロイドβ凝集をさらに増幅させます(119、120)。この炎症カスケードは追加の免疫細胞を動員し、アルツハイマー病の進行を加速させます。最近の研究では、腸管由来リポ多糖の強力な炎症誘発作用および神経毒性作用も明らかにされており、腸-脳軸がアルツハイマー病の病態において重要な役割を果たしていることが示唆されています。腸管由来リポ多糖が培養ヒトニューロンに及ぼす神経毒性作用は、神経変性プロセスへの潜在的な寄与を示唆しています(121, 122)。 |
| リポ多糖に加えて、大腸菌、枯草菌、サルモネラ菌、結核菌、黄色ブドウ球菌など、様々な腸内細菌が、ミスフォールドしたアミロイドβオリゴマーや繊維を産生することでアミロイドタンパク質の蓄積に寄与しています(123, 124)。このプロセスは、アルツハイマー病の病態において重要な役割を果たしている可能性があります。アミロイドは、組織に沈着する不溶性のタンパク質を豊富に含む凝集体で、細菌間のバイオフィルム形成を促進し、凝集体の形成と物理的および免疫的刺激に対する抵抗力を高めます。細菌性アミロイド、特に腸内にみられるアミロイドは、免疫系を活性化し、脳内でのアミロイド沈着の形成につながる可能性があります(124)。これは免疫反応をさらに増幅させ、神経炎症の一因となる可能性があります。微生物由来アミロイドの研究は依然として進行中ですが、Frizzledなどの一部の細菌タンパク質は、プリオン様メカニズムを介して脳内のアミロイドβ蓄積に影響を与える可能性があります。これらのメカニズムは、脳と末梢の両方で炎症反応を引き起こします。さらに、腸内の細菌アミロイドは免疫系を刺激し、脳内の内因性ニューロンアミロイドに対する反応を増強する可能性があります(124)。病原体関連分子パターン(PAMP)として、これらの細菌アミロイドはTLR2、NF-κB、CD14などの経路を刺激することで自然免疫系を活性化し、最終的に神経炎症を引き起こします。この免疫活性化のカスケードは、アルツハイマー病の進行をさらに悪化させる可能性があります(125)。 |
| 腸内細菌叢由来の代謝産物であるトリメチルアミンN-オキシドは、アルツハイマー病の発症に重要な役割を果たしている(126)。アルツハイマー病認知症患者の脳脊髄液(CSF)中のトリメチルアミンN-オキシド濃度は、健常者と比較して上昇していることが観察されている(127)。こうしたトリメチルアミンN-オキシド濃度の上昇は、リン酸化タウタンパク質、タウ対アミロイドβ(Aβ42)比、総タウタンパク質やニューロフィラメント軽鎖タンパク質などの神経変性マーカーなど、主要なアルツハイマー病バイオマーカーと相関している(127)。さらに、アルツハイマー病モデルとして一般的に用いられる野生型マウスとAPP/PS1トランスジェニックマウスの両方において、トリメチルアミンN-オキシド濃度は加齢とともに上昇する(128)。トリメチルアミンN-オキシドは、脳内のアミロイドβ蓄積を促進する酵素であるβセクレターゼの活性を高めることで、認知機能低下やアルツハイマー病の進行に寄与する。さらに、トリメチルアミンN-オキシドは細胞内カルシウムイオンを放出することで血小板の過敏性を促進し、これはアルツハイマー病関連の神経炎症および血管変化と関連しています(129)。このことから、トリメチルアミンN-オキシドはアミロイド病理に影響を与えるだけでなく、アルツハイマー病の血管および炎症性因子にも寄与している可能性が示唆されます。 |
| 循環細菌によって産生される胆汁酸(BA)は、アルツハイマー病におけるアミロイドβ産生の増加と関連付けられています。胆汁酸は内皮細胞間のタイトジャンクションを障害することで血液-脳関門を破壊し、胆汁酸と末梢コレステロールの両方が中枢神経系(CNS)へ侵入することを促進する可能性があります(130)。一旦侵入すると、コレステロール値の上昇はアルツハイマー病の病態において極めて重要な役割を果たします。コレステロールはアミロイド前駆体タンパク質(APP)に結合し、アミロイド前駆体タンパク質の処理に関与する特殊な膜ミクロドメインである脂質ラフトへの統合を促進します。この相互作用は、βセクレターゼによるアミロイド前駆体タンパク質の切断を促進し、アミロイドβ産生の増加につながります(131)。さらに、胆汁酸は脳のコレステロール除去機構を阻害し、コレステロールの蓄積をさらに促進する可能性があります。この蓄積はアミロイドβ形成を促進し、コレステロールの調節異常とアルツハイマー病の進行を関連付けています。このように、胆汁酸はアミロイドβ産生だけでなく、毒性のあるアミロイドβ凝集体の形成を促進するプロセスにも寄与しています。 |
| 免疫系は腸内細菌叢の形成に重要な役割を果たし、その構造、組成、機能に影響を及ぼします (132)。この調節は、宿主の免疫系と相互作用する微生物共生者からのフィードバックによって駆動され (133, 134)、腸の恒常性を維持し、神経炎症や老化などのより広範なプロセスに影響を及ぼします。齧歯類モデルの研究では、腸内細菌叢の変化が免疫応答や神経炎症にどのように影響するかが示されています (135–138)。例えば、Boehme らは、若齢および中年マウスの腸内細菌叢を修正すると、中年マウスにおけるストレス誘発性の免疫活性化が逆転し、脳内の Ly-6Chi 単球(老化に関連する神経炎症のマーカー)の浸潤が減少することを発見しました。これは、細菌叢が局所的な免疫応答に影響を及ぼすだけでなく、脳の健康と老化に影響を与える全身プロセスにも影響することを示唆しています (139)。 |
| 炎症反応は、免疫細胞がパターン認識受容体(PRR)を介して病原体関連分子パターンおよび微生物関連分子パターン(MAMP)を検出すると開始されます。腫瘍細胞やアポトーシス細胞などの宿主細胞も、損傷関連分子パターン(DAMP)を放出します。損傷関連分子パターンはパターン認識受容体によって認識され、免疫系を活性化します。この活性化は、マクロファージやマスト細胞などの免疫細胞による炎症性サイトカインおよびケモカインの産生を誘発し、しばしば補体活性化を伴います。樹状細胞とマクロファージは、主要組織適合抗原複合体(MHC)分子を介して局所免疫細胞に抗原を提示し、T細胞を含む適応免疫系を活性化して標的反応を開始します(12)。炎症が持続すると、エフェクターT細胞を含む追加の免疫細胞が組織に浸潤し、炎症を悪化させ、慢性炎症状態の一因となります。慢性神経炎症は神経変性疾患と関連しており、脳の健康維持には免疫バランスが重要であることが示唆されています。 |
| 上記の証拠は、腸内細菌叢とその代謝物が中枢神経系内の炎症プロセスに影響を及ぼす上で重要な役割を果たし、ひいては神経炎症とアルツハイマー病の進行に影響を及ぼすことを強調しています。腸管血液関門の破壊により、リポ多糖、胆汁酸、トリメチルアミンN-オキシド、アミロイドなどの有害な微生物代謝物が脳に漏れ出し、神経炎症に重要な役割を果たします。この炎症によりアミロイドプラークとタウタングルの蓄積が促進され、それが今度は神経機能を阻害し、アルツハイマー病の進行を促します。腸内細菌叢、免疫反応、脳の健康の関係性をより深く理解することで、特に腸内細菌叢を標的としてアルツハイマー病の発症と進行を遅らせたり予防したりする新たな治療法が開拓される可能性があります(図2)。 |
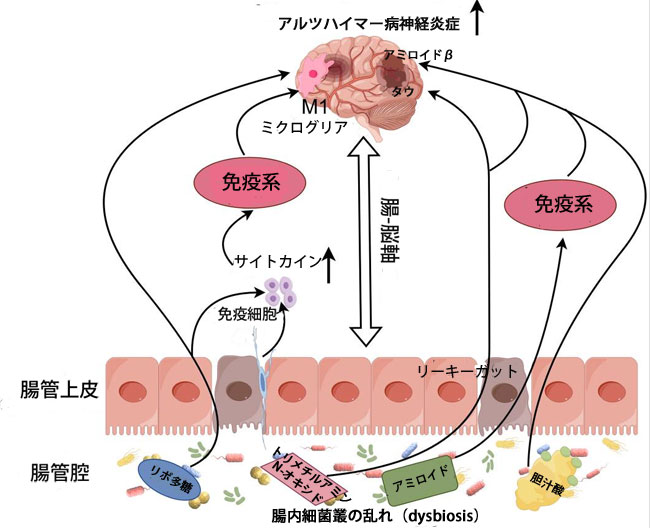 |
図2 アルツハイマー病(AD)における神経炎症における腸内細菌叢の乱れ(dysbiosis)制御機構を示す模式図。 アルツハイマー病では、腸内細菌叢の乱れが免疫反応を誘発し、リポ多糖(LPS)、アミロイド、胆汁酸(BA)、トリメチルアミンN-オキシド(TMAO)などの有害代謝物の産生を促進する。これらの代謝物は腸粘膜バリアの完全性を破壊し、リポ多糖が全身循環に入ることを可能にする。これは全身性炎症を促進し、腸内細菌叢-腸-脳軸(MGBA)を介してミクログリアを活性化する。さらに、アミロイド蓄積は免疫系の活性を高めることで神経アミロイドプラークの形成を促進する。胆汁酸およびトリメチルアミンN-オキシドレベルの上昇は脳内アミロイドβ濃度の上昇と関連しており、トリメチルアミンN-オキシドとタウ病理の相互作用は神経炎症をさらに激化させ、脳におけるアルツハイマー病の進行に寄与する可能性がある。 |
| 4. 腸内細菌叢を標的としたアルツハイマー病における神経炎症の緩和 |
| 腸内細菌叢は、アルツハイマー病の病態形成における神経炎症の重要な調節因子であることが、新たなエビデンスによって確立されています。腸-脳軸の双方向コミュニケーションネットワークは、微生物群集と中枢神経系の恒常性を結びつける重要なインターフェースとして機能します。この軸を標的とした現在の治療法としては、プロバイオティクス、プレバイオティクス、シンバイオティクス、ポストバイオティクス、そして糞便微生物叢移植(FMT)などが挙げられます。これらの介入は、微生物の恒常性を回復させ、腸管バリアの完全性を強化し、全身性および神経免疫応答を調節することで有益な効果を発揮し、アルツハイマー病関連の病理学的プロセスを改善する可能性があります(表1)。臨床応用には依然として課題が残っていますが、微生物製剤の最適化と治療戦略の個別化によって、アルツハイマー病に対する新たな疾患修飾療法が実現する可能性があります。 |
| 表1.腸内細菌叢を標的にしてアルツハイマー病における神経炎症を軽減する |
 |
 |
 |
 |
 |
 |
| 4.1. プロバイオティクス |
| プロバイオティクス、特に乳酸菌とビフィズス菌は、腸の健康をサポートする生きた微生物であり、免疫調節、ストレス耐性、病原体阻害、腸管バリア機能の改善など、様々な効果をもたらします(103、140~142)。BALB/cマウスモデルにおいて、B. ロンガムの補給は認知能力を向上させ、NOR試験やバーンズ迷路試験などの課題における成績向上によって実証されました(143)。L.スピナリス、B.ブレーベA1、L.カゼイ シロタなどの他のプロバイオティクスは、ラットにおいてアミロイド前駆体タンパク質(APP)代謝を促進し、記憶力を高め、アミロイドβレベルを低下させ、神経炎症を軽減することが示されており、これはアルツハイマー病の進行抑制に重要です(144~146)。クロストリジウム ブチリカムもまた、APP/PS1マウスにおいて認知機能の低下を抑制し、アミロイドβ蓄積を減少させると同時に、ミクログリアの活性化と炎症性サイトカインの産生を抑制することが示されています(147)。さらに、プロバイオティクスは視床下部-下垂体-副腎(HPA)系を調節し、ストレス下における神経細胞の活性化を回復させる働きがあり、海馬におけるc-Fosおよび脳由来神経栄養因子の発現増加に表れています(148)。アッカーマンシア・ムシニフィラは、ムチンを酵素分解して短鎖脂肪酸とオリゴ糖を生成することで、炎症反応を緩和し、免疫機能を高めます。短鎖脂肪酸の放出は腸管透過性をさらに低下させ、腸管バリアの完全性を強化し、腸全体の健康を促進します(149)。 |
| 複数のプロバイオティクス株を組み合わせることで、単一株の介入よりも大きな効果が得られる場合が多い。例えば、Hangらは、プロバイオティクス-2(P2;B. ラクチスおよびL. rラムノサス)とプロバイオティクス-3(P3;B. ラクチス、L. アシドフィルス、L. ラムノサス)を6ヶ月齢のSAMP8マウスに投与したところ、アルツハイマー病様認知障害が有意に改善したことを実証した。この介入は同時に、神経細胞へのダメージを軽減し、アミロイドβおよびタウタンパク質の病理学的沈着を減少させ、海馬および大脳皮質における神経炎症反応を弱めた(150)。8種類のグラム陽性菌株をブレンドしたVSL#3は、アルツハイマー病モデルにおいて腸内細菌叢の有益な変化を促進し、長期記憶の改善、炎症の軽減、神経可塑性の増強をもたらす(151)。同様に、9種類の細菌株を混合したSLAB51は、トランスジェニックアルツハイマー病マウスにおいて脳損傷、アミロイドβ蓄積、アミロイドプラーク形成を減少させることが示されています(152)。L. カゼイ、L. アシドフィルス、B. ラクチス、B. ビフィダムを組み合わせたプロバイオティクス-4は、高齢マウスにおいて記憶力を改善し、神経損傷を軽減し、腸管および血液脳関門を保護しました。また、IL-6やTNF-αなどの炎症マーカー、ならびに血漿および脳内のLPS濃度を低下させました(153)。同様に、L. アシドフィルス、L. ファメンタム、B. lラクチス、B. ロンガムを組み合わせたものは、アミロイドβ1-42を注入したラットの学習能力を向上させ、酸化ストレスを軽減しました。これは、アルツハイマー病治療におけるプロバイオティクスの組み合わせの可能性を示唆しています(154)。 |
| プロバイオティクスは、腸内細菌叢-腸-脳軸(MGBA)に作用してアミロイドの蓄積を除去し、神経炎症を軽減する可能性があるため、アルツハイマー病の潜在的な治療薬として注目を集めています。動物モデルでは有望な結果が示されている一方で、アルツハイマー病患者を対象とした臨床試験では一貫性のない結果が出ています。一部の研究では、プロバイオティクスの補給後にミニメンタルステート検査(MMSE)のスコアが上昇するなど、認知機能が改善したと報告されています(155)。例えば、進行期アルツハイマー病患者20名を対象とした臨床試験では、特定のプロバイオティクス混合物(L. ラクチス W19、L.パラカゼイW20、L. アシドフィルスW22、L.アリアリウスW24、L. カゼイW56、L. プランタルムW62、B. ビフィダム W23、B. lラクチス W51、B. ラクチスW52を含む)を4週間投与したところ、腸の炎症マーカーである糞便中のゾヌリン濃度が大幅に低下しました。この介入は、抗炎症細菌であるフェカリバクテリウム・プラウスニッツィーの濃度を上昇させ、ネオプテリンやキヌレニンなどの炎症マーカーの血清値を上昇させたことから、マクロファージおよび樹状細胞に対する免疫調節作用を示唆しています(156)。さらに、軽度から中等度のアルツハイマー病患者90名を対象とした12週間の二重盲検プラセボ対照試験では、2つの異なる単一菌株プロバイオティクス(L. ラムノサスHA-114またはB. ロンガム R0175)の投与により、被験者の平均ミニメンタルステート検査スコアが有意に改善することが示されました(157)。さらなる研究では、健康な高齢者における予防効果が示されています。例えば、B. ビフィダムBGN4とB. ロンガムBORIを含むプロバイオティクスを12週間補給したところ、腸内炎症性細菌の減少、精神的柔軟性、ストレスパフォーマンスの改善、神経可塑性に関連するタンパク質である脳由来神経栄養因子の血清値の上昇が見られました(158)。しかし、プロバイオティクスがアルツハイマー病に影響を及ぼす正確なメカニズムは依然として不明です。いくつかの試験では、混合プロバイオティクス療法は、特に重度のアルツハイマー病患者において、認知機能や生化学的マーカーを有意に改善しないことが示されています。例えば、B. アニマルスを含む発酵乳製品の研究では、糞便サンプル中の細菌組成や遺伝子発現に顕著な変化は見られず、プロバイオティクス効果の一貫性に疑問が生じています(159)。これらの矛盾した結果は、プロバイオティクスが腸内微生物機能に影響を与える可能性がある一方で、必ずしも微生物叢の組成や認知機能に有意な変化をもたらすわけではないことを示唆しています。アルツハイマー病の予防または治療に最も効果的なプロバイオティクス株とメカニズムを特定するには、さらなる研究が必要です。 |
| 4.2. プレバイオティクス |
| プレバイオティクスは、腸内細菌の増殖を促進する化合物であり、様々な食品に含まれています(160, 161)。これらは認知機能の改善や、アルツハイマー病などの神経変性疾患の管理に関連しています。例としては、難消化性デンプン(RS)、イヌリン、オリゴ糖(例:フラクトオリゴ糖[FOS]やアルギン酸)、ガラクトース、オリゴキシルロースなどが挙げられます(162)。研究によると、難消化性デンプンは酪酸の産生を促進し、腸の健康を維持し、炎症を軽減する可能性があることが示唆されています(163)。フルクトースとアルギン酸は、短期記憶を改善し、アミロイドβ蓄積によって引き起こされるアストロサイトの増殖を抑制することで、認知機能を高めることが示されています。特にフラクトオリゴ糖は、アルツハイマー病の動物モデルにおいて、腸内細菌叢の多様性を高め、ニューロンを保護し、アルツハイマー病の病態に関連するあアミロイドβ1-42とタウタンパク質のレベルを低下させるという有望な効果が示されています(164)。 フラクトオリゴ糖はGLP-1/GLP-1受容体経路を調節し、神経保護効果をもたらす可能性もある(165)。5×FADマウスを用いた研究では、マンナンオリゴ糖はラクトバチルスなどの善玉菌の増殖を促進し、ヘリコバクターなどの悪玉菌の増殖を抑制し、腸管および血液脳関門を強化することが示された。その結果、アミロイドβ蓄積の減少、酸化還元バランスの回復、そして脳の主要領域における酪酸濃度の上昇が認められた(166)。同様に、マリンダオリゴ糖はアルツハイマー病モデルにおいて記憶力の改善、プラーク形成の減少、酸化ストレスおよび炎症の緩和を示した(164, 167)。 |
| ヒトを対象とした研究は継続中ですが、プレバイオティクスの補給は高齢者において、特に炎症や免疫反応に影響を与えるサイトカイン遺伝子の発現を調節する上で、潜在的な可能性を示しています(168)。1,837人の参加者を対象とした研究では、食事中の果糖摂取量が1g増加するごとに、アルツハイマー病リスクが24%低下することが示され、フラクトオリゴ糖のようなプレバイオティクスが高齢者の臨床的アルツハイマー病リスクの低減に役立つ可能性が示唆されています(169)。 |
| 4.3. シンバイオティクス |
| シンバイオティクスは、Gibson とRoberfroidによって提唱されたプロバイオティクスとプレバイオティクスの組み合わせです(170)。シンバイオティクスは2つのタイプに分類されます。1つはプロバイオティクスとプレバイオティクスの単純な混合物である相補的シンバイオティクス、もう1つはプレバイオティクスが特定のプロバイオティクスの増殖を促進する相乗的シンバイオティクスです(171)。その目的は、プロバイオティクスが消化管内で生存し、両方の成分の利点を最大限に引き出すことです(172)。シンバイオティクスは、プロバイオティクスまたはプレバイオティクス単独よりも効果的な健康効果をもたらすことがよくあります(173–176)。研究によると、シンバイオティクスは腸内細菌叢を整え、炎症を軽減し、腸管バリア機能を改善することで、アルツハイマー病の神経保護効果をもたらすことが示唆されています。例えば、ニコチンアミドモノヌクレオチド(NMN)、ラクチプランチバチルス・プランタルム CGMCC 1.16089、ラクツロースを含むニコチンアミドモノヌクレオチドシンバイオティクスは、APP/PS1マウスモデルの大脳皮質と海馬におけるアミロイドβ沈着を減少させました。また、結腸の健康状態の改善、杯細胞の回復、Claudin-1やZO-1などのタイトジャンクションタンパク質の増加が認められ、腸管バリアの強化、炎症性サイトカインおよび酸化ストレスの減少が見られました(173)。遺伝子組み換えアルツハイマー病であるDrosophila melanogasterを用いた別の研究では、L. プランタルム NCIMB 8826、L.フェルマトゥスNCIMB 5221、B. ロンガム spp. インファンチス NCIMB 702255をポリフェノール豊富な植物抽出物と組み合わせたシンバイオティクス配合により、生存率、運動性、アミロイドβ沈着の減少、アセチルコリンエステラーゼ活性の改善が認められました(174)。さらに、イヌリンとプロバイオティクス(納豆菌、コアグランス菌、L. カゼイ菌、L. アシドフィルス菌、B. ロンガム菌、B. ブレーベ菌など)を組み合わせた補完的なシンバイオティクスは、アルツハイマー病マウスの記憶力や神経新生を改善し、アミロイドβ42 レベルと神経炎症を減少させた(175)。 |
| シンバイオティクスに関するヒト臨床研究は限られているものの、有望な結果がいくつか確認されています。79名のアルツハイマー病患者を対象とした研究では、12週間にわたりセレン200 mgと特定のプロバイオティクスを補給したところ、ミニメンタルステート検査スコアの上昇で示されるように認知機能と代謝機能が改善され、炎症と酸化ストレスマーカーが減少したことが示されました (176)。高齢のアルツハイマー病患者にプロバイオティクス発酵ケフィアミルクを使用した別の研究では、記憶力、言語能力、実行機能などの認知機能に有意な改善が見られ、炎症、酸化ストレス、血球損傷が減少しました (177)。まだ初期段階ではありますが、これらの研究は、シンバイオティクスがアルツハイマー病患者の認知機能と全体的な健康状態を改善するための有望なアプローチとなる可能性を示唆しています。神経保護とアルツハイマー病管理におけるシンバイオティクスの治療効果を完全に理解するには、さらなる臨床研究が必要です。 |
| 4.4. ポストバイオティクス |
| ポストバイオティクスは、炎症性疾患の治療に有望なアプローチであり、プロバイオティクスの利点を、生きた微生物のリスクなしに提供します。そのため、特に免疫力が低下している人に適しています(178)。ポストバイオティクスの主要成分には、繊維発酵中に生成される短鎖脂肪酸と、腸管と中枢神経系の両方に影響を及ぼす神経活性物質が含まれます。これらの物質は、動物とヒトの認知機能と行動機能を調節する可能性があります(179, 180)。 |
| 短鎖脂肪酸は、炭素原子数が2~6の脂肪酸で、主にバチルス属、ビフィドバクテリウム属、クロストリジウム属などの大腸の細菌によって産生されます(181, 182)。短鎖脂肪酸はGタンパク質共役受容体(GPCR)を活性化し、TNF-α、IL-1、IL-6などのサイトカインの放出など、免疫反応と炎症反応を制御するシグナル伝達経路を誘導します。特に酪酸は、アルツハイマー病マウスモデルにおける認知機能の改善に大きな期待が寄せられています(183)。酪酸はヒストン脱アセチル化酵素(HDAC)阻害剤として、ヒストンの脱アセチル化を抑制し(184)、パターン認識受容体、キナーゼ、転写調節因子、サイトカイン、ケモカインをコードする遺伝子の発現を抑制します(185, 186)。同時に、酪酸はクロマチンアクセシビリティを高め、アリルハイドロカーボン受容体(AhR)-リガンド複合体が標的遺伝子プロモーター内の調節エレメントに結合できるようにします(187)。これによりAhRが活性化され、炎症性サイトカイン(IFN-γ、IL-6、IL-12、TNF-α、IL-7、IL-17など)の発現が抑制され、微生物の移行と組織線維化が抑制されます。また、抗炎症性サイトカイン(IL-10、IL-22)の誘導、抗菌ペプチドの刺激、腸管上皮修復の促進によって粘膜保護が強化されます(185, 188)。 |
| アルツハイマー病においては、臨床研究および前臨床研究の両方において、短鎖脂肪酸、特に酪酸が疾患の様々な段階で重要な役割を果たすことが示されています(189, 190)。免疫系において、短鎖脂肪酸は好中球およびリンパ球の遊走に影響を与え、Treg細胞の産生を促進し、T細胞の活性を調節します(96, 191, 192)。また、好中球の動員やTNF-αなどの炎症性メディエーターの産生にも影響を与えます(191, 193)。短鎖脂肪酸は、オクルディンなどのタイトジャンクションタンパク質を増加させることで血液-脳関門(BBB)を強化し、バリアの完全性を改善します(194, 195)。酪酸は、特に認知機能と免疫機能の向上に効果的であることが示されています(196, 197)。 |
| 腸内細菌叢は、腸と脳のコミュニケーションや脳機能に影響を与える神経伝達物質や神経調節物質の産生においても重要な役割を果たしています (68, 69, 198)。腸内細菌はトリプトファンやチロシンなどのアミノ酸を代謝して神経伝達物質の前駆体を産生し、これが免疫機能やT細胞の分化に影響を及ぼします (199, 200)。大腸菌、乳酸菌、サッカロミセス・セレビシエなどの細菌株は、γアミノ酪酸、セロトニン(5-HT)、ドーパミンなどの神経伝達物質を産生し、これらは感情、ストレス、気分、認知機能を調節します。これらの神経伝達物質の不均衡は、精神衛生に影響を与える可能性があります (201)。これらの神経伝達物質は血流に入り、ミクログリアの活性化に影響を及ぼすことで脳機能に影響を及ぼす可能性があります (202)。さらに、一部の腸内細菌は、ニューロンの成長に不可欠な脳由来神経栄養因子を調節します (203)。これは腸と脳の複雑なつながりを浮き彫りにし、神経疾患や精神疾患の治療法の可能性を示唆しています。 |
| 4.5. 糞便微生物叢移植(FMT) |
| 糞便微生物叢移植(FMT)は、厳選されたドナーの糞便を患者の消化管に移植し、腸内細菌叢の多様性と機能を回復させる治療法です。アルツハイマー病など、腸内細菌叢の不均衡に関連する炎症性疾患の治療に有望性を示しています(204, 205)。研究によると、糞便微生物叢移植はアミロイドβ沈着、タウタンパク質形成、記憶障害、ミクログリア活性化といった主要なアルツハイマー病の特徴を軽減し、神経炎症バイオマーカーも低下させることが示唆されています。そのメカニズムには、抗炎症作用、アミロイドβ蓄積の調節、シナプス可塑性の改善、短鎖脂肪酸の産生増加などが含まれます(90, 206–210)。APP/PS1トランスジェニックマウスモデルなどの動物モデルにおいて、健康なマウスを用いた糞便微生物叢移植は認知機能の改善、アミロイドβおよびタウタンパク質レベルの低下、シナプスタンパク質発現の増加を示しました。炎症誘発性ミクログリアおよびシクロオキシゲナーゼ-2(COX-2)が減少し、短鎖脂肪酸産生細菌が増加しました(90)。同様に、ADPLAPTトランスジェニックモデルにおいて4ヶ月間毎日糞便微生物叢移植を実施したところ、認知機能の改善、アミロイドβおよびタウの減少、活性化ミクログリア、アストロサイト、炎症マーカーの減少が認められました(207)。5×FADマウスなどの家族性アルツハイマー病モデルでは、糞便微生物叢移植によってアミロイドプラークが減少し、認知機能が向上しました(210)。糞便微生物叢移植はまた、炎症性サイトカインの発現を抑制し、IL-10、IL-22、IL-2、TGF-βなどの抗炎症性サイトカインの発現を増強しました。しかし、アルツハイマー病患者の腸内細菌叢は腸内NLRP3の発現と末梢炎症マーカーを増加させ、認知機能の低下を悪化させました。これは、アルツハイマー病由来の細菌叢が炎症を促進する可能性があることを示唆しています(209)。 |
| 動物実験は有望ではあるものの、臨床的エビデンスは限られています。ある症例報告では、再発性クロストリジウム・ディフィシル感染症に対する糞便微生物叢移植を受けたアルツハイマー病患者が認知機能の改善を示したと報告されています(211)。また別の症例では、アルツハイマー病とクロストリジウム・ディフィシル感染症を患う90歳の女性が、健康なドナーからの糞便微生物叢移植を受けた後、認知機能とマイクロバイオームの多様性が改善しました(212)。これらの良好な結果が得られているにもかかわらず、糞便微生物叢移植がアルツハイマー病の有効な治療法であることを確認するには、さらなる研究が必要です。 |
| 4.6. その他 |
| フェノール化合物、ポリフェノール、タンニン(PPT)は微生物の代謝に影響を与え、神経系の健康に潜在的な効果をもたらします。これらの生理活性化合物は、脳の恒常性維持に不可欠なニューロンとグリア細胞の相互作用を制御します。また、タンニンは血流を促進し、栄養素と酸素の供給を改善するとともに、代謝老廃物の除去を促進し、神経毒や炎症からニューロンを保護するため、神経変性疾患の治療効果が期待されます(213, 214)。 |
| 食物性フラボノイドの主要成分であるフラバン-3-オールは、フリーラジカルの除去、金属のキレート化、酵素活性の調節により神経系の健康をサポートします。抗炎症作用を有し、酸化ダメージを軽減します(215)。吸収後、フラボノイドは腸内細菌叢によってフェノール酸や代謝産物に代謝され、脳に蓄積します。これらの代謝産物はアミロイドβペプチドの自己組織化を阻害し、アルツハイマー病などの神経変性疾患における毒性のあるアミロイドの凝集を防ぎます(216)。また、フラボノイドは血液脳関門を通過し、ミクログリア細胞の活性化を抑制し、TNF-αやIL-1βなどの炎症性サイトカインを減少させることで、より健康的な神経環境を促進します(217, 218)。 |
| フラボノイドの一種であるアントシアニンは、炎症を調節し、神経保護作用を有します。炎症性サイトカインを調節し、神経炎症経路を阻害します(219)。高齢マウスを用いた研究では、ブルーベリーのアントシアニンが認知機能を改善し、記憶力を高め、老化や神経変性に伴う炎症を軽減することが示されています(220)。ヒト臨床試験では、これらの知見をさらに裏付け、血漿中の炎症マーカーの減少が示され、認知機能低下の危険因子である慢性炎症の緩和に潜在的な効果があることが示唆されています(221)。 |
| このように、プロバイオティクス、プレバイオティクス、ポストバイオティクス、糞便微生物叢移植、その他の生理活性化合物を介して微生物叢を調節することは、アルツハイマー病と神経炎症を管理するための有望なアプローチとなります。前臨床研究と臨床研究の両方で、腸と脳の複雑な関係が強調され、これらの介入がアミロイドβ蓄積や認知機能低下などのアルツハイマー病関連の病理をどのように軽減するかが示されています。しかし、研究の多くは動物モデルに基づいており、これらの結果をヒトで確認するにはさらなる臨床試験が必要です。今後の研究では、神経保護効果を持つ特定の微生物株と代謝物を特定し、送達方法を最適化することに焦点を当て、アルツハイマー病の個別化治療法の開発を目指します。腸内細菌叢-腸-脳軸(MGBA)を理解することは、アルツハイマー病の予防と治療のための革新的な戦略につながり、罹患した人々の生活の質を向上させる可能性があります(図3)。 |
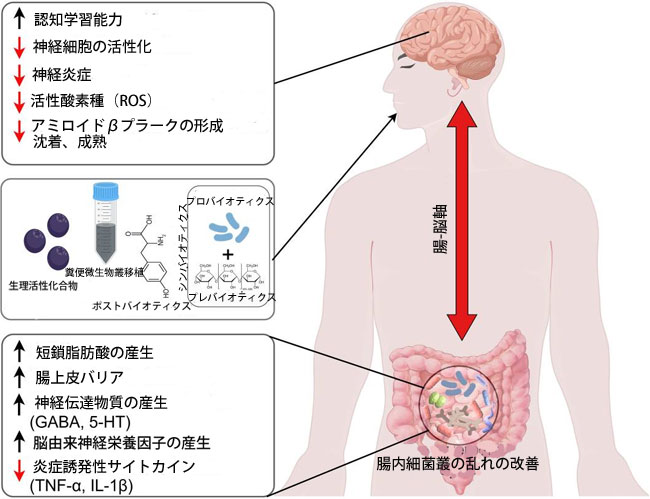 |
図3. アルツハイマー病神経炎症における腸内細菌叢の治療可能性を示す模式図。 腸内細菌叢を標的とした介入(プロバイオティクス、プレバイオティクス、シンバイオティクス、ポストバイオティクス、糞便微生物叢移植など)は、アルツハイマー病患者によく見られる腸内細菌叢の不均衡を回復させることが示されています。これらの介入は、短鎖脂肪酸の産生増加、腸粘膜バリア機能の改善、炎症誘発因子レベルの低下、腸内神経伝達物質の増強に関連しています。腸内細菌叢の乱れを是正し、脳腸相関を調整することで、これらの治療法はアルツハイマー病の神経病理学的状態を改善することが示されています。これは、認知機能の向上、神経細胞の活性化の低下、アミロイドβおよびタウタンパク質レベルの大幅な低下に反映されており、最終的にはアルツハイマー病関連の神経炎症の緩和に役立ちます。 |
| 5. 結論 |
| 本レビューは、腸内細菌叢に起因する神経炎症がアルツハイマー病において重要な役割を果たしていることを強調し、この相互作用がアミロイドβタンパク質やタウタンパク質の蓄積、グリア細胞の活性化といった疾患メカニズムにどのように寄与するかを明らかにしています。ミクログリアとアストロサイトの持続的な活性化は、神経変性を促進する慢性的な炎症環境をもたらします。腸内細菌叢の乱れと神経炎症の間に新たに現れた関連性は、神経炎症と認知機能低下の両方を引き起こすことが示されていることから、有望な治療機会を示唆しています。前臨床研究では、プロバイオティクス、プレバイオティクス、ポストバイオティクス、糞便微生物叢移植の可能性が示唆されていますが、臨床的有効性はまだ証明されていません。今後の研究は、神経保護作用のある微生物株と代謝物の特定、送達方法の改良、そして個別化治療の開発に焦点を当てるべきです。腸内細菌叢-腸-脳軸(MGBA)のより深い理解は、アルツハイマー病治療に革命をもたらし、発症の予防または遅延、生活の質の向上、そして医療負担の軽減といった新たな方法を提供する可能性があります。神経炎症のメカニズムと腸内細菌叢の動態に関する知見を統合することが、この壊滅的な病気と闘うための、より的を絞った効果的な治療戦略を開発する鍵となります。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Front Immunol. 2025 Jun 26;16:1582119.に掲載されたGut microbiota-driven neuroinflammation in Alzheimer's disease: from mechanisms to therapeutic opportunities.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |