
Boobalan Thulasinathan et al., |
要約 |
| がんは、細胞機能と免疫機能の不均衡を伴う長期的な疾患です。環境中の発がん物質への曝露、不健康な食生活、感染症、遺伝子変異など、さまざまな要因によって引き起こされる可能性があります。腸内細菌叢を健全に保つことは、全身の健康にとって極めて重要であり、腸内細菌叢によって産生される短鎖脂肪酸(SCFA)はこのプロセスにおいて重要な役割を果たします。最近の研究では、腸内細菌叢の変化が結腸腔における短鎖脂肪酸の産生低下につながり、腸管上皮バリア機能と免疫の変化と関連し、大腸がん(CRC)の発生と進行に密接に関連していることが明らかになっています。短鎖脂肪酸は、DNAメチル化、ヒストン修飾、非コードRNA機能などのエピジェネティックメカニズム(訳者注:エピジェネティックとは、DNAの塩基配列を変化させることなく、遺伝子の働きを制御する仕組みのことです)を変化させることでがんの進行に影響を与え、腫瘍の発生と転移に作用します。これは、腸内細菌叢の調節を通じて大腸内の短鎖脂肪酸レベルを回復させることが、大腸がんの予防と治療における革新的な戦略となる可能性を示唆しています。本レビューでは、腸内細菌叢と大腸がんの重要な関係性に焦点を当て、短鎖脂肪酸を標的とすることで腸内環境を改善し、大腸がんリスクを低減できる可能性を強調しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. プロバイオティクス菌の代謝産物としての短鎖脂肪酸の役割 |
| 3. 腸の健康における食物繊維、腸内細菌叢、短鎖脂肪酸の役割 |
| 4. 短鎖脂肪酸による腸管恒常性維持への影響 |
| 5. 大腸がんの発がんにおけるエピジェネティック制御における短鎖脂肪酸の役割 |
| 6. 短鎖脂肪酸と大腸がんにおける免疫恒常性 |
| 7. マイクロサテライト不安定性腫瘍細胞における酪酸の抗腫瘍効果 |
| 8. 脳-腸軸と短鎖脂肪酸の影響を受ける免疫応答におけるホルモンおよび神経メディエーターの役割 |
| 9. 大腸がん治療における短鎖脂肪酸の医学的応用 |
| 10. 結論と今後の展望 |
| 本文 |
| 1.はじめに |
| 大腸がんは世界中で重大な健康課題となっており、医療制度、患者、そして地域社会に多大な経済的影響を与えています。これらの影響には、直接的な医療費、生産性の低下、そしてストレスや生活の質の低下といった目に見えない影響が含まれます[1]。 スクリーニングプログラムの改善による早期発見の促進、治療抵抗性を克服するための戦略の開発、副作用の管理、そしてケアの格差の縮小が不可欠です。個別化医療、免疫療法、支持療法の進歩は有望ですが、これらの治療法を普及させるには、継続的な研究、投資、そして継続的なコミットメントが必要です。現在利用可能な治療法は大腸がん患者の治癒には効果がなく、しばしば毒性を引き起こします。大腸がんの治療課題に対処するには、多面的なアプローチが必要です。これらの課題に取り組むことで、大腸がん患者の転帰と生活の質を向上させることができます。腸内細菌叢は、絶えず進化する多種多様な微生物から構成されており、健康の維持と疾患の転帰に重要な役割を果たしています[2]。いくつかの研究では、腸内細菌叢が炎症性腸疾患(IBD)[3]、糖尿病[4]、アテローム性動脈硬化症[5]、大腸がん[6–8]など、さまざまな慢性疾患の進行に大きな影響を与える可能性があることが実証されています。腸内細菌叢の構成と、短鎖脂肪酸などのその代謝産物は、大腸がんの病因に大きく寄与していることが明らかになっています[9]。腸内細菌叢によって生成される多くの代謝産物の 1 つである短鎖脂肪酸は、大腸がんに対する潜在的な影響についてますます認識されています。腸内細菌叢がこれらの疾患に影響を及ぼすメカニズムを理解することで、予防および治療介入の新たな道が開かれます。同時に、食事、プロバイオティクス、プレバイオティクス、および糞便細菌叢移植(FMT)などの高度な治療法を通じて腸内細菌叢を調整することで、健康状態を改善し、これらの複雑な疾患を管理できる可能性が期待されています[10]。 |
| 短鎖脂肪酸には酢酸 (60%)、プロピオン酸 (20%)、酪酸 (20%) などがあり、主に腸内細菌叢による食物繊維やその他の難消化性炭水化物の発酵によって生成されます[11]。このプロセスには、炭水化物を短鎖脂肪酸に変換するために異なる代謝経路を利用する複雑な微生物群が関与しています (図 1)。酢酸は 2 つの異なる経路で生成されます。最初の経路では、酢酸はアセチル CoA 経路によって生成され、アセチル CoA が酢酸に変換されます。酢酸は、バクテロイデス属、ビフィドバクテリウム属、クロストリジウム属、ルミノコッカス属などの幅広い嫌気性細菌によって生成されます[12]。一方、酢酸生成細菌がアセチル CoA を変換するために利用するウッド・ユングダール経路は、アセチル CoA を酢酸に変換する役割を担っていません。このプロセスでは、二酸化炭素が還元されて一酸化炭素が生成され、これが補酵素Aおよびメチル基と結合してアセチルCoAを生成します。このアセチルCoAは酢酸生成の前駆体として機能します[13]。プロピオン酸の生成は、コハク酸経路、アクリル酸経路、プロパンジオール経路という3つの主要な経路によって行われます。コハク酸経路は、バクテロイデス属、プレボテラ属、アリスティペス属、ルミノコッカス属、ディアリスター属、アッカーマンシア属によって一般的に利用され、コハク酸からメチルマロニルCoAおよびプロピオニルCoA中間体を経てプロピオン酸に変換されます。アクリル酸経路は、クロストリジウム属、メガスファエラ属、コプロコッカス属によって利用され、乳酸からアクリル酸に変換され、その後プロピオン酸に変換されます。プロパンジオール経路は、ロゼブリア、ユーバクテリウム、ブラウティア、ラクノスピラ科の菌種によって利用されており、ラムノースやフコースなどのデオキシ糖をプロピオン酸に変換する経路です[14]。酪酸は主にブチリルCoA経路によって生成されます。酪酸を主に生産する菌種には、クロストリジウム、フェカリバクテリウム、ユーバクテリウム、ロゼブリア、ブチリビブリオの菌種が含まれます。酪酸は2分子のアセチルCoAから合成され、中間体としてブチリルCoAが形成され、これが酪酸に変換されます[15]。 |
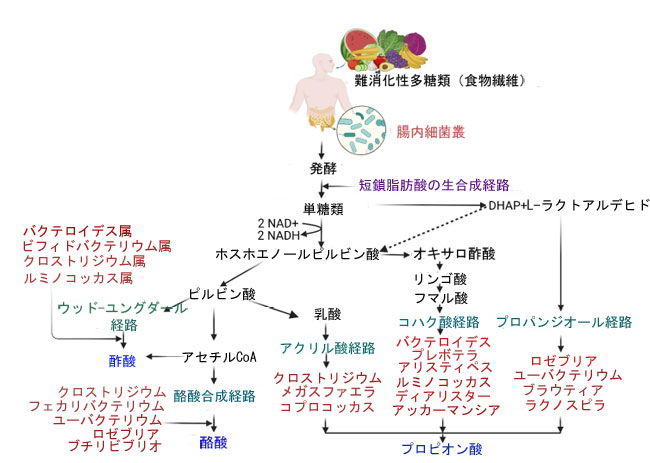 |
| 図1. 腸内細菌叢による難消化性食物繊維と炭水化物の発酵から得られる短鎖脂肪酸の生合成経路 |
| 主要な短鎖脂肪酸には、ウッド-ユングダール経路またはアセチルCoAから生成される酢酸、2つのアセチルCoA分子から形成される酪酸、そしてホスホエノールピルビン酸からアクリル酸経路またはコハク酸経路、あるいはプロパンジオール経路を経て生成されるプロピオン酸が含まれる。 |
| 短鎖脂肪酸の生合成は、複数の微生物経路が関与する複雑なプロセスであり、様々な食事要因や環境要因の影響を受けます[9]。 これらの経路を理解することで、食事介入やプロバイオティクス療法が短鎖脂肪酸の産生をどのように調節し、大腸がんを含む様々な疾患にどのような影響を与えるかについての知見が得られます。しかしながら、表1に示すように、まだ十分に理解されていない潜在的な研究ギャップがあり、その探求が必要です。本レビューでは、腸内細菌叢によって産生される短鎖脂肪酸と大腸がんの関係に関する最近の研究から得られた最新のエビデンスをまとめています。 |
| 表1.短鎖脂肪酸と大腸がんの関係を理解する上で重要なギャップ |
 |
| 2. プロバイオティクス菌の代謝産物としての短鎖脂肪酸の役割 |
| プロバイオティクスは、消化機能のサポート、免疫システムの強化、そして精神的および代謝的な健康への潜在的なメリットを通じて、健康全般の維持・増進に重要な役割を果たします。プロバイオティクスは腸管上皮細胞や免疫細胞に直接作用し、抗炎症作用や細胞保護作用を持つ短鎖脂肪酸などの活性代謝物を放出します[16]。これらの相互作用は、炎症性腸疾患や過敏性腸症候群などの症状を特徴とする、慢性で衰弱性の胃腸疾患(GI)の緩和に役立ちます[17]。特定のプロバイオティクス菌株は、げっ歯類モデルとヒトの両方において、肥満/2型糖尿病[18]、壊死性腸炎[19]、炎症性腸疾患、自己免疫疾患など、様々な疾患を予防または治療する可能性があることが示されています[20,21]。しかし、これらの効果の背後にあるメカニズムは完全には解明されていません。それにもかかわらず、プロバイオティクスサプリメントの需要は過去10年間で大幅に増加し、消費者市場向けの新しいプロバイオティクス製品が急速に開発されました。プロバイオティクスと腸の健康とのつながりを探ったプロバイオティクスの健康効果に関する研究のほとんどは、動物モデルまたは既存の健康問題を抱える人間に焦点を当てており、健康で病気のない個人に対するプロバイオティクスの効果についてはあまり研究されていません。Hemarajataら[22]は、プロバイオティクスが腸内細菌叢を正に調整することを報告しました。しかし、健康な宿主におけるプロバイオティクスの腸内細菌叢と短鎖脂肪酸スペクトルへの影響は、個人差、研究デザインの制限、メカニズムのために、議論の的となっています[23]。短鎖脂肪酸は、核因子κB(NF-κB)シグナル伝達経路を阻害することで、免疫と炎症の進行に影響を及ぼすことが知られています。さらに、短鎖脂肪酸依存性のNFkB阻害は、細胞周期停止とがん細胞のアポトーシスを誘導することにより、がん細胞(多くの場合NFkBシグナル伝達が恒常的である[24])にも影響を及ぼします[25]。短鎖脂肪酸は腸管バリアの完全性の維持にも寄与し、酪酸レベルの上昇は腸管上皮のタイトジャンクションを強化する可能性があります[26]。 |
| 消化できない炭水化物を腸内細菌叢が発酵させることで生成される酪酸は、宿主の健康に重要な役割を果たします[27]。特に、酪酸生成を担う腸内細菌叢には性別による違いがあることが研究で明らかになっています[28]。ある研究では、オスとメスのラットにオリゴフルクトースを多く含む食事を摂取させたところ、異なる短鎖脂肪酸プロファイルが見られました[29]。メスのラットではバクテロイデス属と IL-10 が豊富に存在し、オスのラットでは糞便中の酪酸、肝臓 IgA、IL-6、盲腸中の IL-6 のレベルが高かったのです[29]。別の研究では、アフリカの先住民族では、フェカリバクテリウム・プラウスニッツィ や クロストリジウムクラスターIV および XIVa などの酪酸産生細菌の濃度が高かったのです[30]。バクテロイデス-プレボテラ群は、女性に比べて男性に多く存在することが判明しました[31]。腸内細菌叢と機能性胃腸障害(FGID)との関連性を検討した臨床研究はいくつかあります。例えば、277人の日本人を対象とした研究では、腸内細菌叢の構成における男女差が検討されました[32]。その結果、男性ではプレボテラ、メガモナス、フソバクテリウム、メガスファエラが多く、女性ではビフィドバクテリウム、ルミノコッカス、アッカーマンシアが多かったことが明らかになりました。女性では、硬便(ブリストル便型1型および2型)を呈する人が19.4%と男性よりも多く、軟便から液状便(ブリストル便型6型)は男性でより多くみられました[32]。さらに、過敏性腸症候群(IBS)の発症に重要な役割を果たすタイトジャンクションタンパク質は、腸内細菌叢と短鎖脂肪酸の両方と相互作用します。ヘリコバクター・ピロリ菌は、特にクローディン4とオクルディンをはじめとする複数のタイトジャンクションタンパク質の損傷と関連していることが報告されています[33]。 |
| 3. 腸の健康における食物繊維、腸内細菌叢、短鎖脂肪酸の役割 |
| 食物繊維は一般的に水溶性と不溶性の2種類に分けられます。これらの種類は、全粒穀物、果物、野菜、豆類、エンドウ豆、豆類、ナッツ類、種子類など、多岐にわたります。水溶性食物繊維は血中コレステロールと血糖値を下げるのに役立ちますが、不溶性食物繊維は消化器系における物質の移動を促進し、便の量を増やすことで便秘や不規則な便の改善に役立ちます。食物繊維を多く含む食事には、排便の正常化、腸の健康維持、コレステロール値の低下、血糖値のコントロール、健康的な体重の維持など、様々なメリットがあります。腸内細菌叢は、食物繊維や難消化性デンプンから多糖類を分解することで、短鎖脂肪酸の主な生産者です。 短鎖脂肪酸の生産量は生涯を通じて変化し、生涯にわたる腸内細菌叢の構成の変化を反映しています[34,35]。さらに、人生のさまざまな段階で変化する食生活の多様性は、短鎖脂肪酸生産細菌が利用できる基質に影響を及ぼすことで、腸内で生成される 短鎖脂肪酸の量に大きな影響を与えます[36]。既存の研究によると、植物性食品 (野菜、果物、ハーブ、ナッツ、豆、全粒穀物)、魚介類、肉 (赤身の肉を除く)、食物繊維含有量の高い食品は、大腸がんを予防する可能性があることが示されています。しかし、糖分や脂肪分の多い西洋型の食事を続けると、逆の効果があるようです[37]。脂肪や糖分の多い食事は、腸内細菌叢と代謝バランスを崩し、腸管バリアの完全性を弱め、免疫力を変え、大腸がんの発症を促進することで、大腸がんの発症につながる可能性があります[38]。さらに、マウスモデルで示されているように、高脂肪食で誘発される肥満は、ペルオキシソーム増殖因子活性化受容体デルタ(PPAR-δ)の活性化を介して、ロイシンリッチリピート含有Gタンパク質共役受容体5(Lgr5+)腸管幹細胞の増殖を促進し、腫瘍形成の開始を増加させる可能性があります[39]。Scott ら[40]は、植物由来のポリフェノールは、腸内の酪酸産生細菌(ラクトバチルスやビフィドバクテリウムなど)の量を増やして短鎖脂肪酸産生を増加させることで、大腸がんの発症を防ぐのに役立つと報告しました。食物繊維の有益な効果は、主にその発酵性可溶性成分によるもので、腸内微小環境における短鎖脂肪酸の生成につながります。食物繊維を短鎖脂肪酸に変換するこのプロセスは、多様な腸内細菌叢によって行われます。食物繊維は、フィルミクテス属細菌を増加させ、バクテロイデス属細菌を減少させることで腸内の短鎖脂肪酸レベルを高め、マウスモデルにおける大腸がんの進行を抑制します[41,42]。 |
| 動物実験では、特定の化学構造を持つ食物繊維が、腸内細菌叢とその代謝プロセスに継続的かつ予測可能な変化をもたらすことが示されています。この変化は、特に大腸酪酸産生菌を含む腸内細菌叢を持つ人々において、大腸がんの予防に役立ちます[43,44]。大腸がん患者は、健常者と比較して、独特の腸内細菌叢プロファイルを有しています。 大腸がん患者では、バクテロイデス・フラギリス、フソバクテリウム・ヌクレアタム、大腸菌が著しく増加し、短鎖脂肪酸産生細菌が減少しています[45]。以前の研究では、短鎖脂肪酸を産生することが知られているいくつかのプロバイオティクス細菌には、ビフィドバクテリウム、クロストリジウム・ ブチリカム、ストレプトコッカス ・サーモフィルス、ラクトバチルス ・ラムノサス、ラクトバチルス ・アシドフィルス、ラクトバチルス ・ロイテリ、ラクトバチルス カゼイが含まれることが実証されています[46]。具体的には、クロストリジウム・ブチリカムは、ヒストン脱アセチル化酵素 (HDAC) の活性を低下させることで Wnt/β-カテニンシグナル伝達経路を調整し、大腸がん細胞の増殖を抑制できます。これは、マウス モデルで大腸がんの腫瘍形成を防ぐのに役立ちます[47]。 |
| 一般的な腸内常在菌の 1 つである ラクトバチルス・ラムノサスは、腫瘍量を減らし、大腸がんでの抗腫瘍免疫応答を高め、免疫療法を強化します[48]。 大腸がん腫瘍モデルを ラクトバチルス・アシドフィルス 溶解物と抗 CTLA-4 阻害抗体 (イピリムマブ、トレメリムマブ) を組み合わせて治療すると、溶解物が抗腫瘍免疫を効果的に高め、大腸がん細胞の増殖を抑制できることが実証されています[49] 。同様に、アッカーマンシア・ムシニフィラ は短鎖脂肪酸を生成する能力があり、マウスの M1 様マクロファージの増加を促進することで潜在的な保護的プロバイオティクスとして作用し、大腸がんの発症を抑制します[50]。 複数の研究で、短鎖脂肪酸と腸内細菌、そしてそれらが大腸癌(CRC)の発症に果たす役割との関連性が調査されています[6–8,51,52 ](表 2 および 3)。細菌マイクロバイオームを基盤とした大腸がん治療に関する既存の文献は、有望な結果を示しています。しかしながら、ほとんどの研究は細胞モデルまたは動物モデルに限定されています[81] 。このような治療法を臨床応用するには、有効性と安全性の徹底的な評価、関与するメカニズムの詳細な調査、そして広範な臨床試験が不可欠です。 |
| 表2. 短鎖脂肪酸と腸内微生物産生菌 |
 |
| 表3.大腸がんの発症と進行に関連する主要な腸内細菌叢 |
 |
 |
 |
| 4. 短鎖脂肪酸による腸管恒常性維持への影響 |
| 短鎖脂肪酸は腸管恒常性維持と慢性疾患の予防に役立ちます。短鎖脂肪酸は近位結腸に最も多く存在し、腸管上皮細胞によって局所的に吸収・利用されるか、腸管上皮を通過して血流に輸送されます。短鎖脂肪酸は、エネルギー代謝の調節、腸管バリアの強化、免疫反応の調節、そして複数の代謝プロセスへの関与といったメカニズムを通じて、腸管恒常性に大きな影響を及ぼします[82]。さらに、短鎖脂肪酸は1日の摂取カロリーの約10%を占めます[83]。単離された結腸上皮細胞は高いCO2産生を示し、これらの細胞はエネルギーの60~70%を短鎖脂肪酸の酸化から得ていることが示唆されています[84]。結腸上皮細胞は酢酸やプロピオン酸よりも酪酸への親和性が高く、主に酪酸をケトン体とCO2に酸化します。結腸上皮における酢酸、プロピオン酸、酪酸の分子比は、それぞれ約60:20:20です[85]。Donohoeら[86]は、ブチリビブリオ・フィブリソルベンス株が結腸におけるNADH/NAD+およびATPレベルを維持する能力を有することを実証しました。結腸細胞は酪酸を利用し、この株によって産生される酪酸は結腸における主要なエネルギー源として機能します。この発見から、酪酸の救済効果は、酪酸が調節因子としてではなく、エネルギー源としての役割によるものであるという結論が導き出されました。腸内細菌によって産生される短鎖脂肪酸は、H+またはNa+電解質の形で結腸上皮細胞に輸送されます。これらの電解質は酪酸輸送に直接関与し、Na+およびCl-の吸収を増加させ、管腔への重炭酸イオン(HCO3-)の放出を促進します[87–89]。興味深いことに、電解質吸収効率は、トランスポーター遺伝子の発現の違いにより、腸管の領域によって異なります[90]。 |
| 短鎖脂肪酸は、主に遺伝子調節に影響を及ぼし、代謝、細胞分化、急速な細胞複製など、宿主に対して幅広い影響を及ぼします。酪酸は、ヒト遺伝子の 5~20% の発現をエピジェネティックに活性化することがさまざまな報告で示されています[91–93]。酪酸は、細胞内のヒストン脱アセチル化酵素およびリジン活性を阻害するのにプロピオン酸よりも効果的です[94,95]。ヒストンアセチル化酵素の助けを借りてヒストンのアセチル化 (HDAC) 活性を高めると、酪酸代謝がアセチル CoA に伝播します[93,96] (図 2)。短鎖脂肪酸は、ヒストンのアセチル化レベルを上昇させることで、ヒストンの翻訳後修飾に重要な役割を果たします。このヒストンのアセチル化の上昇により、転写因子が特定の遺伝子のプロモーター領域にアクセスしやすくなり、それによって転写に影響を及ぼします。酪酸による ヒストンのアセチル化の阻害は、遺伝子転写を増加させるだけでなく、LHR、XIAP、IDO-1 などいくつかの遺伝子の抑制にもつながります[97,98]。結腸細胞株では、0.5 mm 酪酸濃度で、アップレギュレーションされた遺伝子の 75% が ATP クエン酸リアーゼ (ACLY) 活性に依存していますが、25% はこの活性に依存していません。より高い濃度 (5 mm) では、これらの割合が逆転することから、遺伝子制御メカニズムは酪酸濃度に依存することが示唆されています。さらに、酪酸はヒストンのアセチル化レベルだけでなく、転写因子 SP1 や Foxp3 など他のタンパク質のアセチル化も変更することが示されています[99,100]。腸内細菌叢によって生成される短鎖脂肪酸は、ヒストンアセチラーゼ活性を介してクロトン化を促進する[101]。この修飾は、小腸および大腸の上皮細胞と脳でよく観察される。ヒストン上のクロトン化CoAの存在は、細胞周期の調節に関連している[102]。 |
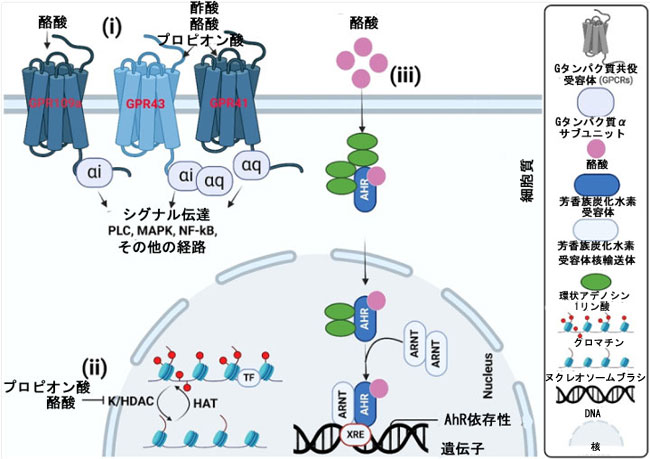 |
図2.短鎖脂肪酸は主に3つのメカニズムを通じて標的細胞に作用します。 (i) 最初のメカニズムは、短鎖脂肪酸がGPR109A、GPR43、GPR41などの細胞膜上のGPCRに結合することです。この結合は、PLC、MAPK、Nf-κBなどの下流経路を阻害します。 (ii) 短鎖脂肪酸は細胞膜上のトランスポーターの助けを借りて細胞内に侵入し、細胞核に移動してヒストンのアセチル化を阻害し、HATを活性化します。その結果、ヒストンのアセチル化が促進され、高密度染色体が徐々に緩み、最終的に遺伝子(LHR、XIAP、またはIDO-1)の発現が増加します。 (iii) もう1つの作用メカニズムは、短鎖脂肪酸がAhRの助けを借りて細胞内に侵入し、核に移動するものです。 AhR や ARNT などの核受容体は DNA に結合して、解毒、代謝、細胞発達、および異物に対する細胞センサーの重要な役割に関与する遺伝子発現を抑制し、身体の反応を調整します。 |
| さらに、研究では酪酸がヒストンのアセチル化だけでなく、DNAやタンパク質のメチル化およびリン酸化のレベルにも影響を及ぼすことが示されています。特に、酪酸は上皮細胞の代謝において二重の機能を示します。健康な腸上皮細胞(IEC)の主要なエネルギー源として働くと同時に、がん細胞の増殖を抑制します。酪酸パラドックスまたはワールブルク効果[93]と呼ばれるこの効果は、エネルギー源としてブドウ糖を好むがん細胞の代謝シフトから生じます。急速な細胞増殖の抑制は通常、細胞周期停止、DNA損傷、および活性酸素種(ROS)産生の増加と関連しており、短鎖脂肪酸ががん細胞でプログラム細胞死のシグナル伝達を引き起こす可能性があることを示唆しています[103–106]。がん細胞でのかなりの代謝変化により、アセチルCoAを含むさまざまな代謝物の産生と利用可能性が変わります。アセチルCoAは複数の代謝経路において重要な役割を果たし、ヒストンアセチルトランスフェラーゼの基本的な補因子として機能します。短鎖脂肪酸は腸の恒常性維持に有益な効果をもたらすことから、胃腸の健康を改善し、腸機能障害に関連する疾患を予防するための治療標的としての可能性が示唆されています。 |
| 5. 大腸がんの発がんにおけるエピジェネティック制御における短鎖脂肪酸の役割 |
| 5-FUなどの化学療法薬やセツキシマブなどの標的免疫療法は、大腸がんの治療に広く用いられています[107]。しかし、これらの治療法は副作用や治療効果の低さといった問題に直面することがよくあります。酪酸産生腸内細菌叢は、大腸がん治療の潜在的な標的として注目を集めています。例えば、HT-29細胞の増殖は、ラクトバチルス・プランタラム株由来の酪酸を含む培養上清で処理すると阻害され、サイクリンD1はG1-S期転移に作用し、サイクリンBはM期転移に関与している[108]。さらに、酪酸産生菌であるブチリコッカス・プルリカエコラムを大腸がん担がんマウスモデルに投与すると、体重増加と血清中のがん胎児性抗原レベルの低下がみられた[109]。酪酸ナトリウム(NaB)による処理は、SW480およびSW620CRC細胞株において、溶質輸送体ファミリー5メンバー8(SLC5A8)およびGタンパク質共役受容体43(GPR43)を含む短鎖脂肪酸トランスポーターの発現を増加させた[109]。バクテロイデス・プルリカエコラムは、酪酸を産生する可能性のある細菌であり、染色体分離1様遺伝子(CSE1L)の発現をダウンレギュレーションすることで大腸がん細胞の増殖を抑制することが示されている[110]。酪酸を生産する別の細菌であるクロストリジウム・ブチリカムは、マウスモデルにおいて高脂肪食(HFD)によって誘発される腸腫瘍の発達を減らすことが分かりました。この効果は、病原菌と胆汁酸生体内変換菌のレベルを低下させ、短鎖脂肪酸産生菌のレベルを上昇させることで達成された[47]。さらに、C. ブチリカムの培養上清と酪酸ナトリウム (NaB) は、Wnt/β-カテニンシグナル伝達経路を阻害し、HCT 116 細胞株における GPR43 と GPR109A の発現を増強することで、細胞のアポトーシスを促進した。これは、大腸がん組織と正常結腸組織におけるこれらの受容体の発現を比較した分析で観察された[47]。さらに、プロピオン酸産生細菌であるバクテロイデス・テタイオタオミクロンは、CRC 細胞株において NaB と同等の効果を示した107B. テタイオタオミクロンの培養上清をプロピオン酸ナトリウム (NaP) と組み合わせて処理すると、大腸がん細胞株の増殖が著しく減少し、細胞のアポトーシス率が上昇した[107]。Ohara ら[111]は、短鎖脂肪酸(酪酸、イソ酪酸、酢酸)の大腸がん細胞に対する抗腫瘍効果を検証し、遺伝子発現を解析した。DNA複製に関与する791個の遺伝子(E2F1、UHRF1、HIST2H3A、HIST1H4K、HIST1H4L、HIST1H3B、HIST1H3D、HIST1H3H、FOXM1など主要な遺伝子)の発現レベルは、未処理細胞と比較して50%未満有意に減少した。McLoughlinら[112]は、メタアナリシスによって、がん、炎症性腸疾患、肥満、健常者、糖尿病、腎臓病、肝臓病など、様々な疾患における短鎖脂肪酸、プレバイオティクス、プロバイオティクスの影響が明らかにされたことを明らかにした。彼らは、短鎖脂肪酸レベルが炎症性タンパク質の発現と負の相関関係にあり、短鎖脂肪酸レベルが高いと C 反応性タンパク質 (CRP)、腫瘍壊死因子 (TNF)、インターロイキン-6 (IL-6) などの炎症性サイトカインのダウンレギュレーションと関連していることを発見しました[112]。Nomura ら[113 ]は、PD-1 阻害剤 (ペンブロリズマブなど) で治療した固形腫瘍患者の糞便中の酢酸、酪酸、プロピオン酸、吉草酸、血漿中のイソ吉草酸のレベルを評価し、糞便中の短鎖脂肪酸レベルが PD-1 阻害剤の有効性と関連している可能性があることを発見しました。これは、腸内細菌叢由来の短鎖脂肪酸が PD-1 チェックポイント阻害薬の有効性を調整する可能性があることを示唆しています。糞便材料からの短鎖脂肪酸レベルの測定は非侵襲的であるため、腸内細菌叢を介した短鎖脂肪酸産生に基づいて抗がん剤に対する患者の感受性を評価するための日常的な患者モニタリングに使用できます。 Auneらは、食物繊維、全粒穀物と大腸がんリスクの関係を調査しました。多くの疫学研究は、胆汁酸、生体物質の再吸収、便の通過時間、短鎖脂肪酸の形成など、様々なメカニズムを通じて食物繊維が大腸がんを予防する役割を担っていることを裏付けています[114–120]。 |
| がんは複数の段階を経て進行しますが、短鎖脂肪酸は、発がんに関わる遺伝子や経路を含む、幅広い遺伝子や経路の発現に影響を及ぼすという利点があります(図3)。これは、一般的に単一の分子または経路を標的とする従来の抗がん治療とは対照的です。発がんプロセスには、遺伝子発現を変化させる特定の変異とエピジェネティックな修飾の両方が含まれます[121]。特定の遺伝子は、細胞運命、生存、ゲノム安定性を制御する複数のシグナル伝達経路に影響を与えます[122]。Wnt、Hedgehog, およびNotch[123]など、細胞運命を制御する遺伝子の変異は、分化と増殖のバランスを崩し、がん細胞の特徴である持続的な細胞増殖につながる可能性があります。 DNAメチル化、ヒストンコード、非コードRNA、そして腫瘍抑制遺伝子のサイレンシングとがん遺伝子の活性化を含む、エピジェネティックランドスケープにおける広範な変化は、がんの基本的な特徴です[124]。遺伝子発現における遺伝的変化とエピジェネティック変化はどちらも細胞分裂を通じて受け継がれるため、腫瘍の発生に大きく寄与します。短鎖脂肪酸は、がんに関連する多くのエピジェネティック変化を緩和することができるため、腫瘍発生リスクの高い個人に短鎖脂肪酸を投与することで、特定の変異が発生する前に、分子レベルおよび細胞レベルでがんの発生を遅らせたり、予防したりできる可能性があります。 |
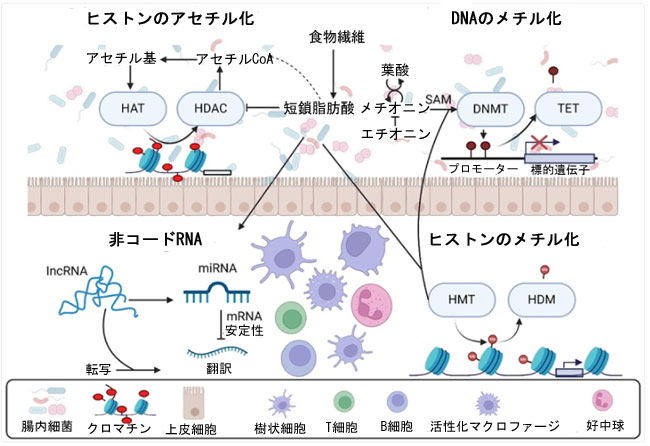 |
| 図3.腸内細菌叢は、クロマチン修飾酵素に影響を及ぼす基質と調節因子の両方として機能する短鎖脂肪酸を産生することで、大腸がんのエピジェネティック制御に寄与しています。そのメカニズムは、ヒストン脱アセチル化酵素の活性阻害であり、様々ながん細胞株において標的遺伝子の発現亢進に関連するクロマチン変化をもたらします。 |
| 上皮成長因子受容体(EGFR)は、上皮成長因子(EGF)や形質転換成長因子α(TGFα)などのリガンドと相互作用する膜貫通型糖タンパク質です。活性化されると、その内因性チロシンキナーゼ活性により、マイトジェン活性化プロテインキナーゼ(MAPK)、ホスホイノシチド3キナーゼ(PI3K)、プロテインキナーゼB(Akt)、哺乳類ラパマイシン標的タンパク質(mTOR)、Ras/Raf/MEK/ERKなど、一連の下流シグナル伝達経路が誘導され、細胞増殖、血管新生、転移などのプロセスが促進されます。 上皮成長因子シグナル伝達は肝細胞がんの発症に重要な役割を果たしている可能性があり、短鎖脂肪酸によってその阻害が異形成およびがんへの進行を遅らせるのに役立つ可能性があります[125]。さらに、上皮成長因子受容体 (ERBB1) 分子は、JAK/STAT、Ras/ERK、c-Jun、PI3K/Akt/mTOR などのシグナル伝達経路を活性化し、これらの経路を介して下流の転写因子を活性化することで、本質的に細胞増殖につながります[126]。短鎖脂肪酸は腸管系を調節することでこれらすべての経路に影響を及ぼします。これは、短鎖脂肪酸がアポトーシスを誘導し、細胞の生存、増殖、血管新生、転移の延長など、さまざまな発がんプロセスを阻害する可能性があることを示唆しています。Wang ら[126]は、活性化 T 細胞核因子 (NFATc) が腸管細胞でのホスファターゼおよびテンシンホモログ (PTEN) の発現の制御に重要な役割を果たしていることを示しました。特に、NFATc1とNFATc4は、腫瘍抑制遺伝子であるPTENの発現を制御することで、腸管細胞の増殖と分化の重要な調節因子として機能する可能性があります。テンシンホモログ機能の低下または喪失は、乳がんや大腸がんなど様々ながんと関連付けられており、細胞増殖と腫瘍の発生を促進します。しかし、ホスファチジルイノシトール-4,5-ビスリン酸3-キナーゼ触媒サブユニットα(PI3KCA)とテンシンホモログがん遺伝子タンパク質は、どちらも細胞分裂と増殖において重要な役割を果たすため、複数のがんとの関連性が観察されています。プロテインキナーゼBシグナル伝達のダウンレギュレーションは、大腸がんの発がんに関与するがん遺伝子であるマウスダブルミニッツ2(mdm-2)の発現低下につながります。mdm-2は、腫瘍抑制遺伝子p53をユビキチン化によって分解するために標識する役割を担っています。 mdm-2の活性低下はp53を安定化させ、細胞周期停止、DNA修復促進、あるいはアポトーシス誘導を可能にします。さらに、プロテインキナーゼBシグナル伝達の低下はNF-κBの活性も低下させ、細胞のアポトーシス感受性を高めます[127]。最終的に、短鎖脂肪酸はがん細胞において恒常的に活性化されているこれらの経路を正常化することでバランスを回復させ、腫瘍の発生と進行の可能性を低減します。初期段階の腫瘍は、低酸素環境下で低酸素誘導因子1(HIF-1)の発現により持続し、増殖します。 これがMETプロトオンコゲンの転写を誘発します。128 MET/HGFRは、肝細胞増殖因子(HGF)と相互作用するチロシンプロテインキナーゼです。活性化されると、METはRas、STAT3、β-カテニン、PI3Kを介したシグナル伝達経路を開始し、MAPKの持続的な活性化を引き起こします。これにより、細胞生存、細胞増殖、血管新生、転移が促進されます[129] 。短鎖脂肪酸は、PI3K/AktやRas/Rafを含むFGFR2およびHippoシグナル伝達経路をヒストンのアセチル化阻害を介してエピジェネティックに阻害しますが、これらの経路は発がんにおける遺伝子変異の標的でもあります[122,130]。潜在的な抗がん剤であるバルプロ酸とヒストンのアセチル化阻害剤は、どちらも腫瘍間質における細胞増殖を強く抑制します。バルプロ酸は、線維芽細胞増殖因子(EGF)、血小板由来増殖因子(PDGF)、ホルボール12-ミリステート13-アセテート(PMA)、プロスタグランジンE2(PGE2)、酪酸、トリコスタチンA(TSA)といった様々なリガンドの影響を受けながら、結合組織におけるHGF産生を阻害しましたが、細胞毒性作用は示しませんでした。肝細胞増殖因子はc-METシグナル伝達を活性化するため、in vitroにおいて肝細胞増殖因子の産生を低下させると、METシグナル伝達とHepG2細胞の遊走が共に弱まります。これは、ヒストンのアセチル化阻害が腫瘍転移の化学予防に影響を与えることを示唆している[131]。酢酸は、カスパーゼ3を活性化してDNA断片化を引き起こし、最終的に細胞死につながることで、大腸がんのプログラム細胞死に影響を与えることが示されている[7]。さらに、酢酸はCD8+ T細胞上のFasと腺がん上皮細胞上のFasリガンド(FasL)の細胞表面発現を増加させ、腫瘍浸潤Tリンパ球による腫瘍細胞のアポトーシス誘導を促進する[132]。酪酸、酢酸、プロピオン酸はNF-κBシグナル伝達を抑制し、リポ多糖(LPS)刺激によるTNF+ヒト好中球を減少させることができる[133]。TNFはNF-κBを活性化するため、NF-κBシグナル伝達のさらなる阻害につながる[134]。プロピオン酸はアルギニンメチルトランスフェラーゼの発現を低下させることで大腸がんのアポトーシスを誘導するが、正確なメカニズムはまだ不明である[7]。これらのデータは、短鎖脂肪酸が発がんの様々な側面を制御する上で多様な影響を及ぼすことを強調し、炎症とがんに関与する複数のシグナル伝達経路を標的とする治療化合物としての可能性を浮き彫りにしています。この点において、短鎖脂肪酸をベースとした治療法は、特定の発がん性変異の影響を、同じ経路をエピジェネティックに制御することで打ち消す可能性があります。腸内細菌叢が大腸がんにおけるエピゲノム変化にどのように影響するかをまとめた既存の報告を表4に示します。 |
| 表 4. 大腸がんにおけるエピジェネティックな変化に関連する腸内細菌叢 |
 |
 |
 |
| 6. 短鎖脂肪酸と大腸がんにおける免疫恒常性 |
| 既存の研究は全体として、短鎖脂肪酸が病原体と闘う免疫システムの能力を高めることを示唆しています。動物実験では、短鎖脂肪酸は、シトロバクター・ローデンティウムやクロストリディオイデス・ディフィシルなどの細胞外細菌、インフルエンザウイルス、RSウイルスなどのウイルス、リステリア・モノサイトゲネスやサルモネラ・チフス菌などの細胞内細菌に対する免疫反応を高めることが示されています[146]。腸内細菌叢は、核因子κB(NF-κB)経路の調節などを通じて、特定の種類の免疫細胞の分化や炎症機能に影響を与えることで、免疫系において重要な役割を果たしています[147]。さらに、酪酸とプロピオン酸は、免疫細胞の移動、接着、サイトカイン産生に影響を与えることで抗炎症効果を発揮することが知られています[148]。さらに、プロピオン酸は細胞上のナチュラルキラーグループ2D受容体(NKG2D)リガンドの表面発現を促進し、大腸がんにおける免疫反応を高めます[148]。 |
| 細菌認識受容体の一種であるToll様受容体(TLR)は、自然免疫系にとって極めて重要です。Toll様受容体は腸管上皮細胞の増殖を刺激し、抗菌ペプチドの産生を促進します[149]。酪酸とプロピオン酸は様々なヒストンのアセチル化 (HDAC)の活性を調節します。ヒストンのアセチル化は内因性Toll様受容体リガンドです[150]。TLR5は結腸で豊富に発現しており、グラム陰性腸内細菌のフラジェリンに結合して、複数の細胞内経路の活性化を引き起こします[151]。酪酸は、TLR5発現の誘導を通じて、腸管上皮細胞における細菌フラジェリンを介した免疫調節反応を増強することが示されている。さらに、フラジェリンはIL-10やTGF-βなどの抗炎症因子の放出を刺激し、炎症を軽減します[152]。腸内細菌が産生する主要な代謝物である酪酸は、Sp3を介してTLR5の転写を活性化し、TLR5をアップレギュレーションし、IL-6、IFN-γ、TNFなどの炎症性サイトカインの発現を促進します。これらのサイトカインは、マウス大腸炎モデルにおいて大腸の炎症を改善します[153]。酪酸は、大腸がんにおいてTLR4の発現を増強し、MAPKおよびNF-κBのリン酸化を増加させることが示されている。しかし、これらの効果の正確なメカニズムはまだ完全には解明されていません[154]。現在、自然免疫における短鎖脂肪酸- Toll様受容体(相互作用のメカニズム経路に関する研究は限られており、短鎖脂肪酸とToll様受容体シグナル伝達経路の関係は依然として不明です。それにもかかわらず、既存の研究では、短鎖脂肪酸が体内の免疫恒常性を維持するために重要なToll様受容体発現を調節することによって抗炎症効果を発揮することが実証されています。 |
| これまでの研究で、短鎖脂肪酸が様々な経路を通じて好中球の活性に大きな影響を与えることが実証されています[155]。短鎖脂肪酸は、好中球の活性化と機能に不可欠なサイトカインおよびケモカインの産生を担う重要な遺伝子の発現を調節することができます。この調節は、感染部位または炎症部位への好中球の動員を促進する可能性があります。さらに、短鎖脂肪酸は好中球による活性酸素種(ROS)の生成にも影響を与えます[156]。生理的レベルの活性酸素種は病原体除去に不可欠ですが、過剰な活性酸素種産生は組織損傷を引き起こす可能性があります。短鎖脂肪酸は好中球中の活性酸素種レベルを調節し、バランスの取れた免疫応答をサポートします。 FFAR2 を高レベルで発現している好中球は、短鎖脂肪酸に対する感受性が高まっています[157]。たとえば、デキストラン硫酸ナトリウム (DSS) を用いて実験的に誘発された無菌炎症の場合、酪酸処理により結腸への好中球の移動が阻害され、それによって炎症を促進するサイトカインの局所的産生が減少することが示されています[158]。最近の研究では、結腸腔内濃度と同様の酪酸の補充により、好中球細胞外トラップ (NET) の形成が促進される可能性も示唆されています[159,160]。好中球は、炎症シグナルに最初に反応する細胞の 1 つであり、細菌や真菌などの病原体の検出と排除に重要な役割を果たします[161]。好中球は、炎症部位の単核細胞の数を増やすことで炎症プロセスに大きな影響を与えます。好中球は、エイコサノイドの産生を促進するシクロオキシゲナーゼ(COX)や誘導型一酸化窒素合成酵素(iNOSまたはNOS II)などの重要な酵素も産生します。これらの酵素は、白血球の接着や集積など、炎症の様々な側面を制御する可溶性因子の産生を誘導します[161]。 |
| マクロファージは腸内バランスの維持に重要な役割を果たしている[162]。Changら[163] は、酪酸が腸内マクロファージによる炎症性サイトカイン産生を抑制することがヒストンのアセチル化活性の阻害と関連していることを発見した。腸内細菌によって産生される代謝物である酪酸とナイアシンは、Gpr109aを介して結腸におけるIL-18の産生を促進する。酪酸はまた、Gpr109a依存性メカニズムを介して抗原提示細胞(APC)におけるIL-10およびAldh1aのレベルを増加させる。Niacr1欠損マウス(Niacr1−/−)は、大腸炎および大腸がんに対する感受性がより高い。 Gpr109aシグナル伝達は、特に腸内細菌と食物繊維が不足している状況において、結腸の健康維持において保護的な役割を果たします[164]。単一細胞RNAシーケンシングにより、酪酸によって誘導される抗菌活性は、抗菌作用で知られるタンパク質であるカルプロテクチンをコードするS100A8およびS100A9遺伝子の発現上昇によって特徴付けられることが明らかになりました。結果として、酪酸はmTORを阻害することでマクロファージの抗菌活性を高めます[165]。さらに、短鎖脂肪酸は肺胞マクロファージにおけるM2分極を阻害し、GPR43を活性化する可能性があります。酪酸とプロピオン酸は、ヒストンのアセチル化の阻害を通じて H3 のアセチル化を促進し、M2 分極を抑制します[166]。短鎖脂肪酸 は、喘息、アトピー性皮膚炎、炎症性腸疾患、好酸球性食道炎など、好酸球増多に関連する症状に同様に影響を及ぼします[167]。さらに、プロピオン酸と酪酸は IgE を介した好塩基球の脱顆粒を促進します[168,169]。これは、短鎖脂肪酸がアルカリ顆粒球の活性化、IL-13 の産生、および脱顆粒の調節に重要な役割を果たす可能性があることを示しています。 |
| CD4+エフェクターT細胞の重要なサブセットであるTヘルパー(Th17)細胞は、主に腸管関連組織に存在します。腸管におけるこれらの細胞の活性化と集積は、特定の腸内細菌や外部病原体との相互作用によって影響を受けます[170,171]。プロピオン酸はCD4+ T細胞機能の調節に関与しており、特にTh17細胞に作用します。大腸炎および多発性硬化症の実験モデルにおいて、プロピオン酸は小腸におけるTh17細胞の産生を抑制し、中枢神経系(CNS)における分節糸状細菌(SFB)誘発性の自己免疫炎症を軽減することが示されています[172]。プロピオン酸は活性Th17細胞の解糖活性を高めることでIL-10の産生を促進し、さらに免疫学的効果に影響を与えます。自己免疫性前立腺炎のマウスモデルでは、プロピオン酸レベルは低いが、プロピオン酸を補充すると、Th17細胞の活性とIL-17産生の両方が効果的に減少し、病状が改善した[173]。多発性硬化症患者では、プロピオン酸レベルは低下し、Th17細胞は増加するが、プロピオン酸補充はTh17細胞レベルの低下と、それに続く疾患経過の改善に関連している[174]。さらに、プロピオン酸と酪酸の補充は、Th17細胞を肺内皮細胞にリクルートするケモカインであるCCL20の発現を増加させることがわかっている。このTh17細胞のリクルートは、肺腫瘍病巣の縮小に寄与し、黒色腫細胞の転移を阻害する[175]。フソバクテリウム・ヌクレアタム株Fn7-1は、結腸Th17細胞の数を増加させ、腸腫瘍の進行に寄与することが示されている。この効果は短鎖脂肪酸受容体(FFAR)に依存する。 短鎖脂肪酸受容体がない場合、Fn7–1 は RORγt+ CD4+ T 細胞の集団を変化させません[176]。そのため、短鎖脂肪酸はヒト疾患における Th17 細胞の誘導と機能の重要な制御因子です。ただし、酢酸と酪酸が同様の効果を発揮するかどうかを決定するには、さらなる研究が必要です。また、腸内細菌叢によって生成されるトリプトファン代謝物は、特に炎症の状況において、Th17 細胞の免疫調節活性の制御に重要な役割を果たしています。乳児の腸内では、ビフィズス菌は生後 1 か月は豊富ですが、その数の減少は IL-17A レベルの上昇と全身性炎症に関連しています。ビフィドバクテリウム EVC001 の補給は、腸内の Th17 細胞と Th2 細胞の集団を減らすことで、これらの影響を軽減することが示されているEVC001によって生成される重要な代謝物の一つであるインドール-3-乳酸は、Th17細胞とTh2細胞の分極過程における活性化を阻害する免疫調節タンパク質であるガレクチン-1の発現を促進する[177]。一方、最近の研究では、腸内で分節糸状細菌によって生成されるレチノイン酸(RA)はシトロバクター・ロデンティウム感染に対する防御に役立ち、IL-17A阻害抗体はこの防御を阻害できないことが実証されている。これは、分節糸状細菌由来のレチノイン酸がTh17細胞とは独立して宿主防御機構に寄与していることを示唆している[178]。そのため、微生物由来の代謝物はTh17細胞を活性化する可能性を秘めているものの、この反応は必ずしも予測可能ではなく、活性化に至る正確なメカニズムはまだ十分に解明されていない。 |
| 胆汁酸(BA)はコレステロール由来の重要な代謝物であり、一次胆汁酸と二次胆汁酸に分けられます。肝細胞は一次胆汁酸を産生し、胆嚢に蓄えられた後、十二指腸に放出されて脂質の消化を助けます。これらの胆汁酸の約95%は回腸末端に到達する前に再吸収されますが、残りの5%は腸管に入り、腸内細菌叢によって様々な二次胆汁酸に変換されます[179]。腸内細菌叢によって産生される胆汁酸の代謝物は、RORγt+細胞の活性を制御し、疾患に対する脆弱性に影響を与える上で重要な役割を果たします[180]。例えば、二次胆汁酸である3-オキソリトコール酸(3-オキソLCA)は、RORγt転写因子に結合して腸管Th17細胞の分化を阻害します。 3-オキソリトコール酸の投与は、無菌(GF)マウスにおけるTh17細胞数を減少させることが示されています[181]。同様に、別の二次胆汁酸であるイソリトコール酸(isoLCA)も、RORγtと相互作用することでTh17細胞への分化を阻害します。3-オキソリトコール酸とイソリトコール酸はどちらもTh17関連遺伝子の発現と負の相関関係にあり、炎症性腸疾患(IBD)患者では減少していることが分かっています[182]。 炎症性関節炎モデルにおいて、腸内細菌パラバクテロイデス・ディスタソニスによって産生されるイソリトコール酸と3-オキソリトコール酸はどちらもTh17細胞への分化を直接抑制し、抗関節炎効果をもたらします[183]。 |
| ビフィドバクテリウム属細菌は、ヒト糞便のハイスループットスクリーニングにおいて、腸内胆汁酸である3-オキソリトコール酸(3-oxoLCA)を、免疫調節作用で知られる二次胆汁酸であるイソアロリトコール酸(isoalloLCA)に変換する能力があることが発見されている[184]。イソアロ-3-オキソリトコール酸は細胞内の酸素消費量を増加させ、ミトコンドリアの活性酸素種を生成させることが示されており、その結果、FOXP3の発現が上昇し、Treg細胞の分化が促進される[185]。しかし、ビフィドバクテリウム属細菌がどのように二次胆汁酸を産生し、免疫調節にどのような影響を与えるかを直接調べた研究は限られている。別の二次胆汁酸である3β-ヒドロキシデオキシコール酸(isoDCA)は、樹状細胞(DC)におけるTNFαおよびIL-6の産生を阻害する一方で、Foxp3の発現を促進し、末梢Treg細胞の数を増加させることが分かっている。ビフィドバクテリウムは、コール酸をイソDCAに変換するのに必要な7α-ジヒドロキシ化酵素を欠いているが[187]、胆汁酸を脱抱合する胆汁酸塩加水分解酵素を発現しており、同様の免疫調節特性を持つ他の二次胆汁酸の形成につながる可能性がある[188,189]。Furusawa et al., (2013) は、酪酸処理により、ナイーブCD4+ T細胞でヒストンH3のアセチル化が著しく増加し、特に70の転写因子に影響することを示した。最も注目すべき標的の1つであるFoxp3では、アセチル化の促進が見られ、これは遺伝子発現の増加と関連していた。この研究では、酪酸がFoxp3プロモーターおよび保存された非コード配列CNS1とCNS3を含む遺伝子内エンハンサーエレメントのアセチル化を促進することが明らかになった[190]。さらに、Arpaia et al., は、CNS1欠損マウスでは、酪酸がナイーブCD4+ T細胞でFOXP3の発現を誘導できないことを実証した。 CNS1 は末梢部位 (pTreg) 細胞の分化に必要であるが胸腺 (tTreg) 細胞には必要ではないことを考えると、これらの結果は酪酸が腸内で pTreg 細胞の分化を選択的に促進することを示唆している[99]。 |
| 7. マイクロサテライト不安定性腫瘍細胞における酪酸の抗腫瘍効果 |
| 酪酸は結腸において強力な抗腫瘍剤であり、アポトーシスを促進し、過剰な細胞増殖を抑制し、細胞分化を誘導し、免疫防御を強化し、血管新生を抑制し、炎症を軽減する特性を示す[191]。特に、酪酸は、マイクロサテライト不安定性(MSI)腫瘍細胞において、ミスマッチ修復能(pMMR)腫瘍細胞よりも高い抗腫瘍効果を示すことが示されている[192,193]。研究では、HCT15、HCT116、LoVoなどのマイクロサテライト不安定性腫瘍細胞は、SW480やHT29などのミスマッチ修復能細胞と比較して、酪酸の抗増殖効果に敏感であることが実証されている[194]。さらに、この研究では、1 mmの酪酸曝露がマイクロサテライト不安定性腫瘍細胞の増殖を有意に減少させ、ヒトmutLホモログ1 (hMLH1)欠損HCT116細胞株は特に反応性が高い[194]。さらなる研究によりこれらの知見が確認され、酪酸はミスマッチ修復能細胞と比較してhMLH1欠損細胞でより高いアポトーシス率とより強い増殖阻害を誘導することが示された[194]。ミスマッチ修復能欠損大腸がん細胞株(HCT15、HCT116、LoVo)およびミスマッチ修復能良好株(SW480およびHT29)を1 mM酪酸に12週間曝露したところ、細胞増殖が有意に減少し、ミスマッチ修復能欠損株でより強い効果が観察された。酪酸処理を中止し、細胞を通常の培地に戻すと、増殖率はベースラインレベルに戻った[194]。特に、ミスマッチ修復能欠損HCT116細胞株は酪酸に対して特に反応性が高い。さらなる研究により、hMLH1欠損細胞株は、ミスマッチ修復能を有するSW480 大腸がん細胞株やHCT116+chr3(第3染色体)細胞株よりも酪酸に対して感受性が高いことが示されました。両研究とも、1mmの酪酸に曝露されたhMLH1欠損細胞において、より強い増殖阻害とアポトーシス誘導が見られました[194]。 |
| 8. 脳-腸軸と短鎖脂肪酸の影響を受ける免疫応答におけるホルモンおよび神経メディエーターの役割 |
| 脳-腸軸は、健康と疾患の両方の調節において重要な役割を果たす相互接続されたコミュニケーションネットワークです[195]。中枢神経系は、視床下部-下垂体-副腎(HPA)相関、および自律神経系(ANS)の交感神経系と副交感神経系を介して腸の機能に影響を与えます。ストレスは視床下部-下垂体-副腎相関の正常な機能を阻害し、ノルアドレナリン、カテコールアミン、セロトニンまたは5-ヒドロキシトリプタミン(5-HT)、サイトカインなどのシグナル伝達分子の放出を引き起こします。ニューロン、腸管クロム親和性細胞、免疫細胞によって生成されるこれらの分子は、腸腔に入り、腸内細菌叢の構成と機能に影響を与えます[196]。研究では、ストレスによって引き起こされるノルエピネフリンの増加が、有害な腸内病原体の増殖を促進する可能性があることが示されています[197]。自律神経系はまた、腸内細菌叢に対する中枢神経系の影響を調節する役割を果たしています。急性ストレスは、腸と胃に向けられた副交感神経と迷走神経の活動の変化を導き[198]、運動性、透過性、酸分泌、免疫反応などの重要なプロセスに影響を及ぼします[199]。これらの変化は腸内環境に総合的に影響を与え、小腸と結腸の微生物のコロニー形成に関連しています。腸内分泌細胞 (EEC) は、消化管 (GIT) 全体に散在する特殊な細胞で、消化管の上皮細胞の約 1% を占めています。これらの細胞は、食事からのシグナルに応じて様々な腸管ホルモンを産生することで、腸管運動、食欲、ホルモン分泌の調節に重要な役割を果たします。腸管上皮細胞は、産生するホルモンの種類によって、グレリン、ネスファチン、ソマトスタチン、5-HT、ガストリン、コレシストキニン(CCK)、グルコース依存性インスリン分泌刺激ポリペプチド(GIP)、グルカゴン様ペプチド1(GLP-1)、ペプチドYY(PYY)など、異なるタイプに分類されます[200]。感覚細胞である腸内分泌細胞は、腸管内容物と宿主の生理学的反応との間のコミュニケーションを促進し、摂食調節、インスリン分泌、行動適応に影響を与えます。 |
| 腸管ホルモンは、消化管から中枢神経系に至るまで、複数の組織において幅広い機能を果たします。現在までに20種類以上の活性腸管ホルモンが同定されており[201]、その多くは重複した作用と標的を有しています。腸管ホルモンは、主に栄養素の検出、消化、インスリン調節における役割について研究されていますが、最近の研究では、不安やうつ病の調整にも重要な役割を果たしていることが明らかになっています[202]。短鎖脂肪酸は、L型腸内分泌結腸細胞のFFAR2およびFFAR3受容体と相互作用し203、ペプチドYY(PYY)やグルカゴン様ペプチド1(GLP-1)などの食欲抑制ホルモンの放出を引き起こします[204–207]。これらのホルモンは、迷走神経求心性神経[208]または血流[209]を介して脳に輸送され、そこで食欲と食物摂取量を調節します[210]。酢酸は血液-脳関門(BBB)を通過し、視床下部神経ペプチドの発現を高めることで満腹感に関与する脳領域に影響を及ぼすことが知られています[211]。さらに、結腸のプロピオン酸レベルの上昇は、高エネルギー食品への嗜好性の低下、エネルギー摂取量の減少、および消化管の活動の低下と関連付けられています。 短鎖脂肪酸はペプチドYYや グルカゴン様ペプチド1のレベルを変化させることなく、線条体経路を介して報酬に基づく摂食行動を抑制することが報告されている[212]。一部の研究では、短鎖脂肪酸がペプチドYYおよび グルカゴン様ペプチド1のレベルを上昇させることができると示唆している一方で、効果がないことを確認した研究もある[213,214]。この矛盾する結果は、研究デザイン、サンプル サイズ、または 短鎖脂肪酸上昇期間の違いによるものと考えられる。初期の研究では、ペプチドYYおよびグルカゴン様ペプチド1は、迷走神経の主要投射領域である孤立束核 (NTS) を含む複数の脳領域で発現していることが示唆されているが [215]、これらのホルモンは、報酬処理、抗不安作用、抗うつ作用、記憶および神経可塑性の向上に関連付けられている[219–223]。ただし、ペプチドYYが消化管の外で生成されるかどうかを確認するには、さらなる研究が必要である。さらに、短鎖脂肪酸によって誘発されるこれらの食欲調節ホルモンの変化が、不安、ストレス、またはうつ病に及ぼす影響は不明である。 |
| 正常な生理学的条件下では、免疫細胞の活性化とサイトカイン産生は中枢神経系に最小限の影響しか及ぼしません。しかし、全身性感染症は認知機能や行動に重大な影響を及ぼす可能性があり[224,225]、サイトカインと神経プロセスの相互作用は気分や意欲に影響を与える可能性があります[226]。マイクロバイオームの変化は短鎖脂肪酸の産生を変化させ、ひいては末梢免疫や脳機能に影響を及ぼす可能性があります。バリア機能の改善は全身性炎症の軽減に役立つ可能性があり、短鎖脂肪酸と免疫細胞の相互作用はこのプロセスにおいて重要な役割を果たす可能性があります[227]。短鎖脂肪酸は、自然免疫系と獲得免疫系の両方に影響を及ぼすことで、脳機能にも影響を及ぼす可能性があります。例えば、Mohleらは、抗生物質による治療後に海馬の神経新生が減少したが、プロバイオティクスと腸内細菌叢の再定着を組み合わせることで回復したと報告している[228]。重要なのは、脳内のLY6Chi単球レベルと神経新生の間に正の相関関係があることを研究が示しており[228]、この関係において短鎖脂肪酸が役割を果たしている可能性を示唆しており[229,230]、さらなる研究が必要である。全身性炎症は神経炎症に寄与すると一般的に理解されているが[227]、このプロセスにおける短鎖脂肪酸の役割を完全に特定するにはさらなる研究が必要である。脳の主要な免疫細胞として機能するミクログリアは、自然免疫反応と脳の発達に不可欠である。さらに、腸内細菌叢がミクログリアの機能に影響を及ぼすことが示されている。通常の条件下では、バランスの取れたマイクロバイオームがミクログリアの維持と成熟を支えています[231]。特に、ミクログリアが通常未発達である無菌マウスでは、酢酸、酪酸、プロピオン酸などの短鎖脂肪酸の補給がミクログリアの成熟を回復させ、特定病原体未感染(SPF)マウスで観察される構造に近づけるのに役立ちます[231]。短鎖脂肪酸がミクログリアの構造と機能に影響を及ぼすメカニズムは依然として不明ですが、短鎖脂肪酸受容体(FFAR)が関与している可能性が高いです。研究では、FFAR2を欠損するマウスでは、無菌マウスのようにミクログリアが未発達な外観を示すことが示されています[232]。短鎖脂肪酸は、直接的および間接的な経路の両方を介して微生物叢-腸-脳軸に沿った多数のプロセスを制御し、エピジェネティックシグナル伝達が中心的な役割を果たしています。この複雑な相互作用をさらに探索することで、中枢神経系疾患の新たな治療法が見つかる可能性があります。 |
| 9. 大腸がん治療における短鎖脂肪酸の医学的応用 |
| 短鎖脂肪酸の大腸がん治療における医学的応用は、活発な研究分野です。糞便細菌叢移植(FMT)は、大腸がんの無菌マウスモデルにおいて、ドナーで観察される免疫チェックポイント阻害剤(ICI)の効果を模倣し、有望な結果を示しました[233]。現在進行中の臨床試験(NCT04729322およびNCT04130763)では、これらの知見をより詳細に検証しています。さらに、糞便細菌叢移植は、免疫チェックポイント阻害剤誘発性大腸炎の難治性患者における治療においても有望な結果を示しています。ビフィドバクテリウムやラクトバチルス・ロイテリなどのプロバイオティクスも、免疫チェックポイント阻害剤誘発性大腸炎の緩和に効果があることが示されています[234,235]。さらに、特定のプロバイオティクスが大腸がんのマウスモデルで免疫チェックポイント阻害剤の効能を高めることがわかっています[236]。 ラクトバチルス・ラムノサス・プロバイオM9と、グアノシン、α-ケトグルタル酸(α-KG)、6-ヒドロキシ-3-スクシニルピリジン、N-アセチル-L-グルタミン酸、ピリドキシン、ドーパキノン、キサントシン、アルドステロン、L-トレオ-3-メチルアスパラギン酸、3′-アエニル酸、アデノシン5′-二リン酸、オレアンドリド、テルペンテジエニル二リン酸などのブレンドは、マイクロサテライト不安定性が高い大腸がんとマイクロサテライト安定性大腸がんの両方のマウスモデルで免疫チェックポイント阻害剤の有効性を高めることがわかっています。 進行中の臨床試験(NCT04208958)では、これらの効果をさらに調査しています[236]。試験管内研究では、ラクトバチルス属およびその代謝物が薬剤耐性大腸がん細胞の化学療法に対する感受性を高める可能性があることが示されています[237,238]。食物繊維および酪酸などのその代謝物は、大腸がん同種移植モデルにおける抗PD-1療法の有効性を高めることが示されています[239]。さらに、遺伝子組み換えプロバイオティクスおよびフソバクテリウム ヌクレアタムを標的とする選択的バクテリオファージは、免疫チェックポイント阻害剤活性を高め、大腸がんの動物モデルにおける化学療法の転帰を改善する可能性があります[239–241]。最近の研究では、腫瘍の微小環境の調整における短鎖脂肪酸の役割も調査されています。例えば、酪酸は細胞周期停止とアポトーシスを誘導することで大腸がん細胞の増殖を阻害することが示されています[242]。さらに、プロピオン酸はエピジェネティック修飾の重要な酵素であるタンパク質アルギニンメチルトランスフェラーゼ1のダウンレギュレーションによって大腸がんのアポトーシスを誘導することがわかっています[243]。 |
| 10. 結論と今後の展望 |
| 腸内細菌叢の構成における個人差は、食事、年齢、健康状態などの要因の影響を受けますが、ヒト腸内細菌叢全体の複雑さは比較的安定しています。特定のマイクロバイオームの変化は、大腸がんとの関連性がますます高まっています。大腸がんは、病原性微生物叢とゲノムレベルおよびエピゲノムレベルでの宿主反応の破綻との間の相互作用の激化に起因する可能性が示唆されています。腸内細菌叢研究は大きく進歩しているものの、依然として取り組むべき課題が残っています。現在の微生物分類群のメタゲノムアノテーションは、典型的には属または種レベルにとどまっており、大腸がんの病因およびそのメカニズムに関与する特定の菌株を特定するには不十分です。様々な腸内微生物に関連するメタボロミクスは、宿主と相互作用し、がんの発生と予防に大きな影響を与えることが示されている。マルチオミクスアプローチとデータマイニングアルゴリズムを用いて微生物株を特定するには、さらなる研究が必要です。さらに、大腸がん研究のほとんどは横断的であるため、腸内細菌叢の動的な変化と大腸がんとの因果関係に関する知見は限られています。したがって、腸内細菌叢が大腸がんの発症に果たす役割をより深く理解するには、異なる集団にわたるマルチオミクスデータを統合し、縦断的な微生物プロファイリングを行うことが不可欠です。大腸がんにおける細菌叢由来短鎖脂肪酸の将来は有望であり、いくつかの重要な領域で潜在的に影響を与える可能性があります。酪酸、プロピオン酸、酢酸などの短鎖脂肪酸は、健康な腸内細菌叢をサポートし、粘膜バリア機能を強化し、炎症を調節することで、大腸がんに対する保護効果があることが示されています。大腸がんを予防するための食事療法またはサプリメント介入における短鎖脂肪酸の利用については、さらなる研究が必要です。さらに、短鎖脂肪酸は大腸がんの補助治療として機能し、腫瘍の増殖、免疫反応、および既存治療の有効性に影響を与える可能性があります。個々の細菌叢プロファイルと短鎖脂肪酸代謝に基づく個別化アプローチは、大腸がんの予防および治療戦略を改善する可能性があります。短鎖脂肪酸が大腸がんの発生と進行にどのように影響するか、特にエピジェネティクスや細胞経路への影響を理解するには、さらなる研究が必要です。短鎖脂肪酸を免疫療法や標的治療などの他の治療法と併用することで、全体的な有効性を向上させ、治療抵抗性に対処できる可能性があります。プロバイオティクス、プレバイオティクス、あるいは食生活の改善を通じて短鎖脂肪酸の産生を高める戦略は、抗がん効果と患者転帰を向上させる可能性があります。大腸がんにおける短鎖脂肪酸をベースとした治療法の安全性、有効性、そして最適な使用方法を判断するには、臨床試験が必要です。全体として、大腸がんにおける微生物由来の短鎖脂肪酸の分野は、予防および治療戦略の進展に大きな可能性を秘めています。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Gut Microbes. 2025 Apr 6;17(1):2483780. に掲載されたThe impact of gut microbial short-chain fatty acids on colorectal cancer development and prevention.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |