
Sevag Hamamah,Andrei Lobiuc,and Mihai Covasa |
要約 |
| 大腸がん(CRC)は、依然として世界的に罹患率と死亡率の大きな要因となっています。腸内微生物組成の乱れ、活性酸素種(ROS)の形成、およびその結果生じる炎症がDNA損傷を引き起こし、大腸がんの発症と進行を促進する可能性があることを示す新たな証拠があります。特に、細菌代謝物は、抗酸化酵素の活性を調節し、活性酸素種誘発性炎症を制御するシグナル伝達経路に影響を与えることで、酸化ストレスを予防するか、または酸化ストレスに寄与する可能性があります。さらに、プロバイオティクスを介して補充された微生物副産物は、腫瘍微小環境に影響を与えて治療効果を高め、活性酸素種誘発性大腸がん細胞の破壊を選択的に媒介することができます。このレビューでは、腸内微生物叢と、短鎖脂肪酸、二次胆汁酸、トリメチルアミン-N-オキシドなどの関連代謝物の分類学的変化が活性酸素種濃度に影響し、炎症媒介大腸がんの発症を予防または促進するメカニズムについて議論することを目的としています。さらに、私たちは、発がんを緩和するために Nrf2-Keap1、NF-κB、NLRP3 など、酸化状態と炎症の両方に影響を与える 活性酸素種媒介シグナル伝達経路を調整するプロバイオティクス種の役割に焦点を当てています。全体として、酸化ストレスに対する腸内細菌叢の役割をより深く理解することで、大腸がんの発症を遅らせたり予防したりするのに役立ち、がん免疫療法などの補助的な 大腸がん固有の治療介入の新たな道が開かれる可能性があります。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 活性酸素種、酸化ストレス、大腸がん |
| 2.1. 抗酸化物質、Nrf2-Keap1、および発がん |
| 2.2. 炎症シグナル伝達、酸化ストレス、および発がん |
| 3. 腸内細菌叢と大腸がん |
| 3.1. 微生物叢、活性酸素種、および大腸がん |
| 3.1.1抗生物質、酸化還元バランス、および大腸がん |
| 3.2. 微生物代謝物、活性酸素種、および大腸がん |
| 3.2.1. 短鎖脂肪酸、活性酸素種、および大腸がん |
| 3.2.2. 二次胆汁酸、活性酸素種、および大腸がん |
| 3.3. トリメチルアミン-N-オキシド、酸化ストレス、および大腸がん |
| 4.プロバイオティクス、抗酸化特性、および大腸がん |
| 4.1. プロバイオティクス、抗酸化酵素、大腸がん |
| 4.2. プロバイオティクス、抗酸化シグナル伝達経路、および大腸がん |
| 4.3. プロバイオティクス、活性酸素種媒介炎症シグナル伝達経路、および大腸がん |
| 4.4. プロバイオティクス、抗酸化物質、大腸がんの免疫療法および治療 |
| 5. 結論と展望 |
| 本文 |
| 1.はじめに |
| 大腸がんは、がん関連死の第2位、世界で3番目に多く診断されるがんとして、一貫して世界の死亡率に寄与しています[1]。185か国から36種類のがんに関するデータを含む、Global Cancer Observatory(GLOBOCAN)による最近の研究では、2022年には大腸がんが新規がん症例の9.6%、新規がん死亡の9.3%を占めると推定されています[2]。GLOBOCANはまた、大腸がんの年間発生率が2020年の190万件から2040年までに360万件に増加し、大腸がん関連死亡者数は同期間に93万人から160万人に増加すると予測しています[3]。 大腸がんと診断される人の大半は70歳以上ですが[4]、近年50歳未満の大腸がん発症率が上昇しており、米国がん協会はより早期のスクリーニングを推奨しています[5]。この疾患は世界中で大きな負担となっており、死亡率も高いため、大腸がん発症の要因を理解し、予防策を改善するための重要な研究が行われています[6,7]。現在、大腸がん発症の修正不可能な危険因子には性別、人種、遺伝、炎症性腸疾患の存在などがあり[7]、修正可能な危険因子には食習慣、運動不足、肥満、喫煙などがあります[6]。腸内細菌叢と総称される腸内細菌の組成が、これらの修正可能な危険因子の重要な媒介物として作用することで、大腸がん発症に影響を及ぼしたり、発症を防いだりできるという新たな証拠が出てきています[8,9,10]。例えば、動物モデルに高脂肪食を導入すると、微生物組成の大幅な変化を通じて腫瘍形成が誘発されることが示されており、Alistipesなどの病原性および炎症性の微生物種が増加し、Parabacteroides などのプロバイオティクス細菌が減少する [11]。喫煙は腸内細菌叢に同様の悪影響を及ぼし、Eggerthella lentaなどの種が増加し、ParabacteroidesとLactobacillusが減少することで、結腸上皮における発がん性シグナル伝達が活性化される [9]。微生物組成のこれらの変化が 大腸がんの発生を促進するメカニズムは複数提案されており、炎症性シグナル伝達 [12]、有害代謝物の生成による直接的または間接的な DNA 損傷 [13,14]、ヒストン修飾 [15]、発がん性遺伝子の上方制御 [11]、治療に対する腫瘍抵抗性の誘発 [16]、活性酸素種の形成促進 [17] などが挙げられるが、これらに限定されない。 |
| 特に興味深いのは、活性酸素種の持続的な増加が二次メッセンジャーとして働き、腫瘍形成とがんの進行を誘発することで、発がん性シグナル伝達経路を活性化する上で中心的な役割を果たしていることです[18]。興味深いことに、微生物叢は、特にディスバイオシス(腸内細菌叢の乱れ)の状態において、活性酸素種と酸素フリーラジカル生成の重要な調節因子です[19]。そのため、常在細菌種は抗酸化特性を通じて炎症性シグナル伝達を抑制できるのに対し、病原性細菌種は逆の効果を発揮することが実証されています[20]。さらに、腸内微生物組成も酸化ストレスの増加状態の影響を受けることが示されており、大腸がん関連細菌は微小環境の圧力から身を守るためにトランスクリプトーム(訳者注:トランスクリプトームとは、特定の状況下において細胞中に存在する全てのmRNAの総体を指す呼称です)を適応させ、炎症性腸内微生物叢の蔓延につながります[17]。例えば、酸化ストレスが増加したがん性微小環境由来の大腸菌は、非がん性大腸菌と比較して、毒性、宿主定着、代謝物の取り込み、生存率を誘導する遺伝子の活性化がより顕著であった[17]。腸内細菌叢と酸素フリーラジカルのこの相互影響を考慮すると、プロバイオティクスは抗酸化特性を持つ補助療法として登場した。プロバイオティクスは、抗酸化および抗炎症シグナル伝達経路を増強し、抗酸化微生物由来代謝物の産生を促進し、抗酸化酵素の活性を高めることで、酸化ストレスを軽減することができる[21]。これまでの研究では、炎症性腸疾患におけるプロバイオティクス投与の役割が強く支持されており[22,23]、炎症誘発性大腸がんにおける抗増殖および抗炎症効果が実証された証拠が蓄積されている[24,25,26,27,28]。 |
| このレビューでは、腸内細菌叢の好ましくない分類学的変化が活性酸素種の持続的な増加を引き起こし、炎症性シグナル伝達とその結果生じる発がんを引き起こすメカニズムを示す新たな証拠を紹介します。まず、大腸がんに関連する腫瘍形成における 活性酸素種と酸素フリーラジカルの役割について簡単に説明します。その過程で、大腸がんモデルで 活性酸素種形成に寄与し酸化状態を調節する主要な腸内微生物種と重要な微生物由来代謝物を特定します。最後に、抗酸化酵素濃度を高め、活性酸素種媒介炎症シグナル伝達を緩和することで酸化ストレスを軽減し、炎症性大腸がんの予防と治療を支援するプロバイオティクスの役割について説明します。 |
| 2. 活性酸素種、酸化ストレス、大腸がん |
| 基底状態では、活性酸素種は必須のシグナル分子として機能し、成長因子、転写、免疫調節の媒介を含む細胞生理学のさまざまな側面を制御します[29]。内因的には、活性酸素種の大部分は酸化的リン酸化とミトコンドリア電子伝達系を介して生成され、ニコチンアミドアデニンジヌクレオチドリン酸酸化酵素(NOX)、一酸化窒素合成酵素(NOS)、キサンチン酸化酵素(XO)、シクロオキシゲナーゼ(COX)、リポキシゲナーゼなどの酸化促進酵素も追加的に寄与します[30,31]。大気汚染、放射線、食事、喫煙、薬物などの外因性要因も、細胞内活性酸素種の総量に大きく寄与します[32]。過剰になると、活性酸素が蓄積し、その結果生じる酸素フリーラジカルと抗酸化物質の不均衡により、正常な細胞生理機能が病的に破壊されます[33,34]。具体的には、酸化ストレスは細胞損傷、DNA変異、炎症性ストレス、成長因子の調節異常を引き起こし、これらが組み合わさって腫瘍形成につながることが示されています[29]。 |
| 大腸がんに関しては、研究により、腫瘍形成が活性酸素種の蓄積と直接関連して起こる可能性のある潜在的なメカニズムが解明されています[35,36]。重要なことに、活性酸素種媒介経路はDNA損傷と、それに続くp53(訳者注:p53遺伝子とは、一つ一つの細胞内でDNA修復や細胞増殖停止、アポトーシスなどの細胞増殖サイクルの抑制を制御する機能を持ち、細胞ががん化したときアポトーシスを起こさせるとされる)、APC(訳者注:APC遺伝子は、細胞のがん化にブレーキをかける物質を作るための情報です)、BRAF(訳者注:BRAF遺伝子の600番目のアミノ酸のバリンがグルタミン酸に変化し、がんを増殖させる遺伝子変異です)などの大腸がん病理でよく見られる腫瘍形成性変異を誘発することが示されている[37]。ヒトの大腸腫瘍の50%以上はp53変異に由来すると推定されており[38]、DNA塩基の酸化がグアニンおよびシトシンとアデニンおよびチミン塩基の誤対合に寄与しています[39]。具体的には、グアニンおよびシトシン塩基のDNA酸化により、それぞれ8-オキソグアニンおよび5-ヒドロキシシトシンが形成され、DNA複製中に誤対合と高い変異率につながります[35]。興味深いことに、大腸がん患者の尿中の8-オキソグアニン濃度は健康な対照群と比較して高いことが報告されており、これはおそらくミスマッチ塩基のDNA切除率の増加とそれに続く排泄によるものと考えられる[40]。 |
| さらに、脂質過酸化も大腸がん発症の強力な誘発因子である[36,41]。脂質過酸化経路の副産物は、大腸炎関連大腸がんで最も有意に増加するものの1つである[36]。例えば、エポキシケトオクタデセン酸(EKODE)の低用量投与は、NF-κBやc-Jun N末端キナーゼ(JNK)などの炎症性シグナル伝達経路を介して、大腸がん発症とともに腸バリア機能不全、リポ多糖、細菌転座を悪化させることがわかっている[36]。同様の結果は、4-ヒドロキシノネナール(4-HNE)や12,13-エポキシオシアデセン酸(EpOME)などの他の脂質過酸化副産物でも観察されており、どちらも炎症を増強し、大腸腫瘍形成に寄与している[42,43]。タンパク質も酸化ストレスの影響を受け、その構造の変化が大腸がんの発症に寄与する可能性があります。硫黄含有アミノ酸(システインとメチオニン)は容易に酸化され、特に重要な酵素、構造タンパク質、受容体などの分解されないタンパク質凝集体の形成につながります[44]。比較研究により、腫瘍形成に関連する酸化感受性システインを含む31のタンパク質が特定され、システイン酸化は大腸がん関連の変化と相関していることがわかりました[45]。したがって、調節不全のタンパク質分解システムは大腸がんの特徴であり、これらの経路を標的とすることががん治療において最近注目されています[46]。 |
| 活性酸素種の蓄積は大腸がん細胞に発がん性変化をもたらすことが示されているが、研究者らは 活性酸素種のアポトーシスおよび老化誘導能力を抗がん治療法として利用している [47]。腫瘍微小環境内では、がん細胞の制御されない増殖により ATP 必要量が増加し、同時に酸化的リン酸化および 活性酸素種濃度が上昇する。しかし、がん細胞では内因性抗酸化物質の活性化も上昇し、酸化ストレスを非がん細胞と同等のレベルまで低下させる。がん細胞内での活性酸素種生成の二重性に注意することは重要であり、中程度の 活性酸素種レベルはがんの生存と増殖を誘導する可能性がある一方で、活性酸素種の過剰はアポトーシスと腫瘍細胞の優先的な破壊を誘導する [48]。 活性酸素種の毒性蓄積は小胞体ストレスにつながり、アポトーシス経路を誘発します。最も顕著なのは、イノシトール要求酵素1(IRE1)シグナル伝達を介してオートファジーと老化を誘導することです[49]。これらの知見を総合すると、大腸がん細胞生理学における活性酸素種の多様性と酸化還元バランスの重要性が強調されます。 |
| 2.1. 抗酸化物質、Nrf2-Keap1、および発がん |
| 大腸がんの病態形成における活性酸素種蓄積の発がん促進作用を考慮すると、細胞の抗酸化防御機構は酸化ストレスを軽減する上で重要な役割を果たします[50]。最近の大規模研究では、抗酸化物質への曝露量の増加とそれに伴う酸化バランスが大腸がんの発症と負の相関関係にあることが示唆されています[51]。 |
| 真核細胞は、酸化ストレスや電子ストレスからさらに防御するために、Nrf2-Keap1経路(訳者注:KEAP1-NRF2 経路は、酸化ストレスおよび電子親和性ストレスに対する主要な保護反応です)を利用して抗酸化応答要素(ARE)と関連遺伝子ネットワークを活性化し、抗酸化酵素の産生を促進します[52]。ストレスのない酸化環境では、ケルチ様ECH関連タンパク質1(Keap1)は核因子エリスロイド2関連因子(Nrf2)に結合して阻害します。あるいは、酸化ストレスの状態ではKeap1の構造変化が誘導され、Nrf2(訳者注:Nrf2(ナーフツー)は、酸化ストレスや親電子性物質などの発生に伴い活性化される転写因子で、細胞を保護する働きがあります)が放出され、それが核に移行して抗酸化応答要素(ARE)を活性化します[52]。 抗酸化応答要素(ARE)の活性化は、スーパーオキシドディスムターゼ(SOD)、カタラーゼ(CAT)、グルタチオンペルオキシダーゼ(GPx)、グルタチオン-S-トランスフェラーゼ(GST)、ヘムオキシゲナーゼ1(HO-1)などの抗酸化酵素の転写を開始し、酸化還元不均衡とフリーラジカルによる損傷を軽減します[53](図1)。 |
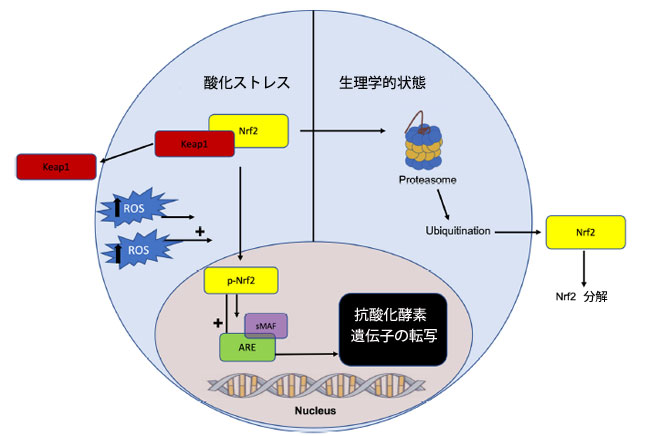 |
図 1 Nrf2-Keap1 経路と抗酸化酵素転写の可視化。 酸化ストレス下では、Nrf2 はリン酸化され、Keap1 から解離します。リン酸化 Nrf2 はその後核に移行し、そこで小筋腱膜線維肉腫 (sMAF) に結合して抗酸化応答エレメント (ARE) を活性化します。これにより、スーパーオキシドディスムターゼ、カタラーゼ、グルタチオンペルオキシダーゼ、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ 1 などの抗酸化酵素遺伝子の転写が開始されます。逆に、生理学的条件下では、Keap1 は Nrf2 をプロテアソーム分解の標的とし、抗酸化酵素転写は上方制御されません。 略語: Nrf2、核因子赤血球 2、Keap1、ケルチ様 ECH 関連タンパク質 1、ROS、活性酸素種、p-Nrf2、リン酸化 Nrf2、ARE、抗酸化応答要素、sMAF、小型筋腱膜線維肉腫。 |
| Nrf2-keap1抗酸化経路の発がんにおける重要性は、対照群と比較して酸化毒性と著しい炎症を示すNrf2ノックアウトマウスを用いた研究を通じて実証されている[54,55]。より具体的には、大腸炎関連大腸がんのアゾキシメタン/デキストラン硫酸ナトリウムモデルにおいて、Nrf2ノックアウトはより高い腫瘍発生率と関連しており、大腸がん発症の緩和におけるNrf2依存性炎症抑制の重要な役割を示している[54]。Nrf2欠損マウスにおける炎症マーカーと酸化マーカーの増加は腸陰窩細胞の増殖を促進し、発がんにつながる変異のリスクと存在を増加させた[54]。同様に、Nrf2欠損マウスを用いた別の研究では、腫瘍細胞の発生率が高いことが示され、大腸がん腫瘍サンプルにおける予後不良を示す23の新規Nrf2関連遺伝子が特定された[55]。加齢によってNrf2の活性も調節不全となり、活性酸素を介したDNA損傷や変異を介して腫瘍形成が増加します[56]。これもまた、大腸がんの発症や高齢世代での有病率上昇に関与している可能性があります。真核生物の染色体の保護キャップであるテロメアは、酸化ダメージを受けやすく[57]、Nrf2の調節不全や酸化還元状態の不均衡と相まって、酸化ストレスは突然変異、ゲノム不安定性、発がんにつながる可能性があります[56]。 |
| Nrf2 経路は酸化ストレスを緩和して大腸がんの発生を防ぐために必要ですが、完全に悪性化した細胞は過剰な Nrf2 シグナル伝達に反応して逆の運命を示します [58]。具体的には、Nrf-2 活性は化学療法に対するがん抵抗性を誘導し、活性酸素種媒介がん細胞破壊から保護することで腫瘍の成長を促進する可能性があります [58,59]。抗大腸がん療法としてアルファヘデリン(訳者注:α-ヘデリンは、ニゲラ・サティバの種子とヘデラ・ヘリックスの葉に含まれる水溶性の五環性トリテルペノイド・サポニンです)を使用した最近の研究では、Nrf2-Keap1 経路の活性化が低いほど、特に腫瘍微小環境の調節における役割により、より良い治療結果をもたらすことが観察されました [60]。興味深いことに、Nrf2-Keap1 経路活性化の腫瘍対正常組織の比率は、大腸がんにおけるリンパ血管浸潤にも関連付けられています [61]。発がん因子は Nrf2 の分解を防ぐために Nrf2-Keap1 複合体の構造変化を促進すると仮定されています [62,63]。そのため、大腸がん細胞はNrf2の異常な活性化を誘導し、腫瘍微小環境内の酸化ストレスを軽減して生存率を高めます[64]。過剰なNrf2活性は化学療法抵抗性を悪化させ、予後を悪化させることから、この状況ではNrf2阻害剤が抗がん剤として働く可能性があることが示唆されています[63]。 |
| 2.2. 炎症シグナル伝達、酸化ストレス、および発がん |
| 最近の研究では、炎症性腸疾患の発症とその後の発がん進行に関連する酸化ストレス関連の遺伝的リスク遺伝子座が特定されています[70]。ゲノムワイド関連研究では、NADPHキノン酸化還元酵素(NQO1)およびスーパーオキシドジスムターゼ2(SOD2)遺伝子内の多型が明らかになりました。NADPHキノン酸化還元酵素多型は抗炎症治療抵抗性と関連しており、スーパーオキシドジスムターゼ2の変異は潰瘍性大腸炎患者の発症年齢の早期化と相関しています[71]。さらに、メタアナリシスでは、GST M1ヌル遺伝子型変異が特定の集団で炎症性腸疾患の感受性を高めるが[72,73]、他の集団ではそうではないことが示されています[74]。 潰瘍性大腸炎の感受性と進行の両方に関連する別の遺伝子座は、核因子赤血球由来2様2(Nfe2L2)遺伝子によってコードされるNrf2転写因子であり、これは制御されていない活性酸素種産生を介して炎症を誘発する可能性があります[75]。さらに、7番染色体内のパラオキソナーゼ(PON)遺伝子座は炎症性腸疾患の発症と関連しており、位置192の単一アミノ酸変異(アルギニンからグルタミン)は、この病気に対する感受性または防御に統計的に有意な差を示しています[76]。 |
| 炎症性腸疾患における慢性炎症は、染色体不安定性、マイクロサテライト不安定性、および過剰メチル化によって開始される p53 または APC 経路を介した腸上皮細胞異形成を含む複数のメカニズムを介して発がんを誘発します [77]。酸化ストレスは、ヌクレオチド結合ドメイン、ロイシンリッチ含有ファミリー 3 (NLRP3)、核因子カッパベータ (NF-κB) などの炎症誘発シグナル伝達経路を誘発し、これらは腸バリアを恒常的に損傷し、異形成形質転換に対する感受性の増加を通じて間接的に大腸発がんに寄与します [78,79]。より具体的には、NLRP3 インフラマソーム活性化に対する酸化酵素ストレスの影響は、ミトコンドリア NADPH 酸化酵素活性の増加と小胞体ストレスに起因します [80,81]。例えば、大腸炎を誘発した大腸がんマウスでは、高コレステロール食はミトコンドリア活性酸素種を介したNLRP3インフラマソームの上方制御を介して腫瘍形成を増加させた[82]。具体的には、NLRP3-ASCアセンブリはIL-1β濃度を増加させ、慢性炎症を増強し、異形成を誘発した[82]。興味深いことに、ミトコンドリア活性酸素種はNLRP3のエンドソーム構造への再配置に直接寄与し、そのアダプター分子であるASCとの相互作用を開始し、インフラマソームを活性化する[83]。次に、NLRP3の過剰活性化は、腸管上皮細胞内の炎症性サイトカインの上方制御、持続的なマクロファージ活性、およびエフェクターT細胞のリクルートメントを介して大腸炎を誘発する[84]。これは発がんに強い影響を及ぼし、大腸がん腫瘍はNLRP3の強い発現を示すマクロファージに密集して囲まれているため、細胞の移動、浸潤、転移が促進され、予後が悪くなる[85]。 |
| NF-κB(訳者注:NF-κBは、細胞の核内で遺伝子の発現に関わる転写因子で、感染やストレスなどの刺激に対する細胞応答や免疫応答の調節に重要な役割を果たしています)の炎症促進作用と免疫調節作用を理解することも大腸がんの発症において極めて重要である[86]。酸化ストレスは、活性酸素(特に過酸化水素)としてNF-κBの活性を調節し、核因子κB阻害剤(IκB)をリン酸化してNF-κBの放出と核への移行を引き起こす[87]。その後のNF-κBの活性化は、サイトカイン転写やインフラマソーム活性化などの自然免疫と獲得免疫応答の主要成分を制御し、調節不全になると炎症性腸疾患の特徴となる[88]。より具体的には、NF-κB活性化の副産物には、腫瘍壊死因子αやインターロイキン-1などの炎症性サイトカインの誘導、CXCL12やCXCL13などのケモカインの放出、血管新生や炎症に関与する複数の転写因子の活性化、カドヘリンなどの接着分子の発現の変化、抗菌ペプチドの分泌など、幅広い細胞プロセスが含まれます[89,90]。興味深いことに、NF-κBの発現は、炎症性腸疾患患者と比較して大腸がん患者で比較的上昇していることがわかっており、腺腫からがんへの形質転換におけるその役割を裏付けています[91]。NF-κBシグナル伝達経路は、大腸がんの大部分を占めるp53、BRAF、APC遺伝子の変異など、特にがん原性変異と関連しています[92]。 NF-κBシグナル伝達は細胞周期の進行にも関与しており、その調節異常は増殖遺伝子の恒常的発現を誘導する[93]。NF-κB活性化の抑制はG0/G1期での細胞周期停止を誘導し、大腸がんの増殖を減少させることが示されている[94]。NF-κB阻害剤はまた、IκBリン酸化を阻害することにより、炎症性微小環境における大腸がん細胞のIL-1誘導増殖を抑制する[95]。したがって、炎症由来の大腸がん発症に対する抗炎症および抗増殖効果を誘発するためにNF-κB経路を標的とすることは正当化される[96]。 |
| Nrf2を介した経路はNF-κBの活性化を阻害し、炎症誘発性大腸がんの発症を緩和するのに役立つ可能性もある[97]。具体的には、酸化ストレスに反応したNrf2の活性化は、強力な酸化剤であるヘムを鉄、ビリベルジン、二酸化炭素に分解するHO-1活性を誘導する[98]。同時に、これらの副産物、特に二酸化炭素への分解は、NF-κBの核への移行に悪影響を及ぼし、経路のダウンレギュレーションと炎症効果をもたらす[99]。このように、Nrf2を介した抗酸化シグナル伝達は、大腸がん発症の際のNF-κB誘発性炎症および関連する炎症性損傷の程度を緩和する上で重要な役割を果たしている。 |
| 3. 腸内細菌叢と大腸がん |
| ヒトの消化管内には、数兆(1013~1014)の常在微生物が生息していると推定されています [100]。この腸内微生物の集合体は腸内細菌叢と呼ばれ、そのゲノム構成全体は腸内マイクロバイオームと呼ばれています [100]。腸内細菌叢は、健康的または好ましい構成が維持されると、免疫調節、エネルギー恒常性、腸内細菌病原体の過剰増殖からの保護、腸管バリア透過性の低下など、宿主の生理機能に無数の有益な効果をもたらします [101,102,103]。腸内細菌叢の構成は、個人の生涯を通じて環境要因と遺伝要因の両方の影響を受け、食事、抗生物質の使用、出産時の分娩方法、地理的な場所、年齢、家族の遺伝が重要な役割を果たします [104]。腸内細菌叢の組成構成には多因子の影響があるため、その変動は一般的であり、肥満、脂質異常症、2型糖尿病、神経精神疾患、炎症性腸疾患、さらにはがんを含む複数の病態に関連しています[105,106,107,108]。過去数十年にわたり、ディスバイオシス(腸内細菌叢の乱れ)の状態と大腸がんとの関連を示す重要なデータが得られており、大腸がんのバイオマーカーとして機能する可能性のある微生物種の特定の分類学上の変化と傾向、および大腸がんの診断と進行に関連する種が特定されています[11,109]。これらの傾向には、Fusobacterium nucleatum、Porphyromonas gingivalis、Megamonas funiformis、Bacteroides vulgatus、Bacteroides stercoris、Ruminococcus gnavus、Dorea longicatena、Escherichia coli、Clostridium、Atopobium parvulum、およびActinomyces odontolyticus [109,110,111,112,113] の相対的存在量の増加が含まれ、Lacticaseibacillus paracasei、Clostridium butyricum、Streptococcus thermophilus、Faecalibacterium prausnitzii、Roseburia intestinalis、およびEubacterium rectaleなどの保護種の全体的な存在量の減少が含まれます [114,115,116,117]。 |
| 微生物組成の変動に挙げられているもののうち、最も裏付けのある証拠はFusobacterium nucleatum[118]であり、大腸がんの早期から後期の患者の糞便サンプルで一貫して増加しています[110]。たとえば、APC遺伝子変異を持つマウスにFusobacterium nucleatumを導入すると、大腸がんにおける骨髄細胞浸潤と炎症誘発性シグナル伝達を介して腫瘍形成が加速されました[119]。メカニズム的には、Fusobacterium nucleatumは、大腸がんに関連するマイクロRNAの遺伝子発現を変化させる[120]、オートファジーを破壊する有害な代謝物を生成し[121]、NF-κB経路を介して炎症性シグナル伝達を活性化する[122]など、複数のモダリティを介して腫瘍形成効果を発揮すると説明されています。腫瘍形成を補助することに加えて、Fusobacterium nucleatum は、がん転移遺伝子の上方制御、mRNA のメチル化、および腫瘍細胞へのマクロファージ浸潤の誘導を含む NF-κB 依存性メカニズムを介して腫瘍転移に寄与します [123,124,125]。同様に、Fusobacterium nucleatum の濃度は、免疫チェックポイント阻害剤を標的としたがん免疫療法を調節することが示されており、マウスモデルにおける細菌の相対的存在量と PD-L1 阻害との間には直接的な相関関係があります [126]。最近のデータでは、細菌がフェロトーシス、ピロトーシス、およびアポトーシスを阻害することによって化学療法抵抗性を誘導できることも示されており [127,128,129]、この種は病因と治療法の増強の両方を理解する上で非常に重要です。 |
| Fusobacterium nucleatum に加えて、他の微生物種も大腸がんのさまざまなステージと重要な関連があることがわかっています。たとえば、研究では、Atopobium parvulum と Actinomyces odontolyticus が共存し、粘膜内および多発性ポリープ状腺腫で増加することが示唆されています [110]。システインデスルファラーゼ活性を持つ細菌である Atopobium parvulum は、腸内での硫化水素形成を促進し、結腸細胞に有毒となる可能性があります [130]。早期 大腸がんにおける Atopobium parvulum の増加とそれに伴う硫化水素の過剰産生も、Fusobacterium nucleatum などの他の硫化水素産生種と相まって、腸内微生物叢のさらなる破壊と大腸がんの進行につながります [121,130]。さらに、大腸がん発症における原因菌種の解析により、Fusobacterium nucleatum、Peptostreptococcus anaerobius、Bacteroides fragilis、Parvimonas micra、Xanthomonas perforans、Clostridium symbiosumなど、大腸がん発症の潜在的なバイオマーカーとなり得る複数の菌種が特定されている[112,131]。同様に、Bacteroides massiliensis、Bifidobacterium pseudocatenulatum、Corynebacterium appendicis、Alistipes onderdonkiiは、非がん組織と大腸がん組織を区別するのに役立つ可能性のあるバイオマーカーとして特定されている[132]。さらに、Porphyromomnas gingivalisなどの菌種は大腸がん発症に関連しているだけでなく、患者の予後に関する知見も提供している[111,133]。 Porphyromomnas gingivalisはNLRP3インフラマソームの活性化を介して発がんを誘発し、炎症性大腸がん発症を促進します[111]。予後との関連では、糞便サンプル中のPorphyromomnas gingivalisが有意に増加した患者は、がん特異的生存率が低下することが研究で示されています[133]。これらを総合すると、腸内細菌叢と大腸がんの病因、治療、同定、予後との間に複雑な相互作用があることを示す強力な証拠があります。 |
| 3.1. 微生物叢、活性酸素種、および大腸がん |
| 前述のように、活性酸素種と酸化ストレスの存在は、腸管上皮への直接的な酸化損傷[135]を通じて、大腸がん発症の重要なリスク因子として機能する腫瘍形成促進性の腸管環境を作り出します[134]。微生物叢は、さまざまな種の相対的存在量と腸管微小環境に応じて、正にも負にも酸化還元状態の重要な調節因子として機能します[136,137]。酸化損傷による腸管バリアの破壊は透過性を高め、病原性微生物叢と代謝物の転座を可能にし、炎症関連大腸がんを引き起こす可能性があります[138]。さらに、腸管バリアの損傷は、制御不能な炎症性腸状態に寄与する可能性のある遺伝毒性または環境変異原に対する腸管幹細胞の感受性を高めます[139]。 |
| Peptostreptococcus anaerobius, Enterococcus faecalis, および Bacteroides fragilisなどの特定の腸内細菌叢は、その酸化力と酸化還元特性を通じて発がん性に影響を及ぼします[140,141,142]。Peptostreptococcus anaerobius,は、活性酸素種レベルを上昇させて腫瘍微小環境を調節し、炎症誘発経路を介して腸異形成を誘発します[141]。具体的には、コレステロール生合成経路と細胞増殖は、Peptostreptococcus anaerobius,代謝物がToll様受容体2(TLR-2)とToll様受容体4(TLR-4)に結合することに反応して上方制御され、活性酸素形成を促進します[141]。活性酸素種はこれらのプロセスの中間体として特定されており、抗酸化物質の導入やTLR-2またはTLR-4のノックダウンにより細胞増殖とコレステロール生合成の両方が改善される[141]。さらに、腸管毒素原性Bacteroides fragilis(ETBF)はBacteroides fragilis毒素(BFT)として知られる亜鉛依存性メタロプロテアーゼ毒素を分泌し、これは腸炎の誘導を通じて結腸上皮細胞の増殖と強く関連している[143]。具体的には、Bacteroides fragilis毒素は結腸上皮細胞上の受容体に結合し、Eカドヘリンの切断、Wingless関連統合部位(Wnt)シグナル伝達の増強、炎症性サイトカインの放出などの発癌関連変化を引き起こします[143]。特にE-カドヘリンは、上皮細胞上の接着分子として細胞間相互作用を促進するため、大腸がんやその他のがんに関与していると考えられています。その機能喪失は、大腸腺腫の形成と相関しています[144]。同時に、Bacteroides fragilis毒素によって誘発される一連の変化は、結腸バリアの透過性を悪化させ、DNA損傷を誘発し、大腸がんの転移能を高めます[143]。さらに、腸管毒素原性Bacteroides fragilisは、スペルミンオキシダーゼ(SMO)酵素を介して炎症刺激を駆動し、腫瘍形成を誘発します[140]。スペルミンオキシダーゼはスペルミンを酸化してポリアミンを異化しますが、炎症刺激はその酵素活性の主な刺激として機能します[145]。その酸化副産物は過剰になると細胞毒性があり、重大なDNA損傷を引き起こし、乳がん、胃がん、大腸がんを含むさまざまながんの発生を引き起こします[146,147,148]。マウスモデルでは、Bacteroides fragilis毒素がスペルミンオキシダーゼを上方制御し、その活性酸素種副産物を介してDNA損傷を誘発します[140]。さらに、発がんとの酵素的関連性を考慮して、新しいスペルミンオキシダーゼ阻害剤が細胞増殖と遊走の抑制に非常に有効であることが研究されています[149]。同様に、Enterococcus faecalisは、その酸化能力により大腸がん発症の要因であると考えられています[142]。この細菌は細胞外スーパーオキシドを産生することがよく知られており、マウスの結腸上皮細胞で異数性、四倍体性、細胞周期停止などの染色体不安定性を引き起こします[150]。 |
| 大腸がん関連種は、酸化環境の形成に寄与するだけでなく、生存率を向上させるための固有の適応メカニズムを通じて酸化ストレスから身を守っています[17,151]。Fusobacterium nucleatumは、酸化ストレスの微小環境に耐え、標的組織への持続的な生存、付着、侵入を可能にする絶対嫌気性菌です[151]。最近まで、この細菌は過剰な活性酸素種に対処できることが知られていましたが[152]、そのメカニズムは解明されていませんでした。最近の研究では、Fusobacterium nucleatumに、メチオニンスルホキシド還元酵素(MsrAB)、ModRとして知られる2成分シグナル伝達システム、および異なるタンパク質をコードする5つの遺伝子座が特定されました[151]。この多重遺伝子座の重要性は、ModRによるメチオニンスルホキシド還元酵素の調節によって示され、活性酸素種媒介破壊に対する耐性と、大腸がん上皮細胞への細菌の付着または侵入に関連する毒性の増加を付与します[151]。 Fusobacterium nucleatumに加えて、Escherichia coli も、がん性細菌と非がん性細菌で観察される異なる調節および耐性応答で酸化環境に適応します[17]。 これは、酸化ストレス誘導によるEscherichia coli の固有のアルギニン脱炭酸酵素(AdiA)酵素の上方制御によって実証されています[17]。 アルギニン脱炭酸酵素は、細菌種の生存率を高めるために酸化圧力に耐える重要な酵素として説明されています[153]。 総合すると、これらの研究は、腸内細菌叢の傾向が大腸がんに見られる酸化環境に影響を及ぼすこと、およびその逆を裏付ける強力な証拠を提供します。 |
| 3.1.1抗生物質、酸化還元バランス、および大腸がん |
| 大腸がんの病因で観察される分類学的傾向と同様に、抗生物質の使用による微生物叢の枯渇の影響と、特に酸化還元不均衡の文脈での発がんとの関係について簡単に議論することが重要です。特に、大規模コホート研究の結果は、幼少期の抗生物質の使用が、特に 50 歳未満の個人において、すべての年齢層で大腸がんの発症リスクの増加と有意に関連していることを示唆しています [154]。さらに、6 つの研究の最近のメタ分析では、抗生物質への曝露レベルが最も高い個人は、抗生物質への曝露レベルが最も低い個人と比較して、大腸腫瘍を発症するリスクが 10% 高いという結論が出ています [155]。このリスク増加は、抗生物質を介した発がん性耐性細菌種の選択と、効果的な DNA 修復メカニズムを欠くストレス耐性がん細胞が部分的に二次的に生じると考えられています [156]。 |
| 抗生物質投与後、これらの耐性菌と DNA 変異は浸透します。これは、Fusobacterium nucleatum と Escherichia coli のサブタイプが複数の抗生物質クラスに耐性を示した研究によって証明されています [157,158]。発がんに関連する腸内微生物種の過剰増殖を可能にすることに加えて、げっ歯類モデルの研究では、抗生物質の使用が好ましくない腸内微生物叢の影響を増強する可能性があることが示されています [159]。たとえば、さまざまな抗生物質クラスが、接着性侵襲性Escherichia coli (AIEC) の増加量を増加させ、慢性感染したマウスでのさらなる増殖を促進することが示されています [159]。重要なことは、抗生物質の使用によって引き起こされる炎症が反応性窒素種の上方制御を引き起こし、酸化代謝物の生成につながり、これがこれらの病原菌に適応上の利点をもたらし、それらの増殖を促進することです [159]。ただし、すべての抗生物質が発がん性変化に寄与するわけではありません。例えば、独特の抗炎症および抗酸化特性を持つマクロライド系抗生物質エリスロマイシンは、化学予防効果があることが実証されている[160]。研究によると、エリスロマイシンはNF-κBの活性化を阻害することで炎症誘発シグナルを抑制し、その結果、大腸がん細胞株におけるインターロイキン-6やシクロオキシゲナーゼ2などの下流標的の発現を減少させることが示されている[160]。シクロオキシゲナーゼは酸化ストレスの誘導因子であることを考えると[161]、その発現の有意な減少は近位腸ポリープにおける酸化ストレスの減少を示唆しており、対照群と比較して最大70.9%減少した[160]。 |
| 抗生物質の過剰使用は一般に発がん性変化を引き起こす傾向があるが、大腸がんの発生が起こった後は、特にFusobacterium nucleatum、Bacteroides fragilis、接着性侵襲性Escherichia coliなどの病原性の大腸がん関連微生物種に対して使用した場合、標的抗生物質療法が治療価値を持つ可能性がある[162,163]。たとえば、腸管嫌気性カバーを提供する抗生物質であるメトロニダゾールは、Fusobacterium nucleatumに対して有効であることが証明されている[164]。ヒト由来のFusobacterium nucleatumを豊富に含むげっ歯類大腸がん異種移植片を使用した研究では、メトロニダゾール治療によりFusobacterium量、がん細胞の増殖、および全体的な腫瘍の成長が減少することが示された[164]。さらに、マウスモデルの研究では、第二世代セファロスポリンであるセフォキシチンがBacteroides fragilisを根絶すると同時に結腸腺腫形成および結腸腫瘍数の中央値を減少させる効果があることが実証されている[165]。注目すべきことに、腸管毒素原性Bacteroides fragilisは、インターロイキン 17A (IL-17A) 依存性の炎症誘発性腫瘍の発生と関連しており、腫瘍形成にはこのBacteroides fragilisサブタイプの持続的なコロニー形成が必要です [165]。この研究では、セフォキシチンが粘膜 IL-17A 発現を効果的に低下させることがわかりました [165]。要約すると、このサブセクションでは、抗生物質の適切な管理の重要性を強調しています。広範囲の抗生物質や長期の抗生物質の使用は、病原性細菌種の過剰増殖とそれに続く大腸がんの発症に寄与する可能性があるためです。同時に、大腸がんを発症すると、これらの大腸がん関連細菌を標的とする特定の抗生物質が、化学療法剤と並行して治療に役立つ可能性があるという証拠が増えています。 |
| 3.2. 微生物代謝物、活性酸素種、および大腸がん |
| 腸内微生物ががんの発生、進行、および治療に及ぼす有益および病原性効果の多くは、それらが産生する代謝物によって媒介されます [166]。腸内微生物の分類学的変化が文献で観察されているように、その代謝物も大腸がん患者において独特で保存された変化を示します [131,167,168]。たとえば、大腸がん関連代謝物には、分岐鎖アミノ酸(BCAA)、二次胆汁酸、ポリアミン、およびトリメチルアミン-N-オキシド(TMAO)の濃度上昇が含まれ、短鎖脂肪酸(SCFA)は罹患患者で特徴的に減少しています [131,169,170]。このレビューで特に興味深いのは、短鎖脂肪酸、二次胆汁酸、およびトリメチルアミン-N-オキシドが大腸がんに関連する前がん状態およびがん状態の酸化環境に関係していることを示す十分な証拠があることです。これらの微生物代謝物については、次のサブセクションでさらに説明します。 |
| 3.2.1. 短鎖脂肪酸、活性酸素種、および大腸がん |
| 短鎖脂肪酸は、腸内細菌叢関連酵素によって触媒される食物発酵反応の分解最終産物であり、ヒト宿主に多くの利点をもたらします。これには、腸バリアの完全性の促進、エネルギー調節、抗炎症、抗酸化作用が含まれます[171]。ヒトの酵素は特定の食物繊維と難消化性デンプンを代謝できないため、腸内細菌叢は、主に酢酸、プロピオン酸、酪酸からなるこれらの短鎖脂肪酸を生成することで共生的な利益をもたらします[172]。腸内細菌叢の異常や全身性疾患の状態では、短鎖脂肪酸の濃度が著しく変化し、多くの場合大幅に減少します[173]。このパターンは大腸がん患者に見られ、罹患患者は罹患していない個人よりも血清および糞便中の短鎖脂肪酸濃度が低くなります[167,174,175]。メタアナリシス研究では、酢酸、プロピオン酸、酪酸の糞便濃度が低いほど大腸がんの発症リスクが高いことが示されています[174]。前述のように、Faecalibacterium、Eubacterium、Roseburiaなどの酪酸産生属は大腸がん患者で大幅に減少しています。興味深いことに、Fusobacterium nucleatumなどの大腸がん関連細菌は、酪酸産生細菌と競合してその濃度を低下させることでこの不均衡に寄与しています[175]。 |
| 短鎖脂肪酸が発がんや腫瘍の進行の予防に寄与するメカニズムは多岐にわたり、細胞周期調節、炎症性シグナル伝達、がんシグナル伝達経路への影響や、腫瘍の増殖や転移の抑制などがある [176]。これらの代謝副産物は、活性酸素産生を調節することでがん細胞の増殖を調節することが知られている [175]。短鎖脂肪酸が酸化ストレスに影響を及ぼすメカニズムとして提案されている 2 つに、G 共役タンパク質受容体 (GPR41 または GPR43) の活性化、またはヒストン脱アセチル化酵素阻害剤 (HDACi) 活性がある [177]。生理学的レベルでは、酪酸はグルタチオン S トランスフェラーゼやスーパーオキシドジスムターゼなどの抗酸化酵素の活性を高め、酸化ストレスを軽減する [178,179]。短鎖脂肪酸の導入は他の GPR43 アゴニストと同様に同様の抗酸化効果を発揮し、活性酸素の形成を減少させる [179] (図 2)。さらに、GPR43アゴニズムは酸化ストレスを改善することで炎症経路に有益な効果を発揮します[180]。例えば、敗血症誘発性の炎症性マウスモデルでは、GPR43遺伝子の上方制御は活性酸素種媒介ミトコンドリア損傷の減少と相関し、NLRP3インフラマソーム活性を阻害して炎症を軽減しましたが、この効果はGPR43ノックアウトマウスでは見られませんでした[180]。同様に、GPR43欠損マウスでは、TNF-αやIL-17などの炎症性サイトカイン濃度の上昇により結腸炎症反応が悪化し、短鎖脂肪酸治療に抵抗性を示します[181]。さらに、短鎖脂肪酸が豊富な難消化性デンプン食は、げっ歯類モデルでGPR43 mRNAを誘導して炎症を軽減し、腫瘍の多発と結腸腺がんの形成を減少させました[182]。したがって、短鎖脂肪酸受容体 GPR43 は、炎症によって引き起こされる大腸がんにつながる可能性のある酸化ストレスと炎症を軽減する上で重要な役割を果たします。 |
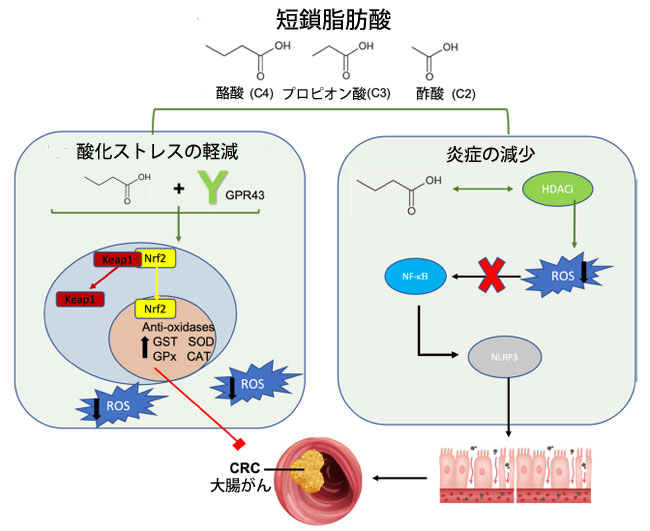 |
図 2 短鎖脂肪酸と大腸がん発症に対する抗酸化物質の役割。 短鎖脂肪酸は酸化ストレスの減少によって大腸がんを改善し、抗酸化酵素の放出を促進して炎症を緩和します。短鎖脂肪酸はその受容体 GPR43 に結合し、Nrf2-Keap1 経路を活性化します。Keap1 は Nrf2 から解離し、Nrf2 が核内に入り、抗酸化酵素の転写を上方制御できるようにします。これにより、今度は活性酸素種濃度が低下し、炎症誘発性大腸がんの発症が緩和されます。右側では、酪酸がヒストン脱アセチル化酵素阻害剤の活性を高め、活性酸素種産生を減少させることが示されています。活性酸素種産生の減少により、NF-KB シグナル伝達経路と NLRP3 インフラマソームの活性化が低下し、炎症誘発性 大腸がんの発症が再び軽減されます。 略語: GPR43、G 結合受容体 43、Nrf2、核赤血球因子 2、 Keap1、ケルチ様 ECH 関連タンパク質 1、GST、グルタチオン S トランスフェラーゼ、SOD、スーパーオキシドジスムターゼ、GPx、グルタチオンペルオキシダーゼ、CAT、カタラーゼ、ROS、活性酸素種、CRC、大腸がん、HDACi、ヒストン脱アセチル化酵素阻害剤、NF-κB、核因子 κ ベータ、NLRP3、NLR ファミリーピリンドメイン含有 3。 |
| ヒストン脱アセチル化酵素はヒストンのアセチル基を除去し、DNAをよりしっかりと包み込み、遺伝子転写、シグナル伝達経路の活性化、エピジェネティックな修飾に対する耐性を高めます[183]。3つの一般的な短鎖脂肪酸の中で最も強力なヒストン脱アセチル化酵素阻害剤である酪酸は、アセチル基の除去を阻害するのに役立ちます[184]。短鎖脂肪酸のこの固有のヒストン脱アセチル化酵素阻害剤能力は、NF-κBシグナル伝達経路[185]とNLRP3インフラマソーム活性[186]を抑制し、活性酸素種産生によって引き起こされる炎症性DNA損傷から腸バリアを保護します(図1)。重要なのは、酪酸を介したヒストンの脱アセチル化により、グルタチオンSトランスフェラーゼ(GST)などの抗酸化酵素の転写が促進され、大腸がん細胞における細胞外シグナル制御キナーゼ(ERK)およびミトゲン活性化タンパク質キナーゼ(MAPK)シグナル伝達のリン酸化が阻害されることです[187]。細胞外シグナル制御キナーゼとミトゲン活性化タンパク質キナーゼの過剰発現は大腸がんでよく見られ、その調節不全により細胞の制御されない増殖が促進されます[187]。これらの知見を裏付けるように、酪酸の蓄積は腸管上皮細胞の細胞周期の進行を停止させることで抗増殖の役割を果たしており、結腸腫瘍を予防することが示されています[188]。研究では、ヒストン修飾、特にヒストン3の過剰アセチル化が、サイクリンD1やp21などの細胞周期タンパク質の上方制御の重要な要因であることが指摘されています[189,190]。さらに、ヒストン脱アセチル化酵素阻害剤活性によるエピジェネティック修飾により、酪酸はNrf2プロモーターに作用して強力な抗酸化効果を発揮します[191](図2)。酪酸の投与は相乗的にNrf2の蓄積を促進し、AMPKシグナル伝達経路の誘導を介してヒストンのアセチル化を阻害します[191]。このように、抗酸化酵素が上方制御され、酸化還元バランスが促進され、腸バリアへの酸化ダメージが軽減されます。 |
| しかし、Nrf2 の濃度バランスが重要であることに留意すべきである。なぜなら、濃度の上昇も大腸がんの進行に寄与する可能性があるからである。化学療法抵抗性のがん細胞における Nrf2 の著しい上方制御は、適切な治療を困難にする可能性がある [192,193,194]。同様に、結腸細胞は通常の状況下では 短鎖脂肪酸を主要なエネルギー源として利用する [195]。がんは遺伝性疾患であると同時に代謝性疾患でもあるため、がん細胞は主なエネルギー源を酪酸ではなくグルコースにシフトする [196]。そのため、がん細胞によって効率的に代謝されない酪酸はがんの影響を受けた細胞の核に蓄積し、ヒストン脱アセチル化酵素阻害剤として機能する [196]。この現象はワールブルク効果として知られ、がん細胞に不利に働く。したがって、酪酸が高い状況では、短鎖脂肪酸濃度、特に酪酸を高めるプロバイオティクスが有益である [197]。さらに、酢酸、プロピオン酸、または酪酸で処理した大腸がん細胞では、活性酸素種レベルが著しく上昇し、がん細胞の死と抗がん活性に寄与します[198]。たとえば、酪酸ナトリウムを大腸がん細胞に直接導入すると、ミトコンドリアを介したアポトーシスとそれに伴う活性酸素種生成が誘発されます[199]。大腸がん細胞への短鎖脂肪酸直接処理後の活性酸素種生成は、活性酸素種生成の上昇とともに、高分子輸送と代謝、ミトコンドリア輸送、呼吸鎖複合体の変化を含む代謝プロファイルの再プログラム化によっても起こることが示されている[198]。この過剰な活性酸素種生成はがん細胞の死にさらに寄与するため、酪酸を大腸がん細胞に直接投与すると、潜在的な治療選択肢になります[200]。総合すると、これらの研究は、大腸がんの予防および治療手段としての酸化還元バランスと酸化ストレスの調節における短鎖脂肪酸の多面的な寄与の重要性を実証しています。 |
| 3.2.2. 二次胆汁酸、活性酸素種、および大腸がん |
| 胆汁酸は肝臓で生成され、胆嚢に蓄えられ、最終的には上部腸管に排泄され、脂質やその他の脂溶性分子の消化を促進します [201]。排泄される前に、一次胆汁酸はタウリンおよびグリシンと抱合され、上部小腸での受動的な再吸収を防ぎます [202]。ほとんどの一次胆汁酸は腸肝循環を経て、遠位回腸で再吸収され、門脈血系を介して肝臓に戻ります [203]。一次胆汁酸の約 5% が結腸に到達し、腸内細菌由来の酵素によって二次胆汁酸に変換されます [204]。胆汁酸塩加水分解酵素 (BSH) は、一次胆汁酸からグリシンとタウリンを遊離させるこのプロセスにおける主要な酵素です。 胆汁酸塩加水分解酵素を含む細菌属には、Clostridium, Enterococcus, Listeria, Bacteroides, Bifidobacterium, およびLactobacillusなどがある[205]。同様に、特定の腸内細菌叢はヒドロキシステロイド脱水素酵素(HSDH)活性を持ち、一次胆汁酸中のヒドロキシ基を酸化して胆汁酸プールを多様化させる[206]。興味深いことに、これらの反応、特にヒドロキシステロイド脱水素酵素との反応は、微小環境の酸化還元電位と酸化状態に大きく依存している[207]。 |
| 大腸がんでは、二次胆汁酸が特徴的に増加しており、腫瘍環境内の酸化状態の調節を含む複数のメカニズムを介して病因および腫瘍の進行に関連しています[208,209,210,211]。二次胆汁酸は主にリトコール酸(LCA)とデオキシコール酸(DCA)で構成されており、大腸がんに関連してリトコール酸が最も毒性の高い二次胆汁酸であり、デオキシコール酸がそれに次ぐ[212]。リトコール酸とデオキシコール酸は、膜結合型NADH / NADPHオキシダーゼとホスホリパーゼA2(PLA2)を活性化することにより活性酸素種を生成します[213,214]。過剰な活性酸素種生成は、炎症性NF-κBなどの細胞シグナル伝達経路を活性化し、大腸がんの病因に寄与する持続的な炎症と酸化DNA損傷を引き起こします[209,211,215]。同時に、胆汁酸誘発性の酸化ストレスはミトコンドリアの破壊を介してアポトーシスを促進し、その結果、シトクロムCが細胞質に放出され、カスパーゼが活性化されます[211,216]。しかし、これらの細胞毒性効果は正常細胞とがん細胞の両方に影響を及ぼし、正常な細胞生理機能に大きな影響を与える傾向があります。具体的には、これらの細胞毒性経路は正常な結腸細胞の遺伝的安定性を変化させ、一方で耐性変異細胞は発がんを誘発する複数の細胞シグナル伝達経路の活性化を介して増殖する可能性があります[213,217]。例えば、デオキシコール酸媒介性活性酸素種産生はNF-κBを恒常的に活性化し、大腸がん細胞のアポトーシス抵抗性を促進します[218](図3)。 |
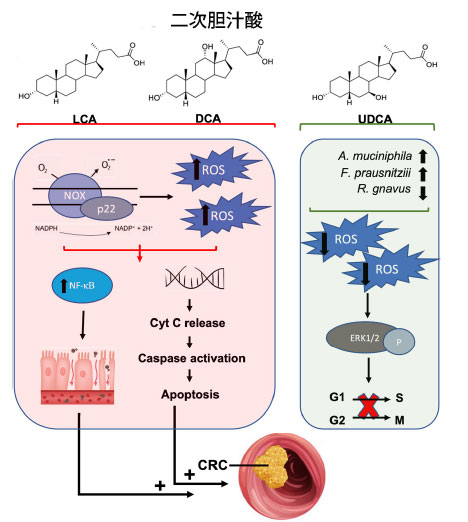 |
図 3 二次胆汁酸と、大腸がんの発症または予防におけるその酸化的役割。 リトコール酸とデオキシコール酸は、膜結合型 NADPH オキシダーゼの活性化を通じて酸化ストレスを増加させます。その結果、NF-κB 炎症シグナル伝達が増加し、腸管の炎症が悪化します。同時に、これらの二次胆汁酸から誘導される 活性酸素種産生は、DNA を損傷し、シトクロム C の放出を誘導し、アポトーシスを開始します。これらのメカニズムは大腸がんの発症に影響します。逆に、ウルソデオキシコール酸は、微生物組成を改善し、活性酸素種産生を減少させる、より好ましい二次胆汁酸です。ウルソデオキシコール酸誘導性 活性酸素種減少による大腸がん細胞株の細胞外シグナル制御キナーゼの刺激は、大腸がん細胞株の細胞周期の進行を防ぐことで細胞周期停止に影響します。酸化状態の調整によるこの抗増殖効果は、大腸がんへの進行を防ぐのに有益です。 略語: LCA、リトコール酸; DCA、デオキシコール酸、UDCA、ウルソデオキシコール酸、NOX、NADPH オキシダーゼ、ROS、活性酸素種、NF-κB、核因子 κ β、Cyt C、シトクロム C、CRC、大腸がん、ERK1/2、細胞外シグナル制御キナーゼ。 |
| 微生物が合成する二次胆汁酸のほとんどは腫瘍形成性であるが、微生物および合成によって生成される二次胆汁酸であるウルソデオキシコール酸には抗がん作用がある可能性がある[219,220,221]。興味深いことに、ウルソデオキシコール酸の導入により、腸内微生物組成がより好ましい細菌へとシフトし、例えばFaecalibacterium prausnitziiやAkkermansia muciniphilaが増加し、炎症誘発性のRuminococcus gnavusが減少する可能性がある[222,223]。さらに、ウルソデオキシコール酸は有毒な胆汁酸を競合的に排除し、胆汁酸の腸肝循環を促進する可能性がある[224,225]。これらの好ましい効果は十分に文書化されているが、ウルソデオキシコール酸は天然には胆汁酸プール全体の約5%を占めるため、特に前がん性微小環境および微生物のディスバイオシスでは、デオキシコール酸とリトコール酸の効果が優勢である可能性がある[226]。さらに、ウルソデオキシコール酸は酸化環境を調節することで大腸がん前駆細胞の形成を阻害する[221]。例えば、ウルソデオキシコール酸はアポトーシスを増加させることなく大腸がん細胞の総数を減少させた。より具体的には、ウルソデオキシコール酸処理は細胞内活性酸素種の減少を誘導し、大腸がん細胞株におけるERK1/2リン酸化を促進する[221]。ERK1/2リン酸化は、G1/SおよびG2/M遷移の制御を介して細胞周期停止と相関しているため、ウルソデオキシコール酸は細胞の酸化状態の調節を介して抗増殖効果を発揮する[221](図3)。これらの研究は、腫瘍形成および抗がん特性における二次胆汁酸の多因子的影響を強調しており、デオキシコール酸およびリトコール酸は活性酸素種生成を介して一般的に有害な影響を及ぼし、ウルソデオキシコール酸は抗酸化能により治療的役割を果たす。 |
| 3.3. トリメチルアミン-N-オキシド、酸化ストレス、および大腸がん |
| トリメチルアミン (TMA) は、カルニチン、コリン、ベタインなどの食事性前駆物質の腸内細菌叢代謝の副産物です [227]。トリメチルアミン産生細菌には、大腸がん患者で増加しているEscherichia などがあり、腸内細菌叢が健康な構成の人では一般的に多くありません [228]。特にEscherichia は、カルニチンオキシゲナーゼ活性を内在しており、カルニチンから トリメチルアミンへの変換を触媒します。この反応は酸素の利用可能性に依存します [228,229]。また、Firmicutes 門には、コリンとベタインをそれぞれ トリメチルアミンに変換するコリン-トリメチルアミンリアーゼとベタイン還元酵素活性があります [228]。 トリメチルアミンは生成されると、肝臓内のフラビンモノオキシゲナーゼによってトリメチルアミン-N-オキシド(TMAO)に酸化される[230]。 |
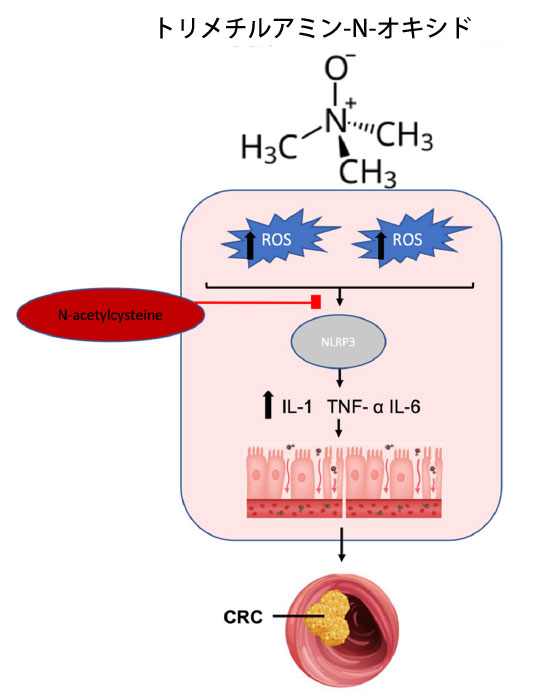 |
図 4 腸の代謝産物であるトリメチルアミン-N-オキシドの大腸がん発症に対する酸化促進作用。 トリメチルアミン-N-オキシドは 活性酸素種産生を増加させて炎症性シグナル伝達を開始し、NLRP3 インフラマソームの活性化を媒介します。NLRP3 活性は炎症促進性サイトカインを増加させ、炎症性腸病理を引き起こし、炎症誘発性大腸がんの発症につながります。活性酸素種阻害剤である N-アセチルシステインの投与は、トリメチルアミン-N-オキシド誘発性酸化ストレスおよび関連する炎症を軽減します。 略語: ROS、活性酸素種、NLRP3、NLR ファミリー ピリン ドメイン含有 3、IL-1、インターロイキン-1、TNF、腫瘍壊死因子、IL-6、インターロイキン 6、CRC、大腸がん。 |
| トリメチルアミン-N-オキシドが酸化ストレスと炎症に及ぼす影響は十分に文書化されているが、大腸がんの発症機序についてはさらなる解明が必要である。結腸上皮細胞では、トリメチルアミン-N-オキシドは酸化ストレスとアポトーシスを誘導し、NLRP3 活性を誘導する [235]。しかし、このレビュー全体で述べたように、持続的なレベルの活性酸素種と炎症は DNA 損傷とタンパク質のミスフォールディングを引き起こし、発がんにつながることが知られている。肝細胞がんや膵臓がんなどの他のがんでは、トリメチルアミン-N-オキシドは炎症性シグナル伝達経路とスーパーオキシドディスムターゼ活性を上方制御することで発がんを誘導し、炎症誘発性がんを促進する [231,236]。そのため、トリメチルアミン-N-オキシドを標的としたこれらのがんの治療における免疫療法が研究されている [237,238]。 トリメチルアミン-N-オキシドは、酸化ストレスの状況下で炎症誘発性大腸がんの将来の治療ターゲットとなる可能性もありますが、これらの発見を確認するにはさらなる研究が必要です。 |
| 4. プロバイオティクス、抗酸化特性、および大腸がん |
| 有害な腸内微生物種が活性酸素種媒介発がんを引き起こすことが報告されている一方、プロバイオティクス効果を持つ有益な細菌は、抗酸化特性によって大腸がんの発生と進行を阻止することができます [21,239,240]。腸の炎症と活性酸素種上昇の状態では、プロバイオティクスは活性酸素種濃度を非病理学的レベルまで低下させることが示されています [241]。たとえば、Lactobacillus acidophilus, Lactobacillus rhamnosus, およびBifidobacterium bifidum を含むプロバイオティクス混合物を毎日摂取すると、炎症誘発性げっ歯類の 大腸がんモデルで腫瘍の平均数が 40% 減少しました [242]。酸化状態の調整によるプロバイオティクス細菌の発がん予防への影響は多面的です。これには、微生物叢依存性の抗酸化酵素の活性化、炎症性シグナル伝達経路の調節、循環微生物叢由来代謝物の変化が含まれます [243,244,245]。プロバイオティクス微生物属には、Bifidobacterium, や Lactobacillusなどの第一世代プロバイオティクスのほか、Akkermansia muciniphila、Faecalibacterium prausnitzii、Bacteroides fragilis、Blautia producta、Clostridium butyricum などの次世代プロバイオティクス (NGP) が含まれます。第一世代プロバイオティクスは、大腸がんに関連する抗がん作用と抗炎症作用を持つことがよく説明されており、部分的には、それぞれ Nrf2-keap1 や NF-κB シグナル伝達などの酸化経路と炎症経路を介して酸化状態を調節することによって作用します [246,247,248]。 次世代プロバイオティクスの大腸がんに対する抗酸化作用はあまり研究されていませんが、これらのプロバイオティクスは抗酸化作用を発揮することで炎症性腸疾患に有益な役割を果たすことが文書化されています [114,249]。最近の研究では、次世代プロバイオティクスが酸化ストレスを緩和して大腸がんの発がんを予防する多面的な影響を明らかにしています [114]。たとえば、Faecalibacterium prausnitzii は NF-κB の活性化を阻害して大腸がん 細胞株の増殖を減弱させますが、これはおそらくその強力な酪酸産生能力によるものです [114]。さらに、Faecalibacterium prausnitzii による治療は、アゾキシメタン誘発大腸がんげっ歯類モデルにおいて脂質過酸化と酸化ストレスを軽減しました [114]。アゾキシメタンは、グルタチオン(GSH)を枯渇させ、結腸細胞の抗酸化応答を損なうことで大腸がんを誘発する毒素です [250]。この研究では、大腸ポリープの前駆症状である異常陰窩巣も減少しており、Faecalibacterium が大腸がん予防に効果がある可能性があることが示唆されています。 |
| 以下のサブセクションでは、プロバイオティクスが酸化ストレスとの闘いにおいて肯定的な変化をもたらすメカニズムと、これが大腸がんの発がんと進行にどのように影響するかについて詳しく説明します。これらも表1にまとめられています。さらに、プロバイオティクスと腸内細菌叢は、がんの化学療法と免疫療法にも役立つことが示されています[126,237,238,251]。 |
| 4.1. プロバイオティクス、抗酸化酵素、大腸がん |
| プロバイオティクスは、スーパーオキシドディスムターゼ、カタラーゼ、グルタチオンペルオキシダーゼ、グルタチオンSトランスフェラーゼなどの抗酸化酵素の調節を通じて有益な抗酸化作用を発揮します[21]。一般的に、乳酸菌は、NADHオキシダーゼやピルビン酸オキシダーゼなどの内因性酸化防御酵素を持っていることがよく知られており、これらは酸化還元バランスの維持に役立ちます[244,252,253]。例えば、最近の研究では、Lactobacillus bulgaricusを動物モデルに導入すると、スーパーオキシドディスムターゼ、カタラーゼ、グルタチオンペルオキシダーゼのレベルが上昇し、酸化ストレスが緩和されることが実証されました[254]。 |
| 重要なのは、プロバイオティクスの抗酸化酵素のプラスの変化が大腸がん特異的腫瘍形成の開始において保護的な役割を果たすことが示されていることです[27,255,256]。興味深いことに、カタラーゼ産生細菌であるLactococcus lactisの経口投与は、1,2-ジメチルヒドラジン(DMH)誘発性大腸がんを予防しました[255](表1)。これは、マウスモデルでカタラーゼ非産生細菌と比較して、活性酸素種媒介性炎症性大腸損傷および腫瘍出現を有意に減少させたカタラーゼ活性の増加によって証明されました[255]。これらの知見をさらに裏付けるのは、1,2-ジメチルヒドラジン誘発性大腸がん細胞にin vitroで投与されたLactobacillus plantarumに関する研究で、スーパーオキシドジスムターゼ、カタラーゼ、およびグルタチオン-S-トランスフェラーゼを含む抗酸化酵素活性が同様に増加しました。これにより、平均腫瘍体積および腫瘍総数が減少しました[27]。 1,2-ジメチルヒドラジンは、一連の代謝反応によって生成される活性酸素種がDNAをアルキル化し、発がんを誘発することで大腸がんを誘発する前発がん物質である[257]。さらに、最近の研究では、プロバイオティクスのLactobacillus acidophilus 由来の菌体外多糖類(EPS)が、1,2-ジメチルヒドラジン誘発大腸がんモデルにおいて抗酸化酵素(スーパーオキシドジスムターゼ、カタラーゼ、グルタチオンペルオキシダーゼ)濃度を上昇させることが明らかになっている[256]。菌体外多糖類(産生細菌、特にLactobacillus delbruecki 株は、抗酸化酵素活性(グルタチオン、スーパーオキシドジスムターゼ、カタラーゼ、グルタチオンペルオキシダーゼ)の上昇を介して脂質過酸化を減少させ、それによって炎症性粘膜損傷を改善する[258]。Lactobacillus とBifidobacterium由来の菌体外多糖類は、その固有の抗酸化酵素能力を含む強力な抗炎症および抗酸化特性で注目を集めている[259,260]。 |
| 表 1 プロバイオティクスの抗酸化酵素、抗酸化調節経路、大腸がん病因における活性酸素種媒介炎症シグナル伝達経路、および現在の免疫療法の増強に対する効果 |
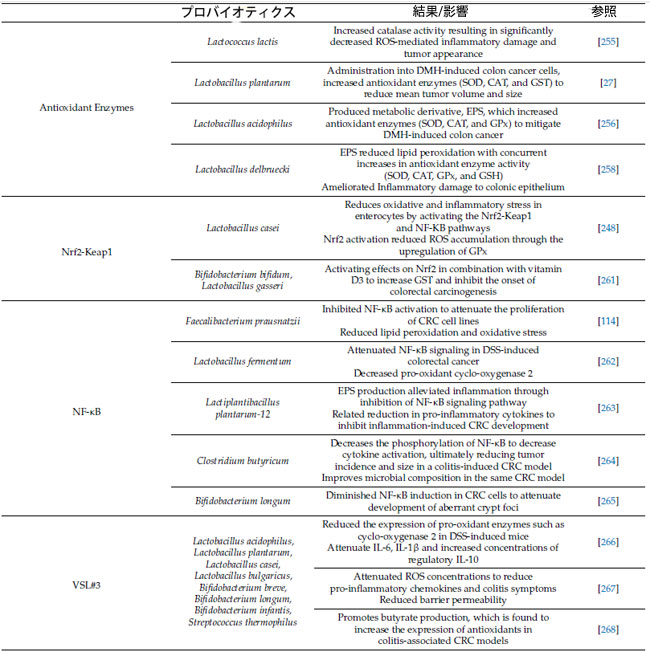 |
 |
| 略語: ROS、活性酸素種。DMH、1,2-ジメチルヒドラジン。SOD、スーパーオキシドジスムターゼ。CAT、カタラーゼ。GST、グルタチオン-S-トランスフェラーゼ。GPx、グルタチオンペルオキシダーゼ。EPS、エキソ多糖類。Nrf2、核因子赤血球関連因子 2。Keap1、ケルチ様 ECH 関連タンパク質 1。NF-κB、核因子 κ ベータ。DSS、デキストラン硫酸ナトリウム。CRC、大腸がん。IL、インターロイキン。CRISPR、クラスター化規則的間隔の短い回文反復。NLRP3。ヌクレオチド結合ドメイン、ロイシンリッチ含有ファミリー、ピリンドメイン含有 3; PD-1、プログラム細胞死タンパク質 1。 |
| 4.2. プロバイオティクス、抗酸化シグナル伝達経路、および大腸がん |
| このレビュー全体で議論されているように、Nrf-2抗酸化経路は、広範囲の抗酸化酵素を調節することで酸化ストレスを制御する上で重要な役割を果たし、酸素フリーラジカルの解毒と除去に貢献しています[248]。腸内細菌叢とその代謝物は、部分的には上皮タイトジャンクションタンパク質のNrf2依存性上方制御を通じて、腸バリアの完全性の維持に大きな影響を与えます[273]。同様に、炎症性疾患および大腸炎関連大腸がんを改善する天然物は、腸内微生物組成とNrf2/HO-1経路を介したシグナル伝達を強化することで、炎症反応、酸化ストレス、粘膜損傷を阻害することが示されています。 |
| プロバイオティクスによるNrf-2の活性化は、顕著な抗酸化作用と抗炎症作用を媒介し、炎症誘発性大腸がんの発症を抑制することが示されています[248,274]。例えば、大腸炎誘発マウスにおけるプロバイオティクス投与の抗酸化作用と抗炎症作用に関する最近の比較研究では、Nrf2およびNF-κB関連遺伝子の下方制御と大腸炎の緩和が示されました[274]。興味深いことに、Lactobacillus spp. と Bifidobacterium spp., の88株を含むプロバイオティクスは、抗酸化酵素活性(スーパーオキシドジスムターゼ、カタラーゼ、グルタチオンペルオキシダーゼ、およびグルタチオン)を改善し、TNF-αなどの炎症誘発性サイトカインの濃度を低下させました[274]。乳酸菌であるLactobacillus caseiは、Nrf-2とNF-κBシグナル伝達の両方を活性化することにより、腸管上皮細胞における酸化ストレスと炎症ストレスに対する酸化還元作用を示すことが実証されている[248]。この研究では、Lactobacillus caseiによるNrf2活性化がグルタチオンペルオキシダーゼを上方制御することにより、腸管上皮細胞における活性酸素種蓄積を減少させた[248]。同様に、Bifidobacterium bifidum と Lactobacillus gasseriの補給とビタミンD3の併用もNrf2を活性化し、同時にグルタチオン-S-トランスフェラーゼが増加してげっ歯類モデルにおける大腸がんの発生を抑制した[261]。全体として、Lactobacillus spp. は、腸管上皮細胞におけるNrf2および炎症ストレスに対する酸化還元作用を効果的に阻害することが示唆されている。プロバイオティクスとその代謝物は、体全体のNrf2媒介経路を活性化することで強力な抗酸化作用を及ぼすことが十分に文書化されており、これらの細菌の酸化還元バランスと炎症性疾患の治療における役割についてさらなる洞察を提供しています[275,276,277]。これらの知見は、プロバイオティクスの補給が活性酸素種媒介損傷と腸管上皮細胞への炎症性ストレスを軽減し、大腸がんの発症を遅らせたり予防したりできることを示唆しています[248,261]。ただし、悪性細胞におけるNrf2-keap1活性に対するプロバイオティクスの影響は十分に研究されておらず、注目されている研究は主にプロバイオティクスの炎症誘発性大腸がんに対する予防効果に焦点を当てていることに注意することが重要です。 |
| 4.3. プロバイオティクス、活性酸素種媒介炎症シグナル伝達経路、および大腸がん |
| プロバイオティクスは、NF-κBなどの活性酸素種媒介、炎症、およびがん関連シグナル伝達経路を媒介することにより、炎症誘発性大腸がんの予防に重要なプラスの影響を与えます[278]。酸化ストレスの増強は、NF-κB経路を介して構成的シグナル伝達を開始し、大腸における炎症性損傷および関連する発がんを促進する可能性があります[86,279]。乳酸菌は、NF-κBシグナル伝達経路を緩和し、発がんを防ぐことに関与しています[262,263]。例えば、デキストラン硫酸ナトリウム(DSS)誘発性大腸がんげっ歯類モデルにLactobacillus fermentumを補給したところ、主要なタンパク質であるIκBαとp65、および既知の酸化促進物質である標的タンパク質シクロオキシゲナーゼ-2が減少し、NF-κBシグナル伝達経路のシグナル伝達が弱まりました[262]。デキストラン硫酸ナトリウムは結腸上皮の炎症性損傷を引き起こすことで大腸がんを誘発しますが[280]、これはプロバイオティクスが炎症シグナル伝達経路を緩和して発がんを遅らせることができることを示唆しています[262]。同様に、Lactiplantibacillus plantarum-12由来菌体外多糖類は、炎症誘発性大腸がんのマウスモデルにおいてNF-κBシグナル伝達経路を阻害し、炎症性サイトカインを減少させることで、炎症を大幅に緩和しました[263]。この細菌はまた、有益な腸内細菌叢の生存を促進し、炎症性種の相対的な寄与を減らすことで、腸内微生物組成を強化します[263]。さらに、酪酸産生Clostridium butyricum は、大腸炎関連大腸がんげっ歯類モデルにおいてNF-κBのリン酸化を減少させ、微生物組成を改善する[264]。NF-κBシグナル伝達の阻害は、観察されたサイトカイン活性の減少、アポトーシスの増加、および腫瘍の発生率とサイズの減少の触媒であった。同様に、Bifidobacterium longum は、このマウスモデルにおいて大腸がん細胞におけるNF-κBシグナル伝達を減少させ、異常な陰窩巣の発達を減弱させた[265]。総合すると、これらの研究は、酸化ストレス増加の副産物であるNF-κB経路と大腸がんの発症を結び付け、プロバイオティクスがシグナル伝達を減弱させる効率的な治療介入として機能するという強力な証拠を提供している。 |
| さらに、3つの細菌属(Lactobacillus, Bifidobacterium, および Streptococcus)の微生物種からなるプロバイオティクス混合物であるVSL#3は、活性酸素種と炎症マーカーの調節を通じて、炎症誘発性大腸腺がんの発症を軽減します[266,267,281]。具体的には、投与後に結腸炎症スコアと結腸異形成病変の発生率が有意に減少し、同時にIL-6、IL-1βが減少し、制御性IL-10の濃度が上昇しました[266]。同様に、これらのデキストラン硫酸ナトリウム誘導マウスでは、シクロオキシゲナーゼ-2などの酸化促進酵素の発現が減少し、活性酸素種活性の低下に対応していました[266]。追跡調査でも、大腸がん発症に対する予防効果を促進するIL-6/STAT3の抑制が観察され、VSL#3の抗炎症作用が裏付けられました[281]。このプロバイオティクス混合物の抗炎症効果は、MUC2欠損マウスの腸管バリア機能の強化への影響を通じて解明されています[267]。MUC2は、腸管バリアの完全性を維持する上で複数の重要な役割を果たしており、糖タンパク質は保護ムチン層として機能し、有益な細菌の重要な食料源となっています[282]。MUC2欠損マウスでは、VSL#3単独でバリア透過性を低下させ、部分的に活性酸素種の減衰を介して炎症誘発性ケモカインと大腸炎症状を減衰させました[267]。興味深いことに、これらの効果は腸の代謝物である酢酸によって媒介されました。しかし、VSL#3の導入による酪酸産生は、大腸炎関連大腸がんモデルで抗酸化酵素の発現増加も実証しています[268]。総合すると、VSL#3 とその他のプロバイオティクス製剤は炎症経路において重要な役割を果たし、多くの場合、酸化ストレスと 活性酸素種の媒介を伴い、炎症誘発性大腸がんの進行または発症を緩和します。 |
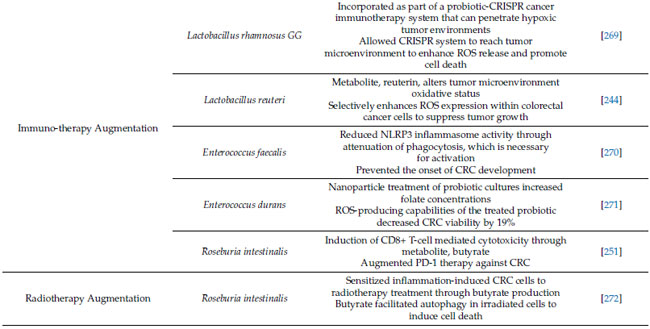
| 4.4. プロバイオティクス、抗酸化物質、大腸がんの免疫療法および治療 |
| プロバイオティクスは、酸化ストレスおよび関連する炎症プロセスを調節することにより、大腸がんの発症および進行を部分的に防ぐことを示す説得力のある証拠があります。近年、プロバイオティクスは酸化微小環境に影響を与え、大腸がんの治療におけるがん免疫療法を強化できることが示されています [269,283]。たとえば、抗生物質で治療したげっ歯類モデルでは、CpG オリゴヌクレオチド治療によるがん免疫療法により、がん特異的細胞におけるサイトカイン産生と 活性酸素種媒介細胞毒性の両方が減少し、治療反応が悪化したことが示されました [283]。 さらに、最近の研究では、Lactobacillus rhamnosus GG からなるプロバイオティクス-CRISPR がん免疫療法システムが解明されています。 このLactobacillus spp. は、がん細胞に特異的なサイトカイン産生と 活性酸素種 媒介細胞毒性の両方を減少させ、治療反応が悪化したことを示しています。低酸素腫瘍環境に浸透できるベクターとして作用し、CRISPR由来のがん免疫療法が腫瘍微小環境に到達し、活性酸素種放出を促進し、細胞死を誘導することを可能にする[269]。 さらに、一般的に使用されるプロバイオティクスであるLactobacillus reuteriは、腫瘍微小環境の酸化状態を変化させることで大腸がん細胞の生存率と増殖を低下させることが示されている[244]。 興味深いことに、その代謝物であるロイテリンは、タンパク質酸化を介してこれらのプラス効果を媒介し、腫瘍細胞内で活性酸素種発現を選択的に促進してがんの増殖を抑制する[244]。観察されたロイテリンの用量依存的効果は大腸がん細胞で観察されたが、ロイテリン耐性の対照細胞では観察されなかった。 |
| Enterococcus spp.も抗腫瘍作用を持つプロバイオティクスとして注目されている [270]。Enterococcus faecalis はこれまで、細胞外スーパーオキシドと過酸化水素の産生による結腸上皮 DNA 損傷による発がん促進作用に関与していると考えられてきたが [284]、最近の研究ではその逆の結果が示された。加熱殺菌したEnterococcus faecalis による治療は、NLRP3 インフラマソーム活性を低下させることで、腸の炎症を軽減し、炎症誘発性大腸がんを予防することが示されている [270]。この効果は NLRP3 ノックアウトマウスでは観察されなかった [270] ことから、Enterococcus faecalis の 大腸がん治療における有効性におけるインフラマソームの重要性が強調されている。さらに、最近の研究では、ナノ粒子療法によって 活性酸素種産生能力を利用して大腸がん細胞を選択的に破壊することを目指した [271]。Enterococcus durans培養物のナノ粒子処理は細胞外葉酸濃度を上昇させ、アミノ酸、短鎖脂肪酸、エネルギー代謝物を含む代謝経路と相互作用した[271]。その後、このナノ粒子処理Enterococcus duran細胞株をHCT 116大腸がん細胞株に導入したところ、細胞生存率が19%減少し、この細菌の新たな抗腫瘍作用が示された。 |
| 炎症誘発性大腸がんモデルでは、最近の研究結果から、Roseburia intestinalisが酪酸産生を介して大腸がんにおける免疫療法、特に抗PD-1療法を強化することが示されています[251]。大腸がん患者ではRoseburia濃度が有意に低下しましたが、補給により酪酸がToll様受容体5に結合し、NF-κBシグナル伝達が活性化することで、CD8+ T細胞を介した細胞傷害が誘発されました[251]。同様に、Roseburia intestinalisは、やはり酪酸の産生を介して、炎症誘発性大腸がんの放射線療法に対する感受性を高めることも示されています[272]。このげっ歯類モデルでは、酪酸が照射細胞のオートファジーを促進し、細胞死を誘発しました[272]。これらの研究結果は、Roseburia intestinalisが酸化因子や関連免疫因子の調節を介して免疫療法の増強に重要な役割を果たす可能性があることを示唆しています。 |
| 5. 結論と展望 |
| 大腸がんモデルでは、腸内細菌叢と酸化状態を関連付ける十分な証拠があります。細菌叢の代謝物、活性酸素種生成、および腫瘍形成の複雑な相互作用は、大腸がんの発生に関する貴重な洞察を提供します。活性酸素種 は大腸がんで二重の役割を果たしており、通常の状態ではシグナル伝達分子として機能しますが、過剰になると腫瘍形成に寄与します。活性酸素種は DNA 損傷、脂質過酸化、およびタンパク質修飾を誘発し、突然変異と発がんにつながります。酸化ストレスは NF-κB や NLRP3 などの炎症性シグナル伝達経路も促進し、大腸がんの発症にさらに寄与します。腸内細菌叢は、酸化状態と 大腸がんの病因に大きく影響します。Fusobacterium nucleatum や Escherichia coli などの特定の細菌種は、活性酸素種生成と炎症性シグナル伝達を増強し、腫瘍の成長と転移を促進する可能性があります。逆に、Faecalibacterium prausnitzii や Lactobacillus spp. などの有益な細菌は抗酸化特性を示し、活性酸素種媒介による損傷を緩和し、炎症を減らします。プロバイオティクスは、炎症誘発性大腸がんの予防と治療に有望であることが示されています。酸化ストレスを調節し、抗酸化酵素の活性を高め、炎症経路に影響を及ぼすことができます。Lactobacillus や Bifidobacterium などの特定のプロバイオティクスは、腫瘍発生率の低下、免疫応答の強化、がん免疫療法の有効性の改善に有効であることが実証されています。レビューされた結果は、腸内細菌叢、活性酸素種、および 大腸がんの複雑な相互作用を強調しています。今後の研究では、(i) 特定の腸内細菌が活性酸素種生成と炎症経路に影響を及ぼす正確なメカニズムの解明、(ii) 大腸がんのさまざまなステージにおけるプロバイオティクスの役割と、既存の治療法との併用療法におけるその可能性の調査、(iii) 食事と生活習慣の変更が腸内細菌叢の構成と 大腸がんリスクに与える影響の調査に重点を置く必要があります。 (iv) 大腸がん患者の抗酸化および抗炎症反応を強化するための標的プロバイオティクス療法の開発。プロバイオティクスやその他の微生物叢標的療法を臨床診療に取り入れることで、大腸がんの予防と治療に新たなアプローチが提供され、患者の転帰が改善され、この疾患の世界的な負担が軽減される可能性があります。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Int J Mol Sci. 2024 Aug; 25(16): 9026.に掲載されたAntioxidant Role of Probiotics in Inflammation-Induced Colorectal Cancer.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |