
Vinod K. Gupta, Sanu Rajendraprasad, et al., |
要約 |
背景: 集中治療室 (ICU) では腸内毒素症(dysbiosis: 腸内微生物叢の異常)が頻繁に発生しており、院内感染のリスクが高まる可能性があります。 腸内微生物叢を強化することは、潜在的な有害な結果を軽減するための戦略的アプローチとして提案されています。 厳選されたプロバイオティクスサプリメントに関するこれまでの研究では腸内微生物の多様性を改善する効果は示されていませんでしたが、発酵食品は有望な代替手段を提供します。 この非盲検第 I 相安全性および実現可能性研究では、重症患者の腸内毒素症を軽減するために発酵食品を利用するための最初のステップとして、ケフィアの安全性と実現可能性を検討しました。 |
方法: 私たちは、消化管に損傷がない54人の重症患者にケフィアを漸増用量(60mL、12時間後に120mL、その後毎日240mL)で投与した。 ケフィアの安全性を評価するために、胃腸症状を監視しました。 実現可能性は、患者が割り当てられたケフィア用量の少なくとも 75% を摂取したかどうかによって判断されました。 ケフィア投与後の腸内微生物叢組成の変化を評価するために、13 人の患者から 2 つの便サンプルを収集しました。1 つは 集中治療室入室後 72 時間以内、もう 1 つは最初の便サンプルから少なくとも 72 時間後のものです。 |
結果: ケフィアを投与した後、54人の重症患者のうち、ケフィア関連の菌血症の兆候を示した人はいなかった。 下剤を同時に服用している 2 人の患者で下痢が発生したことを除いて、膨満、嘔吐、誤嚥などの副作用は認められませんでした。 参加者全員に処方された 393 回のケフィア投与のうち、359 回(91%)の投与が成功しました。 29 人 (54%) の患者から最初の便サンプルを収集し、13 人 (24%) の患者から追跡調査サンプルを収集することができました。 26 対のサンプルの分析により、2 つの時点間で腸内微生物のα多様性が増加していないことが明らかになりました。 しかし、2 番目の時点までに腸内微生物叢ウェルネス指数 (GMWI:Gut Microbiome Wellness Index️、訳者注;臨床診断とは独立して病気の可能性を予測するための生物学的に解釈可能な数式で、健康に保つ微生物種と健康を損なう微生物のセットから計算されます) には大幅な改善が見られました (P = 0.034、片側ウィルコクソン符号付き順位検定)。 この発見は、ケフィア投与により重症患者の腸の健康が改善されるという我々の仮説を裏付けるものである。 さらに、ケフィアに含まれる既知の微生物種は、患者の腸内でさまざまなレベルの生着を示すことが判明しました。 |
結論: 重篤な患者にケフィアを提供することは安全であり、実現可能です。 私たちの発見は、集中治療室に入院した患者におけるケフィアの安全性、忍容性、腸内毒素症に対する影響について、より広範な評価を行うことを正当化するものです。 |
| 目次(クリックして記事にアクセスできます) |
| 2.方法 |
| 2.1.研究デザイン |
| 2.2.患者募集 |
| 2.3.ケフィア製品 |
| 2.4集中治療室患者へのケフィア投与 |
| 2.5.成果の尺度 |
| 2.6.便サンプルの収集、DNA抽出、ショットガンメタゲノム シーケンス |
| 2.7.シーケンスされたリードの高品質なフィルタリング |
| 2.8.便メタゲノムの分類学的プロファイリング |
| 2.9.腸内微生物叢の多様性の測定 |
| 2.10微生物群集の分類学的組成に基づく順列多変量分散分析 |
| 2.11. 腸内微生物叢ウェルネス指数の計算 |
| 2.12.タイムポイント 1 からタイムポイント 2 までの腸内微生物叢ウェルネス指数種の倍率変化の定量化 |
| 3.結果 |
| 3.1.患者の選択、安全性の監視、および便サンプルの収集 |
| 3.2.ケフィアの投与は重症患者にとって実行可能かつ安全である |
| 3.3.重症患者は集中治療室で腸内細菌叢の組成に重大な変化を示す |
| 3.4.ケフィアに含まれる微生物種は患者の腸内でさまざまな生着を示す |
| 3.5.集中治療室でケフィアを補給した重症患者は腸内細菌叢の改善を示した |
| 4.議論 |
| 5.結論 |
| 本文 |
| 1.背景 |
| 重症患者の大部分は、集中治療室入室後数時間以内に、主に共生腸内微生物叢の多様性の減少と病原菌株の拡大である腸内毒素症を経験します[1-3]。 腸内毒素症、院内感染、臓器不全、敗血症性ショック、さらには死亡率の増加と関連している[4-12]。 腸内毒素症とこれらの有害な結果との関係の根底にある正確なメカニズムは、依然として十分に理解されていません。 しかし、一般的な理論は、腸内病理学的細菌の定着と増殖を促進する不均衡な腸内微生物叢が関与する潜在的な原因を示唆しており、これは集中治療室患者における有害転帰の危険因子と考えられている[13]。 したがって、これらの発見は、重症患者の腸内細菌叢の多様性の低下が有害転帰のマーカーであるだけでなく、症状の進行と重症化にも役割を果たしている可能性があることを示唆しています。 |
| 救命救急治療で採用されている標準的な治療介入の多くは、共生腸内微生物叢を意図せず変化させ、多くの場合、患者に不利益をもたらします。 抗生物質 [14、15]、胃酸抑制剤 [16]、オピオイド [17]、抗精神病薬 [18]、特定の非経口および経腸栄養製剤 [19]、下剤、コルチコステロイド [20] などの一般的な治療法は、胃腸の機能を枯渇させるだけでなく、 腸内細菌叢は共生するだけでなく、病原性細菌が繁殖する道も開きます。 集中治療室環境における腸内毒素症の重大な影響を考慮すると、これに対抗する介入を考案することに関心が高まっています。 しかし、この取り組みは簡単ではありませんでした。 例えば、プロバイオティクスの補給による重症患者の人工呼吸器関連肺炎率の減少を目的とした最近の臨床試験では、肯定的な結果は得られなかった[21、22]。 |
| プロバイオティクスの補給が必ずしも腸内微生物の多様性を変えるわけではないことがいくつかの研究で示されているため、プロバイオティクスの補給が重症患者の人工呼吸器関連肺炎の発生率を大幅に低下させなかったのはおそらく驚くべきことではない[23-28]。 ブルガリアの農民の長寿化が示唆するように、伝統的に発酵食品を豊富に含む食事を摂取することは健康を増進する方法として認識されており、これは酸乳に含まれる乳酸生成細菌の恩恵によるものと考えられています[29]。 いくつかの研究は、発酵食品が実際に腸内微生物叢の多様性を高める可能性があることを裏付けています[30-34]。 このカテゴリーで傑出したものの 1 つは、よく知られた発酵乳飲料であるケフィアです。 |
| ケフィアは、抗炎症作用や抗酸化作用から抗がん作用、さらには特定の病原菌に対する抗菌作用に至るまで、数多くの健康上の利点と関連付けられています[35-38]。 これらの特性は当然、興味深い疑問につながります。ケフィアは重症患者の腸内微生物の多様性を強化する上で極めて重要な役割を果たすことができるのでしょうか? しかし、現時点では、そのような患者の腸内細菌叢の多様性に対するケフィアの影響に関する実質的なデータはありません。 このギャップを認識して、私たちは医療集中治療室環境に入院した重症患者におけるケフィア経口投与の結果に焦点を当てたパイロット研究に着手しました。 私たちの主な目的は、患者へのケフィア投与の実現可能性、安全性、および全体的な耐性を評価することでした。 第 2 の目標は、ケフィアが腸内細菌叢の組成に及ぼす影響を評価することでした。 |
| 2.方法 |
| 2.1.研究デザイン |
| この研究は非盲検第 I 相安全性および実現可能性試験として実施され、ClinicalTrials.gov (NCT05416814) に登録されました。 使用されたケフィアは、Lifeway Foods® (Morton Grove, IL 60053) から寛大に寄付されました。 この研究の承認はメイヨークリニック治験審査委員会(IRB# 20-005687)によって与えられ、同委員会はこの研究に追加の倫理承認は必要ないとみなした。 メイヨークリニック治験審査委員会は、重症患者へのケフィア投与の安全性と患者の耐性の観点からの実現可能性の両方を判断するために、食品医薬品局(FDA)によってこの製品を治験中の新薬として扱うよう要請した。 徹底的な審査の後、食品医薬品局はこの研究を承認しました。 私たちの研究の第二の目的は、集中治療室滞在中にケフィアを投与された集中治療室患者の腸内細菌叢組成の変化を調査することでした。 |
| 2.2.患者募集 |
| 集中治療室でのケフィア投与の安全性と実現可能性を適切に評価するには、少なくとも 50 人の患者のサンプルサイズが十分であると事前に決定していました。 集中治療室入院後最初の 24 時間以内に、患者の電子医療記録 (EHR) が対象基準に基づいて適格かどうか審査されました。 資格を得るには、患者は胃腸(GI)管が機能し、経口食事療法または経管栄養投与に耐えることができ、48時間以上集中治療室に留まることが予想される成人( 18歳以上)である必要がありました。 一方、除外基準には次のものが含まれます。 (i) コルチコステロイド(毎日 10 mg 以上)、TNF-α 阻害剤、モノクローナル抗体、または免疫抑制性代謝拮抗物質などの薬剤による持続的な免疫抑制(少なくとも 1 か月続く)の病歴。 (ii) 腸切除、消化管悪性腫瘍または出血、炎症性腸疾患、腸閉塞、腹腔内高血圧、腸虚血/再灌流傷害、または続発性イレウスなどの症状によって示される、腸の完全性の低下。 (iii) 乳製品不耐症または牛乳アレルギー。 (iv) 治療期間中の生存が見込めない極めて予後が悪い。 (v) 妊娠。 |
| 患者またはその代理意思決定者は、研究チームのメンバーの一人からアプローチを受けました。 参加に同意した人は口頭で同意し、HIPAA (訳者注;電子化した医療情報に関するプライバシー保護・セキュリティ確保について定めたアメリカの法律のこと)プライバシー認証フォームに署名しました。 人間の参加者が関与する研究で行われたすべての手順は、機関および国の研究委員会によって設定された倫理基準、および 1964 年のヘルシンキ宣言およびその後の修正または同等の倫理基準に従っていました。 |
| 2.3.ケフィア製品 |
| Lifeway Foods®ケフィアは、ケフィア粒を牛乳またはその他の液体に加えて製造される発酵乳飲料です。 これらのケフィア粒は、酵母と細菌(主にLactobacillus spp.)の組み合わせ、タンパク質多糖マトリックス(最も顕著な成分はグルコースとガラクトースで構成される多糖であるケフィラン)で構成されています。 この飲料には、11 種類の細菌と 1 種類の酵母菌が強化されています: Bifidobacterium lactis, Lactobacillus lactis, Saccharomyces florentinus, Streptococcus diacetylactis, Lactobacillus acidophilus, Bifidobacterium bacterium longum (or Bifidobacterium longum), Lactobacillus casei, Lactobacillus reuteri, Lactobacillus plantarum, Lactobacillus rhamnosus, Bifidobacterium bacterium breve (or Bifidobacterium breve), およびLeuconostoc cremoris. |
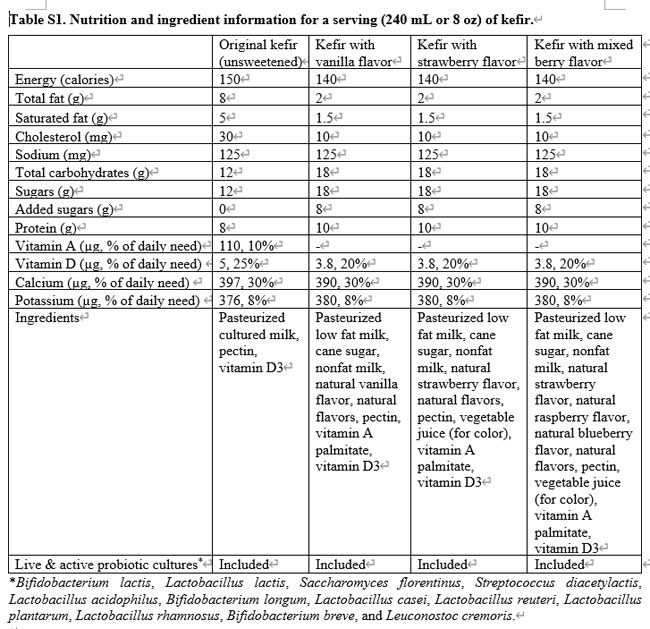
| 240 mL または 8 オンスに相当する各回分には、これらの活性な生きた培養物のコロニー形成単位が 250 ~ 300 億個の濃度で含まれています。 この研究では、Lifeway Foods® オリジナル全乳ケフィア無糖のほか、バニラ、ストロベリー、ミックスベリーのフレーバーを使用しました。 各分量の栄養成分の詳細は、追加ファイル 1: 表 S1 に記載されています。 |
| 2.4.集中治療室患者へのケフィア投与 |
| Lifeway Foods® ケフィア は、研究薬局の冷蔵庫で約 40 °F (4 °C) で保管されました。 960 mL (32 オンス) のケフィアが入った各ボトルには、追跡用の固有の識別番号が付いていました。 ケフィアの用量は、研究薬剤師によって滅菌注射器を使用して 3 つの異なる分量 (60 mL、120 mL、または 240 mL) で測定されました。 私たちは研究薬局と協力して、ケフィア投与用の EPIC EHR (Epic Systems Corporation、Madison、WI 53593) のオーダー セットを構築しました。 また、ベッドサイドの看護師向けに、排便サンプルを提供された容器に収集するよう指示するオーダーセットも含めました。 看護師はまた、サンプルの回収の準備ができたら直ちに研究チームに通知するよう指示された。 通知を受けて、研究チームのメンバーがサンプルを収集し、確実に専用の冷凍庫に移します。 すべてのサンプルは収集後 24 時間以内に -80 °C で凍結されました。 |
| 患者の募集後、ケフィアはカップを使用して経口投与されるか、経鼻胃管を介して投与されました。 後者の方法では、その後水道水のフラッシュ (最大 30 mL) を使用しました。 研究参加者は、漸増投与スケジュールに従ってケフィアを摂取しました。 最初に、60 mL の用量が提供されました。 患者が良好な耐性を示した場合は、その後 12 時間以内に投与量を 120 mL に増量しました。 副作用(吐き気、嘔吐、膨満感、または腹部不快感など)がない限り、12時間後に240 mLの用量を投与し、残りの用量はすべて24時間ごとに240 mL(標準1回分)とした。 ただし、何らかの不耐性が観察された場合は、用量を最後の十分に許容される量に戻しました。 |
| 2.5.成果の尺度 |
| この研究の主な目的は、集中治療室患者へのケフィア投与の安全性と実現可能性を評価することでした。 安全性は、ケフィア投与に直接起因する有害事象の発生率に基づいて定義されました。 私たちは、ケフィアに含まれる細菌または酵母種に起因する膨満感、嘔吐、誤嚥、下痢、薬剤または経管栄養との相互作用、菌血症、真菌血症を特に観察しました。 ケフィア投与の安全性を評価するために、ベッドサイドの看護師との毎日のコミュニケーションと電子健康記録 (EHR) の徹底的なレビューが行われました。 実現可能性は、患者に経口投与または栄養管投与が許可された場合に、処方されたケフィア用量の 75% 以上を投与できると判断されました。 患者は退院するまで追跡調査された。 |
| 2.6.便サンプルの収集、DNA抽出、ショットガンメタゲノム シーケンス |
| 腸内微生物叢の分析では、患者の集中治療室入室後できるだけ早く、理想的には最初のケフィア投与から 72 時間以内に最初の便サンプルを収集することを目指しました。 このタイミングは、患者がこの期間内に排便をしたかどうかによって決まりました。 ケフィアの最初の投与計画を考慮すると、この初期段階での腸内細菌叢に対するケフィアの影響は最小限であると予想されました。 2 回目の便サンプルは、ケフィアの全量を患者に投与してから少なくとも 72 時間後に採取するように計画されました。 |
| 研究完了後、すべての便サンプルは DNA 抽出と配列決定のためにミネソタ大学ゲノミクスセンターに送られました。 糞便DNA は、メーカーの指示に従って Qiagen の DNeasy 96 PowerSoil Pro QIAcube HT キットを使用して抽出され (QIAGEN、Germantown, MD, USA)、NanoDrop-8000 UV-Vis 分光光度計 (ThermoScientific、Wilmington, DE, USA) および PicoGreen分析を使用して定量されました。 次に、サンプルを自動 DNA 抽出装置である QIAcube HT にロードしました。 Nextera XT プロトコルを使用してシーケンス ライブラリを調製する前に、Qubit を使用して DNA を定量しました。 メタゲノム シーケンシング ライブラリを、同じ 2 × 150 bp ケミストリーを使用して Illumina Novaseq 6000 シーケンサーまたは小規模の Illumina シーケンシング機器にロードし、サンプルあたり 8 M ペアエンド リードをターゲットにしました。 |
| 2.7.シーケンスされたリードの高品質なフィルタリング |
| メタゲノムリードは、低品質リード塩基とヒトリードの除去にそれぞれ Trimmomatic v0.39 [39] と Bowtie2 v2.3.3.1 [40] を使用する社内の品質フィルタリング パイプラインを使用して処理されました。 Trimmomatic v0.39 は、パラメータ LEADING:3、TRAILING:3、および MINLEN:60 を使用して実行されました。 イルミナアダプター配列は除去され、ヌクレオチド長が 60 bp より短いトリミングされた非ヒトリードは廃棄されました。 潜在的なヒト汚染は、ヒトゲノム (参照ゲノム hg38) に一致するリードを除去することによってフィルタリングされました。 |
| 2.8.便メタゲノムの分類学的プロファイリング |
| 分類学的プロファイリングは、デフォルトのパラメーターを備えたMetaPhlAn3 v3.0.13 系統発生クレード同定パイプラインを使用して実行されました [41]。 簡単に説明すると、MetaPhlAn3 は、 ~ 100,000 の微生物参照ゲノム ( ~ 99,500 の細菌および古細菌、 ~ 500 の真核生物のゲノムに相当) に由来するクレード特異的マーカー遺伝子のデータベース (mpa_v30_CHOCOPhlAn_201901) に基づいてメタゲノムリードを分類に分類します。 ウイルス起源の微生物、および未分類または未知とラベル付けされた微生物は、さらなる分析から除外されました。 その後、総和スケーリング (TSS) 正規化を使用してマイクロバイオーム プロファイルを正規化し、微生物の分類学的ランクの相対存在量 (つまり、割合) を取得しました。 |
| 2.9.腸内微生物叢の多様性の測定 |
| 腸内マイクロバイオームの全体的な生態は、α多様性(シャノン指数と種の豊富さ)とβ多様性(すべてのサンプルペア間のブレイ・カーティス距離)を計算することによって評価されました。 R パッケージ「vegan」v2.6.4 を使用して、各便メタゲノムの非形質転換種の相対存在量プロファイルに基づいてシャノン指数と種の豊富さを計算しました。 2 つの時点間の α 多様性は、Wilcoxon 符号付き順位検定を使用して比較されました。 R パッケージ「ade4」v1.7-22 および「vegan」v2.6.4 は、MetaPhlAn3 によって同定された微生物種の逆正弦平方根変換された相対存在量の距離尺度としてBray-Curtis の非類似性による主座標配位解析 (PCoA) を実行するために使用されました。 |
| 2.10微生物群集の分類学的組成に基づく順列多変量分散分析 |
| 便メタゲノムにおける微生物分類群の相対存在量の逆正弦平方根変換に基づくブレイ・カーティス距離行列は、R「vegan」パッケージ v2.6.4 を使用して生成されました。 「adonis2」関数を使用して、距離行列に対して順列多変量分散分析 (PERMANOVA) を実行しました。 検定統計量(擬似 F)の P 値は、腸内微生物群集組成の合計分散に対する時点の寄与を評価するための 999 個の順列に基づいており、ランダムな順列は「層」オプションを使用して被験者内に制限されました。 周辺モデル(つまり、単変量解析)と調整済み(つまり、複数の共変量を同時に制御する多変量解析)モデルの両方を使用して、腸内微生物叢の組成と時点の間の関連性のパーセント分散と有意性を評価しました。 |
| 2.11. 腸内微生物叢ウェルネス指数の計算 |
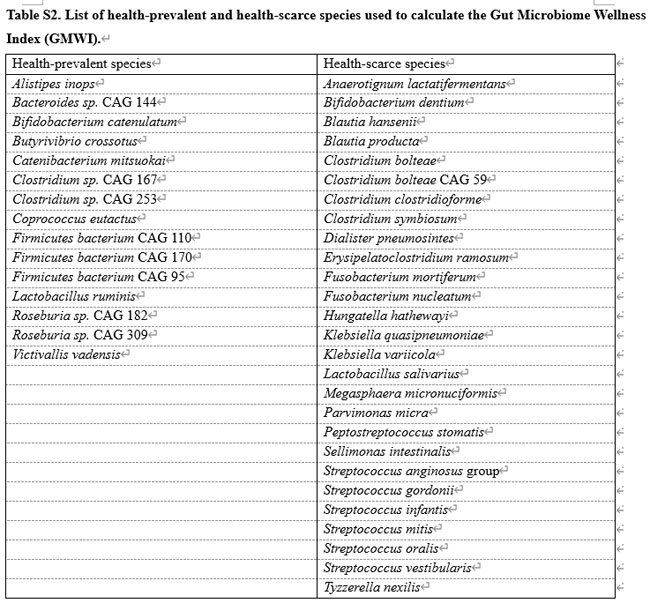
| 腸内微生物叢ウェルネス指数(GMWI) [以前は腸内マイクロバイオーム ヘルス インデックス (GMHI) と呼ばれていた] は、健康状態をモニタリングするための便メタゲノムに基づく指標です [42]。 この研究の 腸内微生物叢ウェルネス指数は、種レベルの腸内微生物叢の分類プロファイルに関する元の 腸内微生物叢ウェルネス指数スクリプトの修正版を使用して導出されました。 この指数は、健康な人 (病気のない人) または健康でない人 (臨床的に病気と診断された人) に蔓延する 42 の腸内微生物種に基づいています。 これらの微生物種 (追加ファイル 1: 表 S2) は、5,547 人の健康な被験者と 2,522 人の非健康な被験者の腸内細菌叢(便ショットガンメタゲノムによって分析) から同定されました。 特定の便メタゲノム サンプルの腸内微生物叢ウェルネス指数の正 (負) 値は、健康で病気のない状態に関連する微生物が、不健康で病気を抱えている状態に関連する微生物よりも豊富 (少ない) であることを示唆しており、値が 0 の場合は、 は、両方の種セットのバランスが等しいことを示します。 したがって、腸内微生物叢ウェルネス指数は、腸内細菌叢のサンプルに、健康を損なう種と比較して、健康を保つ種が集合的にどの程度多く含まれているかの程度として解釈できます。 |
| 私たちは、ケフィアの投与により、腸内微生物叢ウェルネス指数を通じて評価された重症患者の腸の健康状態が改善される可能性があると主張しました。 集中治療室患者の腸内細菌叢に対するケフィアの影響を評価するために、時点T1からT2までの腸内微生物叢ウェルネス指数の進行を調べました。 私たちの仮説は、特定の方向性の変化、つまり 腸内微生物叢ウェルネス指数の増加を予測していました。 したがって、方向性仮説に沿った選択である片側ウィルコクソン符号付き順位検定を使用してデータを分析しました。 この方法は、一般的な差異を測定するのではなく、定義された方向の変化を対象とするため選択されました。 |
| 2.12.タイムポイント 1 からタイムポイント 2 までの腸内微生物叢ウェルネス指数種の倍率変化の定量化 |
| 私たちは、腸内微生物叢ウェルネス指数計算に関与する前述の (健康を保つ微生物と健康を損なう) 微生物種に焦点を当てました (追加ファイル 1: 表 S2 にリストされています)。 種ごとに、時点 2 の相対存在量の幾何平均と時点 1 の相対存在量の幾何平均の比として倍率変化を計算しました。種がすべての種に存在しない (つまり、相対存在量 = 0) 場合、幾何平均は計算できません。 どちらの時点のサンプルでも、すべてのゼロ値を 3.6 × 10−8 の小さな疑似カウントに置き換えました。 次に、順列検定を実行して、2 つの時点間の倍率変化における統計的に有意な差を特定しました。 私たちのアプローチでは、クラス ラベル (ここでは、タイムポイントの指定) がランダムな置換を受けてヌル分布が確立され、倍率変化が計算されました。 10,000 回の反復にわたって、倍率変化が観察値以上に極端である回数を数えて、P 値を導き出しました。 P < 0.05 の倍率変化は統計的に有意であるとみなしました。 |
| 3.結果 |
| 3.1.患者の選択、安全性の監視、および便サンプルの収集 |
| 私たちは、2022年7月から2023年2月までにさまざまな理由で集中治療室に入院した722人の患者の健康記録を、研究に含める可能性があるかどうかスクリーニングしました(図1)。 このコホートのうち、54 人の患者が基準を満たして登録されましたが、668 人は図 1 に詳述されている特定の基準に基づいて除外されました。 登録された患者は、集中治療室入院時点で平均年齢 64.6 歳 (s.d. = 15.3)、平均 肥満指数(BMI )34.9 (s.d. = 13.0) でした (表 1)。 人口統計の内訳では、39% (54 人中 21 人) が女性であり、かなりの大多数 (98%、または 54 人中 53 人) が白人であることが明らかになりました。 さらに、参加者の87%(54人中47人)が集中治療室滞在中に少なくとも1つの抗生物質投与を受けており、78%(54人中42人)が嫌気性をカバーする抗生物質の投与を受けていた(表1)。 主要な併存疾患と手術歴、および全患者の集中治療室入室の臨床的理由の詳細を表 1 に示します。 最も頻繁に発生した診断には、呼吸不全(新型コロナウイルス関連以外)とショックが含まれていました。 集中治療室入室時の平均 Apache スコア(疾患の重症度および死亡率の推定値の指標として使用され、範囲は 0 ~ 71。スコアが高いほど死亡リスクが高いことを示します)は 39.8(s.d. = 22.0)でした。 この指標は、安全性と実現可能性に焦点を合わせて、主に私たちの研究の臨床集団を説明するために組み込まれました。 医療集中治療室 (MICU_LOS) の在院期間の中央値は 6 日でしたが、全入院期間の平均は 11 日でした (表 1)。 2 つの便サンプルを採取した 13 人の患者の追加の人口統計と I集中治療室滞在の詳細も表 1 に示します。 |
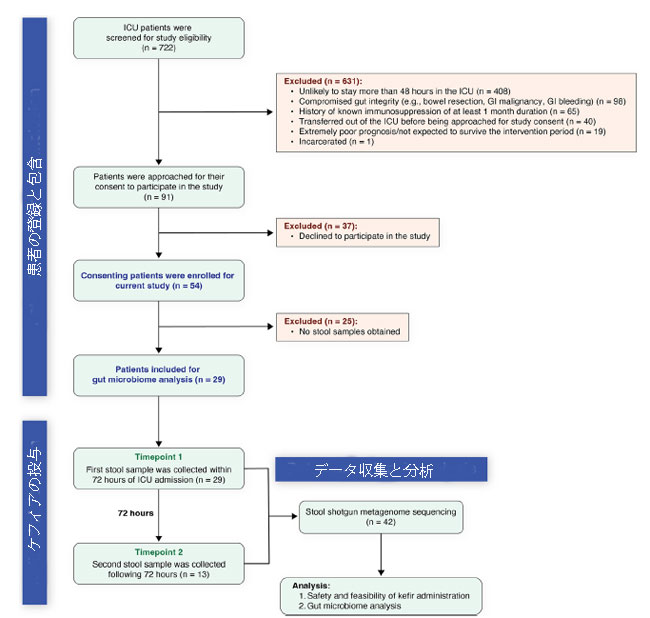 |
図1 腸内マイクロバイオーム分析のための患者の選択と便サンプルの収集 スクリーニングされた最初の集中治療室入院患者 722 人のうち、54 人の患者が我々の基準に基づいて現在の研究に登録されました。 腸内細菌叢分析のために、ケフィア投与後の患者から便サンプルが収集されました。 しかし、54 人の参加者のうち 25 人は集中治療室滞在中に排便がなく、便サンプルを提供できませんでした。 残りの29人の患者については、最初の便サンプルは集中治療室入室後72時間以内に採取され(29人の患者全員から)、その後のサンプルはケフィア投与後に腸の活動に応じて採取されました(13人の患者から)。 |
| 表 1 研究参加者の人口統計および臨床プロフィール |
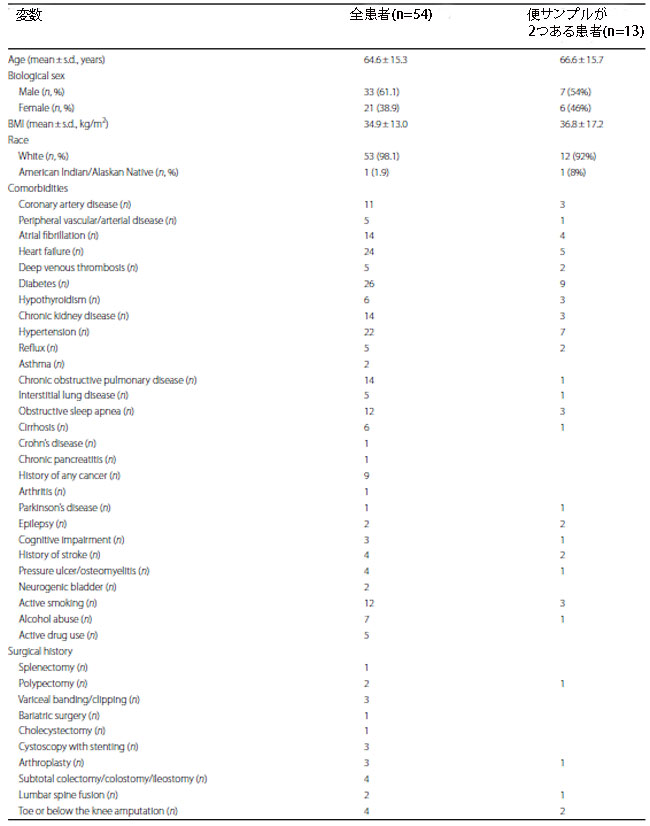 |
a Apache、急性生理学および慢性健康評価 b MICU_LOS、集中治療室の滞在期間 c Hospital_LOS、入院期間 d 抗生物質には、セフトリアキソン (n = 26)、バンコマイシン (n = 26)、ピペラシリン-タゾバクタム (n = 23)、セフェピム (n = 15)、アジスロマイシン (n = 14)、メトロニダゾール (n = 14)、ドキシサイクリンが含まれていました。 (n = 5)、セファゾリン (n = 3)、オキサシリン (n = 2)、トリメトプリム-スルファメトキサゾール (n = 2)、リファキシミン (n = 2)、レボフロキサシン (n = 1)、およびクリンダマイシン (n = 1) eピペラシリン-タゾバクタム、メトロニダゾール、トリメトプリム-スルファメトキサゾール、レボフロキサシン、およびクリンダマイシン |
| 3.2.ケフィアの投与は重症患者にとって実行可能かつ安全である |
| 患者の52%(54人中28人)に経鼻胃管を通じてケフィアを投与し、残りの患者は経口摂取した。 以前の用量レベルに戻す必要があるような事例には遭遇しませんでした。 したがって、用量調整は必要ありませんでした。 患者の80パーセント(54人中43人)が少なくとも3回のケフィア投与を受けた。 中止の主な理由は、病棟への転院または快適なケアへの移行でした。 私たちが注文した 393 回の投与量のうち、91% (393 回中 359 回) が投与されました。これは、「方法」セクションで概説した実現可能性の目標と一致していました。 全体として、最初のケフィア投与から最初の便サンプルの採取までの中央値は 56 時間 (四分位範囲 [IQR]: [28, 83])、最初の投与から2回目のサンプル採取まで中央値は 160 時間 (IQR: [144, 193]) でした。 ケフィアの投与が(手続きやNPO法人への変更などにより)中断され、その後再開された例もありました。 最初の便サンプルまでの時間が目標ウィンドウである 72 時間を超えた例がいくつかありましたが、研究のパイロット的な性質を考慮して、入手可能なすべてのデータを分析することにしました。 患者のケフィア摂取期間中央値は 3 日 (IQR: [2, 7])、そのうち 4 人の患者は 2 週間ケフィアを摂取し、2 人の患者は 4 週間ケフィアを摂取しました。 |
| 54人の研究参加者のうち、4人が脱落した。 1人の患者は膨満感を報告したが、これは後に慢性腸間膜虚血の前診断に関連していることが判明した。 別の患者は、風味のないケフィアの味が嫌いだと表明した。 その結果、フレーバー付きの品種を導入しました。 この調整にもかかわらず、さらに 2 人が味に魅力を感じなかった。 |
| 2 名が下痢を経験しましたが、下剤の同時使用を考慮すると、ケフィアとの関連性は不明でした。 重症患者の多くは、オピオイドの使用などのさまざまな要因により、排便が困難になっています。 一般的な慣行として、患者が数日間排便がない場合には、排便療法(下剤など)が導入されることがよくあります。 私たちの研究では、下痢を発症した患者はどちらもケフィアの投与を受けながら排便療法を受けていました。 集中治療室では下痢が頻繁に発生し、通常は経管栄養などが原因で起こります。 注目すべきことに、私たちの研究で下痢を経験した患者は両方とも経管栄養を受けていました。 このような状況を考えると、下痢の原因を明確に特定することは困難でした。 このパイロット研究では制御アームが欠如しているため、原因の特定はさらに複雑になります。 重要なのは、ケフィアに関連した菌血症、真菌血症、または死亡例はなかったということです。 したがって、我々の調査結果は、重症患者へのケフィアの投与が実現可能かつ安全であることを示している。 |
| 3.3.重症患者は集中治療室で腸内細菌叢の組成に重大な変化を示す |
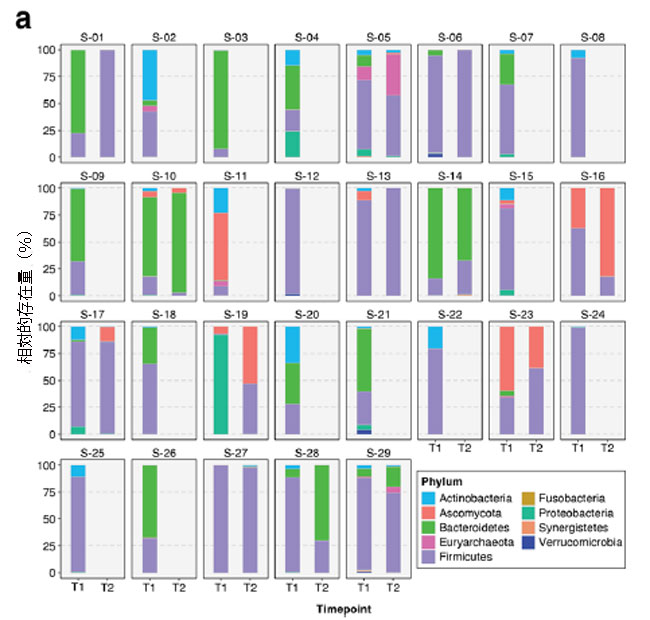
| 重症患者の腸内細菌叢(便ショットガンメタゲノム)では、Bacteroidetes とFirmicutesが、時点1(T1、n = 29)と時点2(T2、n = 13)の両方で最も豊富な門であることがわかりました(図2a)。 一方、Bacteroidetes と Firmicutesが最も豊富な門でした(図2b)。 患者が 集中治療室に入院したとき、腸内細菌叢の平均門数と綱数はそれぞれ 4.9 (s.d. = 1.5) と 8.5 (s.d. = 2.6) でした。 しかし、この数は 集中治療室滞在中に大幅に減少しました。これはおそらく、医療集中治療室環境で患者に抗生物質が日常的に投与されていたためと考えられます。 T2までに、平均数は4.0門(s.d. = 1.8)、5.9綱(s.d. = 3.5)に減少した。 |
 |
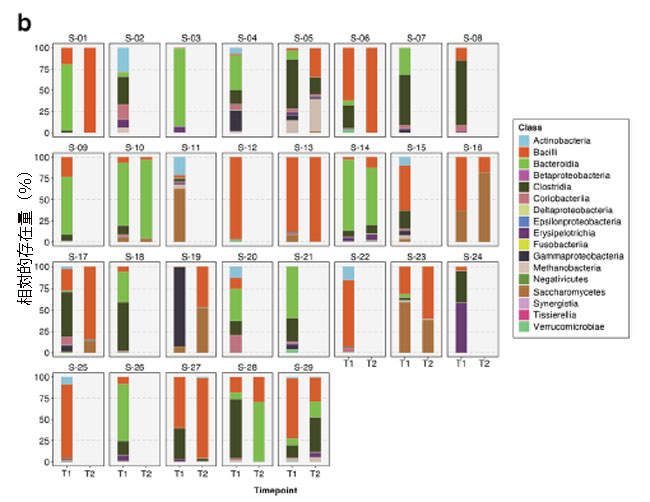 |
| 図2 2 つの時点における 29 人の 集中治療室患者の腸内細菌叢における相対的な分類学的存在量を示す積み上げ棒プロット: T1 (集中治療室入院後72 時間以内) および T2 (72 時間後)。 一般に、最も豊富な a 門はFirmicutes と Bacteroidetesであり、一方、Bacilli と Bacteroidiaが b綱レベルを支配しています。 |
| 2 つの異なる時点 (n = 13) で同じ患者から収集された便サンプルの腸内細菌叢について、 我々は、ブレイ・カーティス間距離に対して順列多変量分散分析(PERMANOVA)分析を実施し、重症患者の腸内微生物群集の分散に対する時点の影響を評価した(「方法」)。 被験者内の変動を調整した後、この時点が腸内微生物群集の総分散の6%を占めていることがわかりました(P = 0.004、順列多変量分散分析図3a)。 この結果は、集中治療室環境が腸内微生物叢全体の構成に縦断的に大きな影響を与えていることを示唆しています。 |
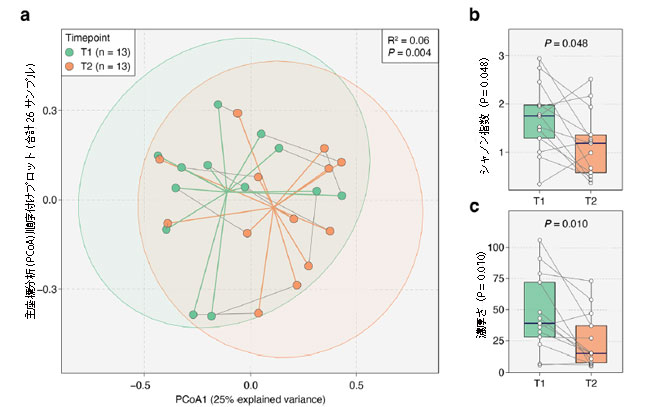 |
図 3 2 つの時点にわたる 13 人の 集中治療室患者における腸内細菌叢の多様性の変化。 a 2 つの時点における患者の腸内細菌叢サンプルの主座標分析 (PCoA) 順序付けプロット (合計 26 サンプル)。 順列多変量分散分析分析により、各時点間の腸内細菌叢組成の有意な変化が確認されました (R2 = 0.06、P = 0.004)。 点は、T1 (緑) と T2 (オレンジ) からのサンプルを表します。 灰色の実線は同じ患者からのサンプルを接続し、緑とオレンジの線はそれぞれ T1 サンプルと T2 サンプルの重心を示します。 楕円は 95% の信頼領域に対応します。 b、c T2サンプルは、T1と比較して、種レベルのシャノン指数(P = 0.048)と濃厚さ(P = 0.010)の両方で大幅な減少を示しました。 P 値は、両側 Wilcoxon 符号付き順位検定を使用して取得されました。 |
| 13 人の患者から採取した一対の腸内微生物叢サンプル (72 時間以内に収集) では、 両方のシャノン指数(P = 0.048、両側Wilcoxon符号付き順位検定、図3b)およびT1からT2までの種の豊富さ(P = 0.010、両側Wilcoxon符号付き順位検定、図3c)で大幅な減少が観察されました。 上で述べたように、これらの変化は、集中治療室滞在中に投与された抗生物質に起因する可能性が最も高くなります。 |
| 3.4.ケフィアに含まれる微生物種は患者の腸内でさまざまな生着を示す |
| 2つの異なる時点で13人の患者の腸内微生物叢のα多様性を分析した結果、1日1回分の用量でケフィアを摂取しても、全体的な微生物の多様性は増加しないことがわかりました。 しかし、ケフィアに含まれることが知られている 12 の特定の微生物種の有病率の変化をさらに深く調査したところ (図 4)、いくつかの興味深いパターンが明らかになりました。 T1 と T2 の間の短い 72 時間で、Lactobacillus plantarum, Lactobacillus reuteri, および Lactobacillus rhamnosus.の 3 つのLactobacillus 種の有病率 (つまり、特定の微生物が検出されたサンプルの割合) の大幅な増加が観察されました。 逆に、Lactobacillus acidophilusの有病率は同じままであり、Bifidobacterium longum はT1よりもT2で検出される頻度が低かった。 特に、ケフィアに含まれる12 種のうち 7 種は両方の時点ですべての患者から検出されず、腸内での生着が完全に欠如していることを示しています。 |
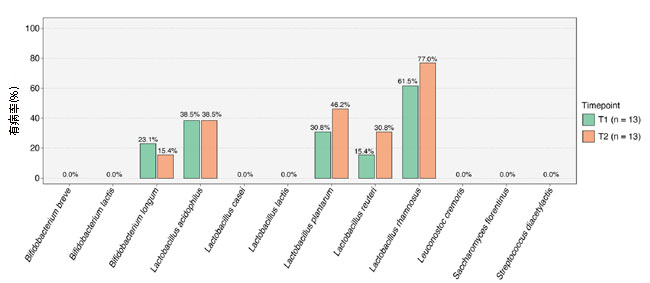 |
図 4 ケフィア由来の微生物種は、腸内生着の異なるパターンを示します。 ケフィアに含まれる 12 種類の微生物の T1 および T2 の蔓延。 集中治療室患者では3つの Lactobacillus 種(Lactobacillus plantarum, Lactobacillus reuteri, および Lactobacillus rhamnosus)の有病率が増加していた。 しかし、Lactobacillus acidophilusの有病率は変わらず、Bifidobacterium longum はT2で検出される頻度が低くなりました。 分析されたどの便サンプルからも 7 種は検出されなかった。 |
| 3.5.集中治療室でケフィアを補給した重症患者は腸内細菌叢の改善を示した |
| 私たちの研究では、ケフィアの投与により重症患者の腸の健康が改善されるという仮説を立てました。 医療集中治療室でケフィアを投与するという決定は、基本的に、ケフィアが有益な効果をもたらすという仮説に基づいていました。 したがって、集中治療室患者の腸内細菌叢に対するケフィア補給の利点についてより深い洞察を得るために、腸内微生物叢ウェルネス指数のT1からT2への移行を分析しました。 私たちの以前の研究 [35] で前述したように、腸内微生物叢ウェルネス指数は多様性の生態学的指標よりも腸全体の健康状態を示す優れた指標です。 興味深いことに、T2で腸内微生物叢ウェルネス指数の有意な上昇があり(P = 0.034、片側Wilcoxon符号付き順位検定、および図5a)、これは集中治療室滞在中の患者の腸内細菌叢の改善を示しています。 |
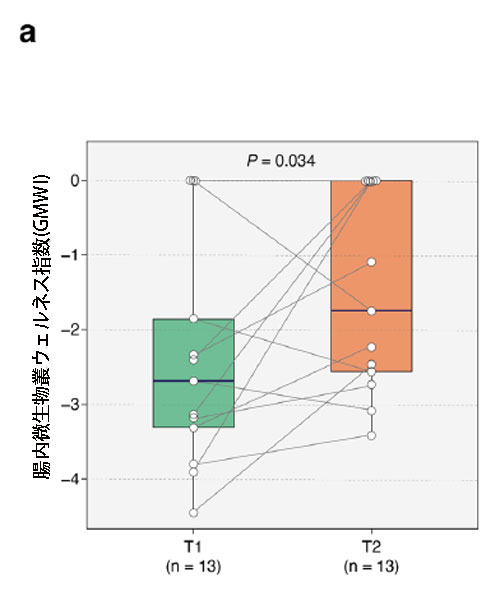 |
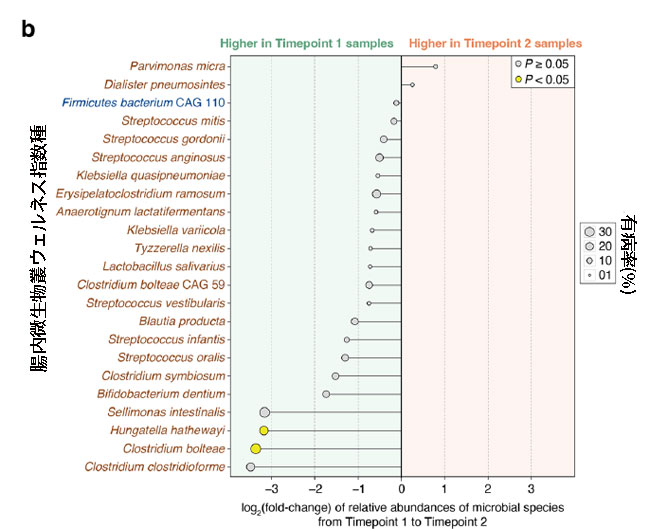 |
図 5 集中治療室患者における腸内細菌叢の健全性と 腸内微生物叢ウェルネス指数種存在量の変化。 a 腸内微生物叢ウェルネス指数は T1 から T2 まで大幅に増加しました (P = 0.034、片側ウィルコクソン符号付き順位検定)。 b グラフは、T1 と T2 の間の 腸内微生物叢ウェルネス指数種の相対存在量の倍率変化を表しており、健康を保つ種の名前は青 (n = 1)、健康を損なう種 (n = 22) の名前は茶色で示されています。 特に、2 つの健康希少種、Hungatella hathewayi と Clostridium bolteae は、T2 による相対存在量の統計的に有意な減少を示しました (P < 0.05、順列検定)。 黒い水平線は倍率変化の範囲を示し、各円のサイズは両方の時点で収集された 26 個の便サンプルにおけるそれぞれの腸内微生物叢ウェルネス指数種の有病率を反映しています。 |
| 腸内微生物叢ウェルネス指数は健康と病気に関連する微生物種の両方を計算に考慮するため、T1 と T2 の間の各腸内微生物叢ウェルネス指数種の相対存在量の変化 (追加ファイル 1: 表 S2) を調査しました。 合計 42 種の 腸内微生物叢ウェルネス指数種(健康を保つ 15 種と健康を損なう27 種)のうち、サンプルが両方の時点で入手可能だった 13 人の患者の腸内細菌叢で観察されたのは 23 種のみでした(図 5b)。 このサブセットのうち、健康を保つ種は 1 つだけ (Firmicutes 細菌 CAG110) で、残りの 22 は健康を損なうものでした。 興味深いことに、すべての腸内微生物叢ウェルネス指数種は、倍率変化の増加を示した2種、つまりParvimonas micra とDialister pneumosinteを除いて、T1からT2への倍率変化(相対存在量)の減少を示しました(図5b)。 しかし、ほとんどの種では、T1 から T2 までの相対存在量の変化は統計的に有意ではありませんでした (P ≥ 0.05、順列検定)。 T2 で統計的に有意な減少を示したのは、Hungatella hathewayi と Clostridium bolteae の 2 つの特定の種だけでした (P < 0.05、順列検定、および図 5b)。 |
| 4.議論 |
| この第 1 相研究では、胃腸系が機能し、入院前に持続的な免疫抑制を受けていない重症患者に対してケフィアの投与が安全であり、実行可能であることを実証しました。 ケフィアの投与は忍容性が高く、副作用は最小限またはまったくありませんでした。 私たちの分析では、腸内細菌叢における微生物の多様性と種の豊富さは、集中治療室でのケフィア摂取後に大幅に増加しなかったことが示されましたが(図3b-c)、時点 1 (T1) から時点 (T2) にかけて、腸内微生物叢ウェルネス指数の増加が観察されました (図 5a)。 参考までに、腸内微生物叢ウェルネス指数は腸内細菌叢の全体的な健康状態の指標として機能します [42]。 |
| 私たちが調査を計画し実施した時点では、集中治療室で重症患者にケフィアを投与することの安全性と実現可能性に関する報告は公表されていませんでした。 Lillieらは最近、経腸栄養を受けている火傷患者を含む重傷患者にケフィア120mLを1日2回投与したという後ろ向き研究の結果を論じた会議要旨を発表した[43]。 しかし、この研究の主な目的は、ケフィアを投与された患者と投与されなかった患者の間で、C. difficile感染症、カテーテル関連尿路感染症、中心線関連血流感染症の発生率を比較することであった。 その結果、2 つのグループ間で院内感染の発生率に有意な差は見られませんでした。 注目すべきことに、120mLのケフィアを1日3回投与することが、一般内科病棟に入院している患者の下痢とC. difficile感染症の発生率に影響を与えるかどうかを調査するランダム化対照試験が進行中である(NCT02707198)。 |
| 2つの時点にわたって13人の患者の腸内細菌叢を調査したところ、集中治療室入院時、すべての重症患者は集中治療室滞在中に微生物の多様性と種の豊富さの低下を示したことがわかりました(図3b、c)。 重症患者における腸内細菌叢の多様性の喪失は、短鎖脂肪酸生合成の枯渇と関連しており、院内感染を発症するリスクの増加をもたらします[4、5、44]。 集中治療室で嫌気性抗生物質の適用を受けた患者では、便中の腸球菌の濃度が増加し、これが臓器不全の数と死亡率の増加につながりました [13、45]。 心臓手術の前後で糞便細菌叢を調べた調査では、入院後に潜在的に病原性細菌種が大幅に増加し、細菌多様性の低下は入院期間の長期化と関連していることが報告された[46]。 この観察は神経重症患者の間でも注目されており、大量のEnterobacteriaceaeが退院時の修正ランキンスケールの上昇と180日死亡リスクの92%増加に関連している[47]。 肝硬変患者では、入院時に特定された腸内細菌叢の異常は、他の臨床危険因子とは無関係に、臓器不全への進行、集中治療室への移送、および死亡と関連していた[48]。 重症患者におけるこのようにベースラインの腸内細菌叢の多様性が低いことは、患者の栄養状態、併存疾患、ベースラインの腸内細菌叢の多様性の低さが重症疾患自体の発症に寄与するいくつかの危険因子の1つであるかどうかなど、多くの重要な疑問を引き起こします。 |
| 以前の研究では、発酵食品が腸内細菌叢叢の多様性を高める可能性があると報告されています[33-37]が、私たちの研究では、ケフィアを1回摂取しても、 ~ 72時間という短い期間では、重症コホートにこの効果が見られないことがわかりました。 私たちの評価がケフィア補給の72時間という短い期間内のα多様性の変化に焦点を当てていたことを考えると、この結果はまったく驚くべきことではありません。 特に患者のほとんどが抗生物質を服用していたことを考慮すると、腸内細菌叢組成の重大な変化を観察するには 72 時間では不十分である可能性があります [49, 50]。 |
| 興味深いことに、ケフィアに存在する 12 種の微生物のうち、3 種(Lactobacillus plantarum, Lactobacillus reuteri, および Lactobacillus rhamnosus)が、T2 の腸内細菌叢サンプルでより頻繁に検出されました(図 4)。 これは、抗生物質を含む投薬計画を同時に行っていたにもかかわらず、ケフィアの投与により、72 時間以内に特定の有益な微生物を集中治療室患者の腸内環境に導入できたことを示しています。 しかし、投与されたケフィアに含まれる別の微生物種であるBifidobacterium longumは、T2までに患者の有病率が減少したことが示された。 この正確な理由は不明ですが、Bifidobacterium longumは、集中治療室患者に投与される特定の薬剤、場合によっては抗生物質に対して特に感受性が高い可能性があると考えられます。 |
| 患者は集中治療室滞在中に腸内細菌の多様性の減少を示しましたが、ケフィア投与後72時間以内の腸内微生物叢ウェルネス指数の大幅な増加は、私たちの研究の興味深い発見です(図5a)。 図5aに示すように、腸内微生物叢ウェルネス指数はT2で改善しました。これは主に健康を損なう(疾患に関連する)腸内微生物叢ウェルネス指数細菌種がT1から減少したためです。 T2 による健康希少種の多くの減少は、集中治療室入室時に患者の腸内に存在するさまざまな種を排除する抗生物質治療に起因する可能性があります。 |
| 結果を解釈する際には、私たちの研究のいくつかの限界に注意する必要があります。 まず、実現可能性研究であるため、結果を比較するための対照群がありませんでした。 第二に、採用された患者の半数以上が集中治療室にいる間排便がなかったため、便サンプルを収集できませんでした。 募集された 54 人の患者のうち、採取時点で複数の便サンプルを提供した患者は 13 人だけでした。 この状況は、集中治療室患者からの自発的で非侵襲的な生体サンプル収集に依存する研究を実施する際に内在する課題を浮き彫りにしており、それによって私たちのデータから導き出せる結論の範囲が制限されています。 第三に、2 番目の時点では限られた数の便サンプルしか収集できませんでしたが、欠損データに対する特別な調整は実施しませんでした。 この研究のパイロット的な性質と、重篤な患者におけるケフィア使用後の腸内細菌叢の変化を調べるという新規性を考慮すると、欠落している追跡データの補完を試みることは非現実的であったでしょう。 第 4 に、パイロット研究としての私たちの研究の性質上、統計的検出力分析を通じて研究に必要なサンプルサイズを正確に推定することは現実的ではありませんでした。 この研究はそのアプローチにおいて先駆的なものでしたが、信頼できる既存の仮定がなかったため、患者集団の分散を事前に予測することはできませんでした。 それにもかかわらず、私たちはサンプルサイズがこの目的を達成するのに十分だったと信じています。 確かに、この研究から得られたデータは、有効性を判定することを目的とした将来のランダム化試験のためのより正確なサンプルサイズの推定を提供するために不可欠であり、私たちの研究とこの分野の他の研究の両方に利益をもたらします。 最後に、この単一群のパイロット研究では抗生物質の影響を制御することはできませんでした。 しかし、2 つの便サンプルを採取できたすべての患者が嫌気性をカバーする抗生物質の投与を受けていたことは注目に値します。 したがって、研究コホート全体でこの均一な治療背景を考慮すると、抗生物質は、最初から 2 回目の糞便サンプルで観察された腸内細菌叢の変化の交絡因子とはみなされませんでした。 |
| 上記の制限にもかかわらず、私たちの研究は、潜在的な副作用と忍容性を注意深く監視しながら、漸増用量レジメンで重症患者にケフィアを投与するこの種の最初の研究です。 今後の研究は、ケフィアの投与量の最適化、サンプル収集方法の強化、対照群の導入に重点を置く必要があります。 これらの改善は、ケフィアの安全性、忍容性、腸内毒素症の軽減における可能性をより包括的に評価するために非常に重要です。 このような進歩は、集中治療室環境における患者の転帰の改善に大きく貢献する可能性があります。 |
| 5.結論 |
| 私たちの研究は、胃腸系が機能している重症患者にケフィアを安全かつ実行可能に投与できることを確認しました。 私たちの調査結果は、集中治療室入院時の患者における腸内細菌叢の多様性の顕著な欠如を浮き彫りにしました。 腸内毒素症と患者の有害な転帰との間の関連性が十分に確立されていることを考慮すると、集中治療室にいる患者の腸内細菌叢の強化に引き続き注力することが不可欠です。 |
 |
 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、BMC Med. 2024; 22: 80.に掲載されたSafety, feasibility, and impact on the gut microbiome of kefir administration in critically ill adults.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |