
Arun Kumar et al., |
要約 |
| 乳酸菌媒介の健康な老化に関するエリー・メチニコフ博士の仮説以来、いくつかの微生物が健康な老化のさまざまな特徴を備えて寿命を延ばすことが報告されています。 しかし、健康な老化のさまざまな特徴に影響を与える微生物は、次世代のプロバイオティクスとしてより広く受け入れられ、市場性を高めるために選ばれています。 私たちは、発酵食品サンプルから単離されたLactobacillus plantarum JBC5 (以下はLPJBC5と記載) が長寿と健康な老化に及ぼす可能性とその根底にあるメカニズムを理解するためのモデルとしてCaenorhabditis elegans(以下は線虫と記載)を採用しました。 まず、LPJBC5 は、対照 (未処理) と比較して線虫の平均寿命を 27.81% 延長しました。 LPBC5 誘発の長寿には、身体機能、脂肪、リポフスチンの蓄積など、老化に関連するバイオマーカーの向上が伴っていました。 変異体線虫の寿命アッセイと遺伝子発現研究により、LPJBC5 媒介の長寿は、p38 MAPK シグナル伝達カスケードを通じて活性化されるスキンヘッド 1 (skn-1) 遺伝子の上方制御によるものであることが示されました。 第二に、活性化された転写因子 SKN-1 は、抗酸化遺伝子、耐熱性遺伝子、抗病原性遺伝子の発現を上方制御しました。 これを裏付けるように、LPJBC5 は酸化、熱、病原体などの非生物的および生物的ストレスに対する耐性を与えました。 LPJBC5 は、腸のタイトジャンクションタンパク質 ZOO-1 の発現を上方制御し、腸の完全性を改善しました。 第三に、LPJBC5 は、LPJBC5 で訓練された線虫の学習と記憶を、ナイーブな線虫と比較して向上させました。 その結果、LPJBC5を与えられた線虫では、対照と比較してセロトニンシグナル伝達に関与する遺伝子(ser-1、mod-1、およびtph-1)が上方制御されていることが示され、LPJBC5を介した認知機能の改善にはセロトニンシグナル伝達が不可欠であることが示唆されました。 第四に、LPJBC5 は、脂肪代謝の重要な基質および酵素をコードする遺伝子 (すなわち、脂肪5 および脂肪7) の発現を減少させることにより、線虫における脂肪の蓄積を減少させました。 最後に、LPJBC5 は活性酸素種の生成を減少させ、ミトコンドリア機能を改善し、それによって線虫のアポトーシスを減少させました。 単一の細菌が長寿を促進する能力と、腸の健全性や認知機能の強化を含む健康的な老化の特徴により、次世代のプロバイオティクスとして推進される理想的な候補となっています。 |
| 目次(クリックして記事にアクセスできます) |
| 2.材料と方法 |
| 2.1. 材料 |
| 2.2. 細菌株と増殖条件 |
| 2.3. LPJBC5におけるプロバイオティクスマーカー遺伝子の存在の同定 |
| 2.4. 系統樹 |
| 2.5. 胃腸(GIT)通過までの生存 |
| 2.6. 胆汁酸耐性のアッセイ |
| 2.7. 腸細胞への接着 |
| 2.8. 長寿アッセイ |
| 2.9. 咽頭ポンプ作用と運動活動の測定 |
| 2.10. 発達速度アッセイ |
| 2.11. 体のサイズの測定 |
| 2.12. 定着の効率 |
| 2.13. 老化による色素の蓄積 |
| 2.14. 同腹のサイズ |
| 2.15. 脂肪蓄積の測定 |
| 2.16. 食餌嗜好性と学習記憶 |
| 2.17. 耐熱性および酸化ストレス耐性アッセイ |
| 2.18. 病原性細菌感染症に対する耐性の判定 |
| 2.19. 病原性感染に対する腸の完全性の測定 (スマーフアッセイ) |
| 2.20. RNA の単離、cDNA 合成、および定量的逆転写ポリメラーゼ連鎖反応 (qRT-PCR) |
| 2.21. GSH/GSSG アッセイ |
| 2.22 SOD活性アッセイ |
| 2.23.細胞内ROS生成の測定 |
| 2.24.活性酸素の生成とミトコンドリアの膜貫通電位の変化の測定 |
| 2.25.細胞内アデノシン三リン酸(ATP)協働の測定 |
| 2.26.トンネルアッセイによるアポトーシスの定量化 |
| 2.27.統計分析 |
| 3.結果 |
| 3.1. LPJBC5の分子分類学的特徴付けとインビトロ胃腸状態における持続性 |
| 3.2. LPJBC5は寿命を延ばし、線虫の発育を遅らせる |
| 3.3. LPJBC5は線虫の腸内に効率的に定着します |
| 3.4. LPJBC5の摂食により線虫の老化が遅れる |
| 3.5. LPJBC5の給餌により線虫の脂肪の蓄積が減少した |
| 3.6. LPJBC5は線虫における学習と記憶を改善する |
| 3.7. LPJBC5の給餌により非生物的および生物的ストレス条件に対する耐性が付与される |
| 3.8. LPJBC5を餌とする線虫の寿命延長効果に関与する経路の理解 |
| 3.9. LPJBC5が誘発する線虫の健康な老化の分子メカニズムを解明する |
| 3.10. LPJBC5の給餌により活性酸素種の生成が減少した |
| 3.11. LPJBC5 線虫のミトコンドリア機能の改善 |
| 3.12. LPJBC5 は線虫のプログラムされた細胞死を遅らせる |
| 4.討議 |
| 5.結論 |
| 本文 |
| 1. はじめに |
| 人口の高齢化は世界経済に大きな影響を与えます[1]。 健康的な老化とは、「高齢になっても健康に過ごせる機能的能力を開発および維持するプロセス」を指し、最近の関心事となっています[2]。 機能的能力は、人生の後期の抗酸化段階における生理学的、認知的、代謝的、および免疫学的機能を構成します [3]。 高齢は多くの病気の重要な危険因子であると考えられています。 これには、がん、糖尿病、肥満、神経変性疾患、心血管疾患、感染症などが含まれます[4]。 老化のプロセスは、遺伝学、病歴、薬理学的および食事療法の影響を受けます[5-8]。 過去数十年の間に、長寿と健康的な老化に関する研究が大幅に増加しました。 無脊椎動物(虫やハエ)と脊椎動物宿主(マウスや人間)の両方における食事介入に関するいくつかの研究では、健康的な老化を可能にすることが示されています[8-10]。 |
| 人口の高齢化は世界経済に大きな影響を与えます[1]。 健康的な老化とは、「高齢になっても健康に過ごせる機能的能力を開発および維持するプロセス」を指し、最近の関心事となっています[2]。 機能的能力は、人生の後期の抗酸化段階における生理学的、認知的、代謝的、および免疫学的機能を構成します [3]。 高齢は多くの病気の重要な危険因子であると考えられています。 これには、がん、糖尿病、肥満、神経変性疾患、心血管疾患、感染症などが含まれます[4]。 老化のプロセスは、遺伝学、病歴、薬理学的および食事療法の影響を受けます[5-8]。 過去数十年の間に、長寿と健康的な老化に関する研究が大幅に増加しました。 無脊椎動物(虫やハエ)と脊椎動物宿主(マウスや人間)の両方における食事介入に関するいくつかの研究では、健康的な老化を可能にすることが示されています[8-10]。 |
| プロバイオティクス微生物は、抗菌効果、栄養補給、免疫調節、宿主の腸内の健康な微生物叢の維持によって宿主の健康を改善し、それによって健康的な老化も可能にすることが知られています[16]。 1世紀前、エリー・メチニコフ博士は、乳酸菌を含むヨーグルトの摂取がブルガリアの農民の寿命の延長と健康状態の改善につながることを観察しました[17]。 これは、プロバイオティクスによる長寿に関する最初の観察でした。 乳酸菌属 は、誕生以来人間の胃腸管に定着する最も重要な細菌です [18]。 研究では、乳酸菌の数は年齢とともに減少し、高齢者にプロバイオティック乳酸菌を補給すると、腸内細菌叢の組成を調整し、免疫力と腸の健康を強化することで健康を改善することが示唆されています[19-21]。 これまでの報告では、酸化ストレスや毒性に対する耐性、病原性感染症からの保護、脂肪蓄積の減少、認知力の改善、炎症、代謝障害、神経変性疾患の緩和など、健康的な老化のさまざまな特徴による長寿に対する乳酸菌の役割が示されている[12-14, 22–32]。 しかし、健康な老化のこれらの多様な特徴に影響を与える単一の微生物は、次世代のプロバイオティクスとしての受け入れと市場性を高めるでしょう。 インドのアッサム州の酪農場からの沸騰した牛乳と生乳を使用して調製されたヨーグルトの細菌に関する我々の以前の研究[33]では、潜在的なプロバイオティクス細菌が単離され、それは分類学的にLactobacillus plantarumJBC5(LPJBC5)として特徴付けられました。 この研究では、LPJBC5 が長寿と健康的な老化のさまざまな側面を可能にすることを実証しました。 これには、加齢に伴う身体機能の遅れ、脂肪蓄積の減少、非生物的および生物的ストレスに対する耐性の向上、腸の完全性、認知機能、ミトコンドリア機能、線虫のアポトーシスの減少などが含まれます。 私たちの研究は、乳酸菌LPJBC5 が健康的な老化のさまざまな特徴に影響を及ぼし、次世代のプロバイオティクスとして推進される理想的な候補となることを示しています。 |
| 2.材料と方法 |
| 2.1. 材料 |
| deMan、Rogosa and Sharpe (MRS)、Nutrient 寒天および Luria-Bertini (LB) 寒天を含むすべての微生物増殖培地は、インドの Himedia から入手しました。 細菌対照食品 E. coli OP50 (以下はOP50と記載)、線虫野生型株 N2 およびその変異体 (DR1572 daf-2 (e1368)、AU1 sek-1 (ag1)、KU25 pmk-1 (km25) を含む)、 GR1307 daf-16 (mgDf50)、AU3 nsy-1 (ag3)、および EU31 skn-1(zu135) および EU1 skn-1 (zu67) は、米国ミネソタ大学の Caenorhabditis Genetics Center (CGC) から入手しました。 すべての実験は、線虫の自家受精雌雄同体株を用いて行われました。 病原菌株Staphylococcus aureus MTCC 3160 は、インド、チャンディーガルの CSIR 微生物技術研究所 (CSIR-IMTECH) の微生物培養コレクションから入手しました。 上皮腸細胞株 HT-29 は、インドのプネにある国立細胞科学センターから入手しました。 ゲノム抽出キットはドイツの Sigma から購入しました。 RNAeasy ミニキット (Invitrogen、米国マサチューセッツ州ウォルサム) を使用して全 RNA を単離し、Verso cDNA 合成キット (Thermo Scientific、米国マサチューセッツ州ウォルサム) を使用して cDNA に逆転写しました。 |
| 2.2. 細菌株と増殖条件 |
| LPJBC5 を接種し、MRS ブロス中で 30℃ で 18 時間培養しましたが、OP50 は Luria-Bertini ブロス中で 37℃ で一晩培養しました。 病原性Staphylococcus aureus 株を接種し、栄養ブロス中で 37℃で一晩培養しました。 これらの細菌株はすべて、150 rpm の振盪条件下で培養されました。 |
| 2.3. LPJBC5におけるプロバイオティクスマーカー遺伝子の存在の同定 |
| 以前に記載されているように [34]種特異的なコラーゲン結合タンパク質と胆汁酸塩加水分解酵素をコードするプロバイオティクスマーカー遺伝子の存在が LPJBC5 で確認されました。 さらに、L. plantarum の特異的配列と抗菌遺伝子 (プランタリシン生合成遺伝子) が増幅され、LPJBC5 で配列決定されました [35,36]。 ゲノム DNA はゲノム抽出キットを使用して抽出され、その濃度は NanoDropTM 2000c 分光光度計 (Thermo Scientific、米国) を使用して測定されました。 PCR 反応は、2.5 L の 10 Taq バッファー、1.5 U の Taq DNA ポリメラーゼ (Sigma、ダルムシュタット、ドイツ)、1.5 mM の MgCl2、100 M の dNTP 混合物およびを各プライマーペア 10 pmol および細菌 DNA 50 ng含む合計 25 L の反応混合物でセットアップしました。 PCR は、PCR サーマルサイクラー (Eppendorf、ハンブルク、ドイツ) で次の条件を使用して実行されました。 96℃で5分間、続いて94℃で30秒間、57℃で30秒間、72℃で1分間、および72℃で5分間を35サイクル。 増幅産物を 1.5% アガロースゲル上で泳動し、UV トランスイルミネーター (Vilber、Collégien、フランス) の下で画像化しました。 精製された PCR 増幅フラグメントの配列決定は、Macrogen Inc. (ソウル、韓国) で実施されました。 DNA 配列は BLAST 分析に供され、NCBI (国立バイオテクノロジー情報センター、米国メリーランド州ロックビル、ベセスダ) データベースに提出されました。 |
| 2.4. 系統樹 |
| LPJBC5 株の系統関係を決定するために、16S rDNA 遺伝子配列を他の乳酸菌株およびアウトグループの 1 属 Enterococcus faecium ATCC 19434 と比較しました。 系統発生上の近隣の同定とペアごとの 16S rDNA 遺伝子配列の類似性の計算と、系統樹解析ソフトウェア (MEGA 7 バージョン) を使用したアラインメントを行いました [37]。 系統樹の再構築には隣接結合アルゴリズムが使用されました。 ブートストラップ分析は、分岐の信頼限界を決定するために実行されました。 |
| 2.5. 胃腸(GIT)通過までの生存 |
| 模擬胃液は、Conway et al. によって記載された方法を使用して調製されました [38]。 まず、増殖した LPJBC5 培養物 (109 CFU/mL) を PBS で 2 回洗浄し、pH 2.0 の 胃腸 ジュース (0.3% ペプシン) に再懸濁し、37 °C で 0 時間、1 時間、および 3 時間培養しました。 次に、増殖したLPJBC5培養物(109CFU/mL)をPBSで洗浄し、腸液(0.1%ブタパンクレアチン、Sigma、ドイツ)に再懸濁し、さらにpH8.0に調整した。 処理したLPJBC5細胞を37℃で4時間培養しました。 第三に、LPJBC5 の耐酸性を、PBS の 1.0、3.0、および 7.0 (対照とみなされる) の異なる pH 範囲で評価しました。 LPJBC5 培養物 (109 CFU/mL) を 10 mL の異なる pH 溶液に添加し、37 °C で 4 時間培養しました。 各実験は 3 回ずつ行い、培養時間の完了後、MRS 寒天プレートに播種して各処理の生存 LPJBC5 細胞を計数し、37 °C で 24 ~ 48 時間イ培養しました。 |
| 2.6. 胆汁酸耐性のアッセイ |
| 分離株 LPJBC5 の胆汁酸塩に対する耐性は、Vinderola と Reinheimer によって記載された手順を使用して測定されました [39]。 簡単に説明すると、胆汁酸塩の溶液は、牛胆汁(Sigma、ダルムシュタット、ドイツ)を使用して0.3%および1%の濃度で調製され、PBSが対照として機能した。 増殖した分離株 LPJBC5 の 109 CFU/mL 細胞をさらに 10 mL 胆汁酸塩溶液に添加し、37 °C で 0 時間および 4 時間培養しました。 生存LPJBC5細胞をMRS寒天プレート上に広げて各処理ごとに計数し、37℃で24〜48時間培養しました。 |
| 2.7. 腸細胞への接着 |
| 上皮腸細胞株 HT-29 に対する LPJBC5 の接着能力を、Ayeni et al. で議論されている手順を使用してテストしました [40]。 分離株LPJBC5の接着を、DMEM懸濁液中の初期集団と比較した、4時間の培養後のHT-29細胞株への接着細胞の数として計算した。 |
| 2.8. 長寿アッセイ |
| 線虫増殖培地 (NGM) プレート (60 mm) に、M9 緩衝液 (22 mM KH2PO4、42 mM Na2HPO4、および 86 mM NaCl) に懸濁した 109 CFU/mL の OP50 または LPJBC5 を播種しました [41]。 線虫の同期は、Stiernagle [42] によって説明された修正手順によって実行されました。 「簡単に説明すると、十分な量の自家受精雌雄同体虫の卵を含む NGM プレートを脱イオン水 (Millipore、バーリントン、マサチューセッツ州、米国) で洗浄し、ピペットで 5 mL の円錐遠心管に移しました。 脱イオン水を円錐形遠心管中で3.5mLに調整し、1mLの次亜塩素酸ナトリウム漂白剤と0.5mLの5N NaOHとの混合物1.5mL容量を加えた。 次いで、チューブを約2分間攪拌し、7500rpmで遠心分離して、放出された卵をペレット化した。 上清を捨て、線虫のペレットを脱イオン水で2回洗浄した。 最後に、残りのペレットを約 0.1 mL の脱イオン水に懸濁し、標準的な細菌性食品E. coli OP50 を播種した NGM プレートに移しました。 寿命アッセイは、若い成体野生型 N2 および変異体線虫を用いて行われました。 寿命実験は、各 NGM プレートに 50 匹の線虫を含み、プレートを 20 °C でさらに培養する 3 つの技術的反復で実行されました。 十分な細菌の餌を維持するために、24 時間ごとに線虫を数え、2 日ごとに新しい NGM プレートに移しました。 線虫がプレートの壁に付着し、体内での子孫の孵化と外陰部の爆発による異常死を示した場合、線虫は寿命分析から除外されました [41]。 OASIS 2 ソフトウェアのカプラン・マイヤー法を使用して生存分析が行われ、平均寿命が計算されました [43]。 |
| 2.9. 咽頭ポンプ作用と運動活動の測定 |
| 線虫の咽頭ポンプと運動活動は、Nakagaw et al.によって記載されたプロトコルを使用して測定されました [12]。 同期した線虫は、最初に OP50 で 2 日間増殖し、成体になるまでさらに 14 日間 OP50 または LPJBC5 で培養しました。 次いで、線虫を、ポンプ速度または運動能力を記録する30分前に、新しいOP50を播種したNGMプレートに移した。 咽頭ポンプ速度の数は、ステレオズーム顕微鏡 (SMZ1270、ニコン、東京、日本) を使用して 30 秒間測定されました [12]。 運動速度は、ステレオズーム顕微鏡を使用して NGM プレート上で 1 分あたりの体の曲がりをカウントすることによって測定されました [12]。 各細菌株について 10 匹の線虫を評価し、細菌ごとに 3 つの複製を使用しました。 |
| 2.10. 発育速度アッセイ |
| 両方の細菌食を与えられた線虫の発育速度は、Soukas et al. によって記載された手順を使用して分析されました [44]。 約 100 匹の年齢を同期させた線虫を、OP50 を播種した NGM プレート上に 30 分間産卵させ、漂白プロトコルを使用して同期させました。 線虫が幼成体段階に達したら、細菌株あたり 20 匹の線虫を OP50 または LPJBC5 を播種した NGM プレートに 3 連で個別に移し、最初の産卵が観察されるまで 30 分ごとにステレオズーム顕微鏡 (SMZ1270、ニコン、日本) で継続的に観察しました。 |
| 2.11.体のサイズの測定 |
| OP50 および LPJBC5 を餌とした線虫の体サイズは、Zanni et al. の記載に従って決定されました [45]。 年齢同期した線虫を最初に OP50 上で 3 日間培養し、OP50 または LPJBC5 (109 CFU/mL) を播種したプレートに移しました。 画像は、生後7日目まで24時間ごとにステレオズーム顕微鏡(SMZ1270、ニコン、日本)を使用して撮影され、体サイズはImageJソフトウェア(米国メリーランド州国立衛生研究所)を使用して測定されました。 体の大きさの測定には各菌株で増殖させた10匹の線虫を使用し、再現性を確保するために実験は3回行った。 |
| 2.12. 定着の効率 |
| 同期した線虫の卵を、OP50 または LPJBC5 を播種した NGM プレートに移しました。 細菌株あたり合計 10 匹の虫を洗浄し、さらに溶解して、3 日目と 8 日目の定着効率を確認しました。 LPJBC5 または OP50 を与えられた線虫の全線虫溶解物を、プレートを含むそれぞれの培地に 3 つずつ播種しました [46]。 それぞれの培養条件で培養した後、各細菌株のコロニー形成単位 (CFU) をカウントしました。 |
| 2.13. 老化による色素の蓄積 |
| 線虫の老化色素の蓄積またはリポフスチンレベルに関する研究は、Kwon et al. によって記載されているように実施されました [41]。 簡単に説明すると、線虫を OP50 または LPJBC5 上で 14 日間培養し、洗浄し、共焦点顕微鏡 (TCS SPE、Leica、Wetzlar、ドイツ) 用のガラス スライド上の 3% (w/v) アガロース パッドに移しました。 ImageJ ソフトウェアを使用して細菌株ごとに 10 匹の線虫を定量し、細菌ごとに 3 つの複製を使用しました。 |
| 2.14. 同腹のサイズ |
| 線虫の同腹のサイズは、Zanni et al. の記載に従って決定されました [45]。 線虫あたりの子孫の数が計算され、実験は両方の細菌株について 3 回行われました。 |
| 2.15. 脂肪蓄積の測定 |
| 年齢を同調させた若い成虫を OP50 または LPJBC5 で 14 日間培養しました。 さらに、体脂肪の蓄積は、NAKAGAWA et al.によって記載されたプロトコールに従って、線虫のオイルレッド O (ORO) 染色によって検査されました [12]。 複合顕微鏡(10×および20×対物レンズ)(AX10、Carl Zeiss、Jena、Germany)を使用して脂質蓄積を観察および画像化し、相対的な染色強度をImageJソフトウェアで定量しました。 各細菌株の脂肪の蓄積を定量化するために 10 匹の線虫が分析され、細菌ごとに 3 つの複製が使用されました。 |
| 2.16 食餌嗜好性と学習記憶 |
| Bendesky らによって記載されているように、バイナリ選択アッセイは、さまざまな細菌食餌に対する線虫の食餌嗜好性を観察するために実行されました [47]。 アッセイは 60 mm NGM プレート上で実施されました。 合計 25 μL の LPJBC5 または OP50 (109 CFU/mL) をプレートの反対側に播種し、層流気流下で 1 時間乾燥させました。 3 日目の線虫 (1 プレートあたり 30 匹の線虫) を、OP50 と LPJBC5 の等距離の菌叢を含む NGM プレートの中心に個別に移し、4 時間後に両方の菌叢の線虫を数え、実験を 3 回繰り返しました。 線虫の細菌の食餌嗜好性の選択指数 (CI) は次のように計算されました。 |
| 選択指数 (CI) = LPJBC5 の線虫の数 – OP50 の線虫の数 / アッセイで使用された線虫の総数 |
| CI = -1.0 は、対照食品 OP50 に対する完全な食餌嗜好性を示します。 |
| CI = +1.0 は、細菌 LPJBC5 をテストするための完全な食餌嗜好性を示します。 |
| CI = 0.0 は、OP50 と LPJBC5 の両方の食餌嗜好性の分布が等しいことを示します。 |
| トレーニングのために、3 日目の線虫 (n = 30) を LPJBC5 を播種した NGM プレート上で培養し、20 °C で 4 時間培養しました。 線虫をさらにM9緩衝液で3回洗浄し、OP50およびLPJBC5の等距離の位置を播種したプレートの中央に移した。 メモリ指数は次のように計算されました。 |
| 記憶指数 = CI (トレーニング済み LPJBC5) − CI (ナイーブ OP50) |
| プレートあたり合計 30 匹の線虫を各選好アッセイで分析し、実験を 3 回繰り返しました。 |
| 2.17. 耐熱性および酸化ストレス耐性アッセイ |
| 年齢同調線虫は、最初に若年成虫段階まで OP50 上で培養し、その後 OP50 または LPJBC5 を播種した NGM プレートに個別に移し、20 °C で 3 日間培養しました。 耐熱性アッセイでは、これらの培養プレートを 35 °C に維持し、すべてが死ぬまで生存可能な線虫を 1 時間ごとに数えました [48]。 |
| 酸化ストレス耐性アッセイでは、3 日目の若い線虫を OP50 または LPJBC5 で 3 日間増殖させ、個別に採取して 100 mM パラコートを含む M9 溶液 (Sigma Aldrich、セントルイス、ミズーリ州、米国) に移し、20 ℃で培養しました [49]。 8時間後に生存可能な線虫を数えました。 各処理に対して 50 匹の線虫を 3 つのウェルに移し、各処理について実験を 3 回繰り返しました。 リポフスチンレベルも、前述のように共焦点顕微鏡を使用して、100 mM パラコート中で 8 時間培養した後に測定しました (材料と方法 2.13 を参照)。 ImageJ ソフトウェアを使用して各処理について 10 匹の線虫を定量化し、各処理に 3 つの複製を使用しました。 |
| 2.18. 病原性細菌感染症に対する耐性の判定 |
| 年齢を同調させた若い成虫を、最初に OP50 を播種したプレートで増殖させ、さらに OP50 または LPJBC5 を播種した NGM プレートに個別に 3 日間移しました。 次に、これらの線虫を、病原性細菌であるS. aureus (109 CFU/mL) を播種した NGM プレートに個別に移し、20 °C で培養しました [41]。 線虫の生存を 24 時間ごとに記録しました。 各プレートには合計 50 匹の線虫が使用され、実験は細菌ごとに 3 回行われました。 |
| 2.19. 病原性感染に対する腸の完全性の測定(スマーフアッセイ) |
| 腸関門感染症に対する LPJBC5 の効果は、Kim と Moon に従って評価されました [50]。 簡単に説明すると、OP50 で増殖した年齢同調の若い成虫を OP50 または LPJBC5 で 5 日間培養しました。 次いで、これらの線虫を、病原体S. aureusを播種したNGMプレートに2日間個別に移した。 病原体曝露に応答した腸管透過性を観察するために、OP50 を 70 °C で 2 時間加熱死滅させました (LB 寒天上にプレーティングすることによって確認されました)。 加熱死滅させたOP50培養物を遠心分離し、ペレットを青色食用色素(5%w/v)に再懸濁し、室温、35rpmで3時間振盪した。 次に、この線虫を、青色の食用色素で染色した加熱殺菌した OP50 を含む液体 NGM 培地中で 3 時間増殖させました。 線虫を M9 バッファーで数回洗浄し、25 mM レバミゾール (L-025、Sigma、ドイツ) を含む同じバッファーで麻酔し、複合顕微鏡 (AX10、Carl Zeiss、ドイツ) で 10 倍および 20 倍の倍率で画像化しました。 線虫 (n = 10) の体内の青色の食用色素を、ImageJ ソフトウェアを使用して 10 倍の倍率で定量的に分析しました。 |
| 2.20. RNA の単離、cDNA 合成、および定量的逆転写ポリメラーゼ連鎖反応 (qRT-PCR) |
| 年齢を同期させた線虫を OP50 上で 20 °C で 2 日間増殖させました。 次いで、若い成虫を、LPJBC5 または OP50 を播種した NGM プレートに 24 時間移しました。 グループあたり約 500 匹の線虫を収集し、洗浄して全 RNA を抽出しました。 抽出したRNA約1μgをVerso cDNA合成キットを用いてcDNAに逆転写した。 リアルタイム PCR 装置 (Applied Biosystems、米国) で SYBR Green (Applied Biosystems、米国) を使用して、遺伝子の発現を測定するために qRT-PCR を実行しました。 遺伝子には、DAF-2/DAF-16 (daf-2 および daf-16)、p38 MAPK (nsy-1、sek-1、および pmk-1) およびその下流遺伝子 (skn-1 および skn-1b) が含まれます。 FOXA 転写因子 pha-4、フェーズ 2 解毒遺伝子 GST (gst-4、gst-7 および gst-10)、カタラーゼ (ctl-1 および ctl2)、チオレドキシン-1 (trx-1) および SOD (sod-1) 、sod-2およびsod-3)、ヒートショックタンパク質HSP(hsp-60およびhsp-70、hsp-16.1およびhsp-16.2)、脂肪代謝の主要な基質および酵素をコードする遺伝子(fat-5、fat-6) およびfat-7)、セロトニンシグナル伝達遺伝子(ser-1、mod-1、およびtph-1)、自然免疫遺伝子[サポニン様タンパク質(spp-1およびspp-7)、リゾチーム(lys-1およびlys- 8)、C 型レクチン (CLEC) ドメイン含有タンパク質 (clec-60 および clec-85) および抗菌因子 (ABF) (abf-1、abf-2 および abf-3)]、密着結合タンパク質小帯オクルディン動物園 -1、ミトコンドリア DNA (mtDNA) は、NADH ユビキノン酸化還元酵素チェーン 1 (nd-1)、抗アポトーシス (ced-9) およびプロアポトーシス (ced-3 および ced-4) 遺伝子をコードしました。 研究された遺伝子のプライマー配列は表S2にリストされています。 実験は 3 回繰り返して実行されました。 各遺伝子の相対発現は、2-ΔΔCt 法 [51] を使用して分析されました。 ハウスキーピング遺伝子 act-1 を使用して、各遺伝子の発現を正規化しました。 |
| 自然免疫遺伝子の発現は、若い成虫を LPJBC5 または OP50 で 24 時間前培養し、次にS. aureusを播種した NGM プレートに移すことによって研究されました。 感染後 12 時間後、線虫を収集し、M9 緩衝液で 3 回洗浄しました。 RNAの単離、cDNA合成、およびqRT-PCRを上記のように実施した。 |
| 2.21. GSH/GSSG アッセイ |
| グルタチオン アッセイ キット (Promega、米国ウィスコンシン州マディソン) を使用して、メーカーの指示に従って、OP50 または LPJBC5 で増殖させた 14 日目の線虫の還元型グルタチオン (GSH) と酸化型グルタチオン (GSSG) を個別に測定しました。 これは、線虫内の GSH と GSSG の両方を検出する発光ベースのシステムです。 簡単に言うと、線虫を 96 ウェル平底プレートのウェルに移しました。 50μL容量の総グルタチオン溶解試薬または酸化グルタチオン溶解試薬を96ウェルプレートの各ウェルグループに添加し、プレートを室温で5分間3000rpmで振盪した。 ルシフェリン生成試薬を添加し(50μL/ウェル)、プレートを室温で30分間培養した。 ルシフェリン検出試薬を各ウェルに添加し(100μL/ウェル)、マルチモードプレートリーダー(Varioskan Flash、Thermo Scientific、USA)で562nmで発光を記録した。 LPJBC5を与えられた線虫とOP50を与えられた線虫の両方で発光の総レベルが検出され、GSH対GSSGの比が計算された。 各細菌処理グループに 100 匹の線虫が使用され、実験は 3 回行われました。 |
| 2.22 SOD活性アッセイ |
| SOD アッセイ キット-WST (19160、Sigma、米国) を使用して、メーカーの指示に従って、OP50 または LPJBC5 で増殖させた 14 日目の線虫のスーパーオキシド ジスムターゼ (SOD) 活性を測定しました。 さらに、必要なタンパク質抽出物の調製と SOD 活性のさらなる測定は、NAKAGAWA ら.によって記載された手順を使用して実行されました [12]。 タンパク質抽出物の調製にはグループあたり 100 匹の線虫が使用され、実験は 3 回行われました。 |
| 2.23. 細胞内ROS生成の測定 |
| Yoonらによって記載されているように、蛍光非極性プローブ2',7'-ジクロロフルオレセインジアセテート(H2DCFDA)を使用して、OP50またはLPJBC5で増殖させた14日目の線虫のin vivo細胞質ROSを測定しました [52]。 簡単に説明すると、タンパク質抽出物を調製し、各サンプルにつき 25 マイクログラムのタンパク質を PBS に溶解して最終容量を 50 μL にしました。 タンパク質溶解物(25μg/サンプル)またはPBS(対照)を、PBS中の50μMクロロメチル-H2DCFDA 100μLとさらに混合し、96ウェル黒色マイクロプレートのウェルに移した。 プレートを 37 °C で 4 時間保存し、マルチモード リーダー (励起-485、発光-535) (Varioskan Flash、Thermo Scientific、米国) を使用して蛍光強度をさらに測定しました。 実験は 3 つの生物学的複製で行われ、細菌処理グループあたり 100 匹の虫が蛍光測定に使用されました。 蛍光強度は、対照(線虫なし)の蛍光強度を差し引いた後に正規化した。 |
| 2.24.活性酸素の生成とミトコンドリアの膜貫通電位の変化の測定 |
| MitoTracker® Red CM-H2XRos 試薬 (M7513、Invitrogen、米国) を使用して、Dilberger らによって記載された手順を使用して、OP50 または LPJBC5 で増殖させた 14 日目の線虫のミトコンドリア ROS を測定しました [53]。 簡単に説明すると、線虫を 5 μM MitoTracker® Red CM-H2XRos 試薬 (M7513、Invitrogen、USA) 中で室温で 4 時間培養しました。 次に、洗浄した線虫を共焦点顕微鏡 (525 ± 45 nm で励起、595 ± 35 nm で発光) で視覚化しました [53]。 実験は 3 回行い、細菌処理グループあたり 10 匹の線虫を蛍光強度の測定に使用しました。 |
| JC-1 染色色素 (T3168、Invitrogen、米国) を使用して、OP50 または LPJBC5 上で増殖させた 14 日目の線虫のミトコンドリア膜貫通電位を、前述の手順 (Nakawa et al.) によって決定しました [12]。 蛍光測定にはグループあたり 100 匹の線虫が使用され、実験は反復して行われました。 蛍光強度は、対照(線虫なし)の蛍光強度を差し引いた後に正規化した。 |
| 2.25.細胞内アデノシン三リン酸(ATP)協働の測定 |
| Roche ATP 生物発光 HSII キット (Merck、ダルムシュタット、ドイツ) を、メーカーの指示に従って生物発光に基づく ATP 濃度の検出に使用しました。 簡単に言うと、ATP (1 μM ~ 1 × 10-5 μM) の標準曲線を作成しました。 OP50 または LPJBC5 で増殖させた 14 日目の線虫を PBS で 3 回洗浄し、NAKAGAWAらの記載に従ってタンパク質抽出物を調製しました [12]。 各サンプルまたは PBS (サンプル ブランク) の生物発光を、マルチモード プレート リーダーで ATP 標準と比較して測定しました。 各サンプル中のATP濃度は、標準曲線の両対数プロットを使用して計算され、その値はATPのnmol/mgタンパク質で表されました。 ATP 濃度の測定にはグループあたり 100 匹の線虫が使用され、各実験は 3 回行われました。 |
| 2.26.トンネルアッセイによるアポトーシスの定量化 |
| In Situ 細胞死検出キット、フルオレセイン (Merck、ドイツ) を使用して、OP50 または LPJBC5 で増殖した 17 日目の線虫のアポトーシスを検出および定量しました。 手順は製造元の指示に従って実行されました。 細菌処理グループあたり 100 匹の線虫を使用して蛍光強度を検出し、各実験を 3 回実行しました。 |
| 2.27.統計分析 |
| 表されたすべてのデータは、独立した 3 回の反復の結果であり、すべての実験は 2 回繰り返されました。 データは、3 回の測定の平均値 ± 標準誤差平均 (SEM) として表されました。 OASIS 2 プログラムは、寿命の生存分析やその他の生存アッセイに使用されました。 線虫の生存曲線間の差異は、ログランク検定を使用して評価されました。 すべての統計計算分析は、SigmaPlot バージョン 12.0 (米国カリフォルニア州サンノゼ) を使用して実行されました。 治療/グループ間の統計分析は、一元配置分散分析 (ANOVA) とスチューデントの t 検定を使用して実行されました。 データが正規分布していない場合は、Mann-Whitney U 検定が実行されました。 2 セットのデータ間で、p 値 <0.05 は統計的に有意であるとみなされます。 |
| 3. 結果 |
| 3.1. LPJBC5 の分子分類学的特徴付けとin vitro胃腸状態における持続性 |
| LPJBC5 の 16S rDNA 配列は NCBI データベースに提出されました (GenBank Acc. No. MG824976.1)。 JBC5株の16S rDNA遺伝子配列分析の根系系統樹は、Lactobacillus plantarum種との類似性を示した。 その最も近い近縁種は、配列類似性が 100% である Lactobacillus plantarum CHE37 株 (MZ571407.1) であることが判明しました。 LPJBC5 は、インド医学研究評議会およびインド政府バイオテクノロジー局が発行したガイドラインに従って実施された in vitro 分析によるプロバイオティクス特性の評価に基づいて選択されました [54]。 これらのパラメータは、酸性および胆汁条件に対する耐性、および腸上皮細胞株に定着する能力です[54]。 さらに、L. plantarum 種特異的 PCR アッセイにより、種特異的配列、プロバイオティクスマーカー遺伝子 (胆汁酸塩加水分解酵素 (Lpbsh1) をコードする) の存在が確認されました。 コラーゲン結合タンパク質(Lpcbp))および抗菌性プランタリシン生合成遺伝子(pln)、アンプリコン長は 152、975、2174、および 231 bp です。 これらの配列はすべて NCBI データベースに提出されています。 これらの配列のBLAST分析は、異なるL. plantarum株と最も近いペアワイズ配列類似性を示しました。 プロバイオティクスマーカーおよびプランタリシン遺伝子のアンプリコンサイズは、完全長のL. plantarum特異的bsh1、cbp、およびpln遺伝子を表しました。 |
| 3.2. LPJBC5 は寿命を延ばし、線虫の発育を遅らせる |
| LPJBC5 を給餌すると、標準的な細菌性食品であるE. coli OP50 (OP50) を給餌した場合と比較して、線虫の寿命が 27.8% 延長されました (*** p < 0.0001、ログランク検定) (図 1A)。 |
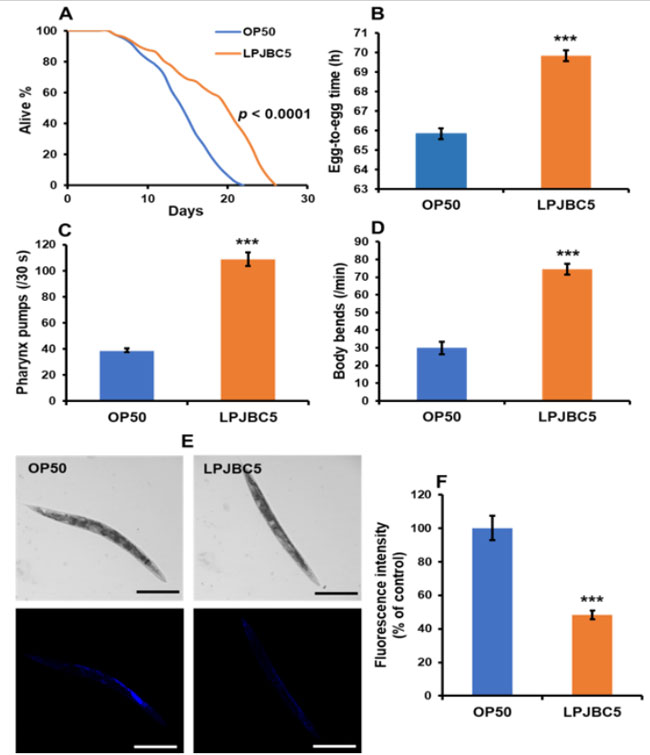 |
図1 プロバイオティクス L. plantarum JBC5 (LPJBC5) を与えると、線虫の長寿と年齢に関連するバイオマーカーが促進されます。 (A) E. coli OP50 (OP50) または L. plantarum JBC5 (LPJBC5) (109 CFU/mL) を給餌した後に、線虫の寿命アッセイを実行しました。 (B) 各細菌による処理後の発育速度を評価するために、卵から卵までの時間を使用しました。 (C、D)細菌給餌の 14 日目に咽頭ポンプ速度と運動活動を分析しました。 (E、F)リポフスチン蓄積などの老化バイオマーカーは、細菌処理の 14 日目にアッセイされました。 リポフスチンの蓄積を、倍率10倍の共焦点顕微鏡下で観察した(スケールバー、250μm)。 エラーバーは平均値±SEMを表します。 治療効果は、Student の t 検定を使用して比較されました (*** p < 0.001)。 |
| 線虫の発育速度に対する LPJBC5 の効果は、LPJBC5 を給餌した線虫の発育速度が、OP50 を給餌した線虫と比較して、卵から生殖成体段階 (卵から卵) まで著しく遅いことを示しました (*** p < 0.001) (図 1B) )。 さらに、OP50 を与えた線虫と比較して、LPJBC5 を与えた線虫の体サイズの有意な減少が観察されました (*** 4 日目および 6 日目で p < 0.001; ** 5 および 7 日目で p < 0.01) 。 |
| 3.3. LPJBC5 は線虫の腸内に効率的に定着します |
| LPJBC5 と OP50 を与えられた線虫の両方で、細菌コロニー形成単位 (CFU) 数が年齢とともに増加しました。 ただし、LPJBC5 を与えた線虫では、孵化 3 日目と 8 日目の両方で、OP50 を与えた線虫と比較して CFU 数が 67.11% および 133.47% 有意に高いことがわかりました (*** 3 日目と 8 日目の両方で p < 0.001)。 結果は、OP50を与えられた線虫と比較して、8日目の線虫の腸内でのLPJBC5の定着効率が約2倍増加したことを示した。 |
| 3.4. LPJBC5 の摂食により線虫の老化が遅れる |
| 咽頭ポンプ作用、体の曲がり、リポフスチン蓄積などの線虫の年齢関連バイオマーカーに対する LPJBC5 の給餌の影響を調査しました。 LPJBC5 の給餌は、OP50 給餌と比較して、14 日目に線虫の咽頭ポンピング速度を 179.47% 増加させました (*** p < 0.001) (図 1C)。 |
| 次に、1 分間あたりの体を曲げる回数を数えました。 体の屈曲の頻度は、OP50 を与えた線虫と比較して、LPJBC5 を与えた線虫の方が 14 日目に 148.66% 高いことが観察されました (*** p < 0.001) (図 1D)。 これらの結果は、LPJBC5 が寿命を延ばし、人生の後期段階での生活の質を改善することを示しました。 |
| また、LPJBC5 を与えた生後 14 日の線虫におけるリポフスチンの蓄積も測定しました。 結果は、LPJBC5 を給餌すると、OP50 を給餌した場合と比較して線虫の 51.79% でリポフスチンの蓄積が有意に減少することが示されました (*** p < 0.001) (図 1E、F)。 |
| 3.5. LPJBC5 の給餌により線虫の脂肪の蓄積が減少した |
| 結果は、LPJBC5 を与えられた線虫では、OP50 を与えられた老齢線虫と比較して、脂肪滴の蓄積が 35.77% 減少したことを示しました (** p < 0.01) (図 2A、B)。 |
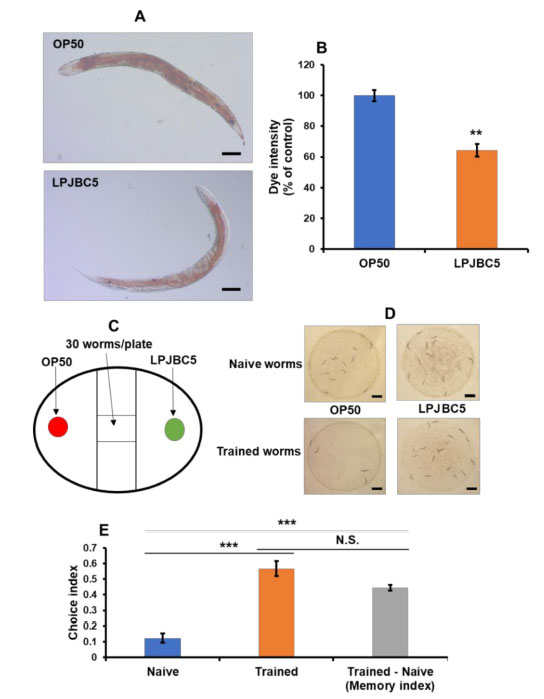 |
図 2 LPJBC5 による給餌は脂質の蓄積を軽減し、線虫の学習と記憶を改善します。 (A、B) 細菌処理の 14 日目に脂質の蓄積を分析しました。 画像は 10 倍 (スケール バー、100 μm) で観察されました。 (C) 概略図は実験計画を表します。 実験は、バイナリ選択アッセイ用の NGM 培地を含む 60 mm ペトリプレートで実行されました。 (D) 二項選択アッセイのナイーブな線虫と訓練された線虫における結果の観察。 (スケールバー、1 mm)。 (E) 未処理の線虫と訓練された線虫の餌の好みの選択指数 (CI)。 記憶指数 (CI トレーニング済み - CI ナイーブ) は、二項選択アッセイの結果から計算されました。 エラーバーは平均値±SEMを表します。 治療効果は、Student の t 検定を使用して比較されました (** p < 0.01 および *** p < 0.001)。 |
| 次に、LPJBC5 または OP50 を播種した NGM プレートに移した後 1 ~ 5 日目に若い成虫によって産生される子孫の数を評価しました。 結果は、LPJBC5 を給餌した線虫と OP50 を給餌した線虫の間で子孫の総数に有意差がないことを示しました (p > 0.05) 。 |
| 3.6. LPJBC5は線虫における学習と記憶を改善する |
| 線虫の摂食行動に対する LPJBC5 の影響を調べるために、二項選択アッセイを実施しました。 まず、結果は、OP50 を与えた線虫と比較して、LPJBC5 を与えた線虫 (CI = +0.12) の摂食選好に有意な変化がないことを示しました (p > 0.05) (図 2C–E)。 次に、線虫の学習能力に対する LPJBC5 の影響を研究しました。 3 日目の線虫を LPJBC5 で 4 時間訓練し、その後二項選択アッセイを実行しました。 訓練された線虫は、ナイーブ線虫 (CI = +0.12) と比較して、LPJBC5 に対してより高い摂食選好性 (CI = +0.56) を示しました (訓練された線虫はナイーブ *** p < 0.001) (図 2D、E)。 |
| さらに、LPJBC5 でトレーニングされた線虫のナイーブ線虫に対する記憶指数 (Trained – Naive) が計算されました。 訓練された線虫が OP50 よりも LPJBC5 を優先することは、メモリ インデックスが高いことを示します。 結果は、LPJBC5 を与えられた線虫の記憶指数がナイーブ線虫よりも有意に高いことを示しました (CI = +0.44) (*** p < 0.001) (図 2E)。 これらの結果は、LPJBC5 の給餌により線虫の学習と記憶が改善されることを示しました。 |
| 3.7. LPJBC5の給餌により非生物的および生物的ストレス条件に対する耐性が付与される |
| 結果は、OP50 を与えた線虫と比較して、LPJBC5 を与えた線虫の熱ストレスに対する線虫の生存率が 28.2% 高いことを示唆しました (** p < 0.01) (図 3A、B)。 次に、線虫の酸化ストレス(100 mM パラコート)に対する耐性に対する LPJBC5 の効果を評価しました。 OP50 を与えた線虫と比較して、LPJBC5 を与えた線虫の酸化ストレスに対する生存率は有意に増加しました (** p < 0.01) (図 3C)。 |
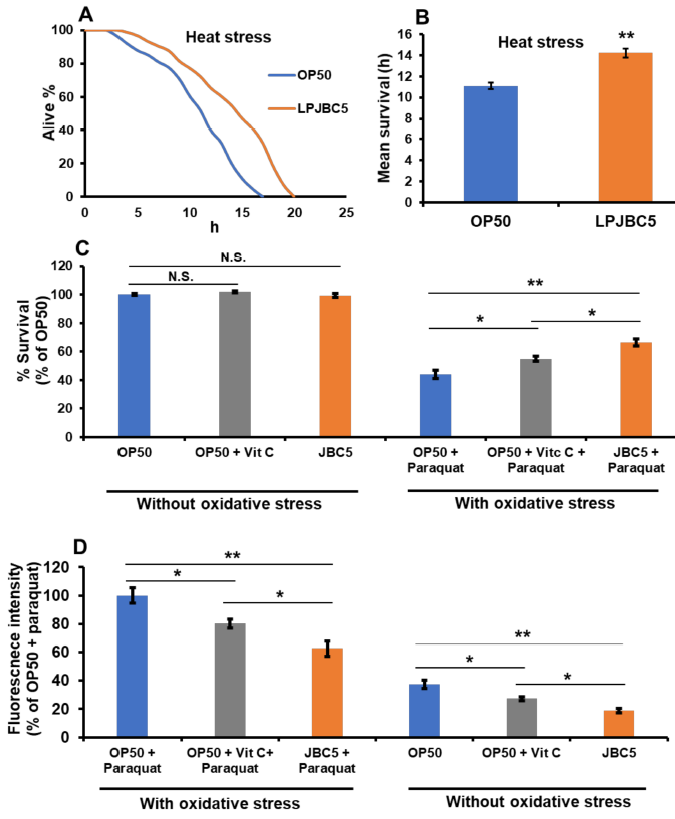 |
図 3 LPJBC5 による処理により、非生物的ストレスに対する線虫の耐性が向上しました。 (A、B)LPJBC5 給餌後の 35 °C での熱ストレスに対する線虫の生存、 ( C、D)酸化ストレス(パラコート-100 mM)および酸化ストレスの存在下および非存在下でのリポフスチンレベルの蓄積。 棒は平均±SEMを表す。 給餌効果は、Student の t 検定を使用して比較されました (* p < 0.05 および ** p < 0.01)。 |
| さらに、結果は、酸化ストレス条件の有無の両方で、OP50 を与えられた線虫と比較して、LPJBC5 を与えられた線虫のリポフスチン (老化の尺度) レベルが低いことも示しました (** p < 0.01) (図 3D )。 |
| 次に、LPJBC5 の給餌により病原性細菌であるS. aureusに対する線虫の抵抗力が高まるかどうかを調べました。 その結果、LPJBC5 を給餌すると、OP50 を給餌した線虫と比較して、S. aureusに対する生存率が 25% 増加することが示されました (** p < 0.01) (図 4A、B)。 さらに、LPJBC5 で前培養された線虫は、OP50 で前培養された線虫と比較して、病原体曝露後の腸内腔の拡張が少なかった (平均値 ± SEM、LPJBC5 で 20.8 ± 1.38 対 OP50 で前培養された線虫では 38.26 +2.07) ( ** p < 0.01) (図 4C、D )。 |
| 次に、LPJBC5 の給餌により病原性細菌であるS. aureusに対する線虫の抵抗力が高まるかどうかを調べました。 その結果、LPJBC5 を給餌すると、OP50 を給餌した線虫と比較して、S. aureusに対する生存率が 25% 増加することが示されました (** p < 0.01) (図 4A、B)。 さらに、LPJBC5 で前培養された線虫は、OP50 で前培養された線虫と比較して、病原体曝露後の腸内腔の拡張が少なかった (平均値 ± SEM、LPJBC5 で 20.8 ± 1.38 対 OP50 で前培養された線虫では 38.26 +2.07) ( ** p < 0.01) (図 4C、D )。 |
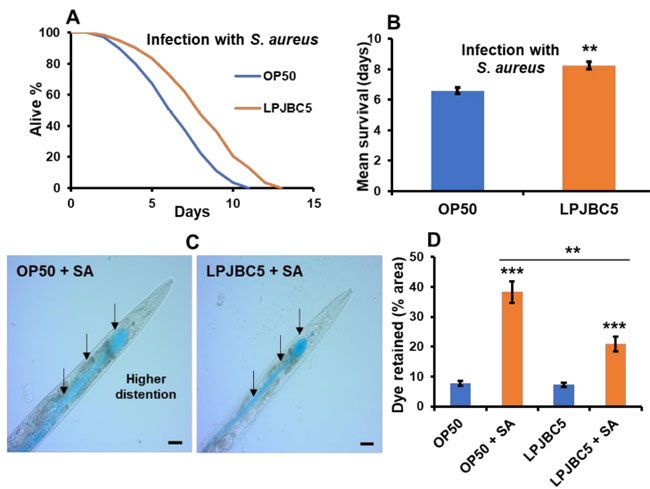 |
図 4 LPJBC5 による処理により、生物ストレスに対する線虫の耐性が向上しました。 (A、B)病原体S. aureus感染に対する生存率。 (C、D) LPJBC5 の給餌により、病原体S. aureus (SA) に対する線虫の腸の完全性が改善されました。 処理群(OP50 + SA および LPJBC5 + SA)の腸腔を 20 倍の複合顕微鏡下で観察し(C)、1 匹の線虫当たり腸腔内に保持された青色食用色素の面積(%)を ImageJ ソフトウェアを使用して計算しました( スケールバー、20 μm) (D)。 エラーバーは平均値±SEMを表します。 治療効果は、Student の t 検定を使用して比較されました (** p < 0.01 および *** p < 0.001)。 |
| 3.8. LPJBC5を餌とする線虫の寿命延長効果に関与する経路の理解 |
| 我々はまず、線虫の 2 つの機能喪失変異体 daf-2 (長寿命) と daf-16 (短命) が関与する DAF-2/DAF-16 機構の役割を調査しました。 結果は、これら 2 つの変異体線虫に LPJBC5 を与えると寿命が延びることを示しました (daf-2、*** p < 0.0001; daf-16、*** p < 0.0001、ログランク検定) (図 5A、B、表1)。 これは、LPJBC5 誘発寿命が DAF-2/DAF-16 経路の関与に依存しないことを示唆しました。 |
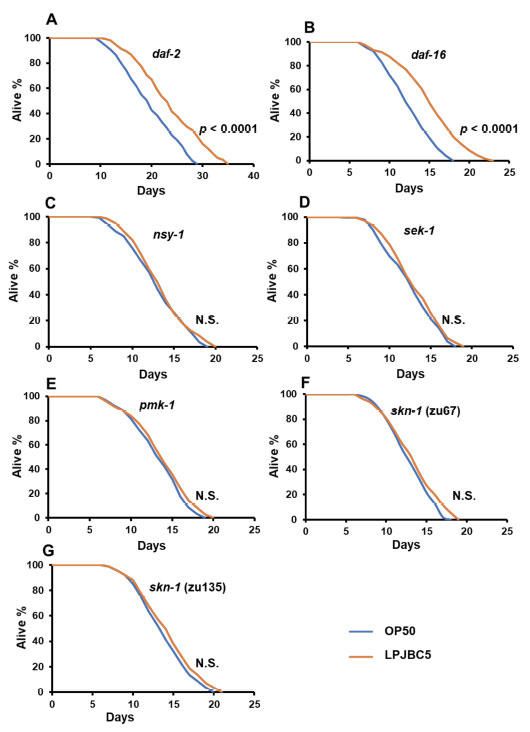 |
図5 LPJBC5による線虫の寿命延長に関与する経路の解明。 寿命アッセイは、変異体 (A) daf-2 (e1368)、(B) daf-16 (mgDf50)、(C) nsy-1 (ag3)、(D) sek-1 (ag1)、(E) pmk -1 (km25)、(F) skn-1 (zu67)、(G) skn-1 (zu135) を使用して実行されました。 治療効果はログランク検定を使用して比較されました。 |
| 表 1 OP50 またはプロバイオティクス LPJBC5 を与えられた線虫の野生型および変異株の平均寿命。 NS は有意でない p 値に対応します。 |
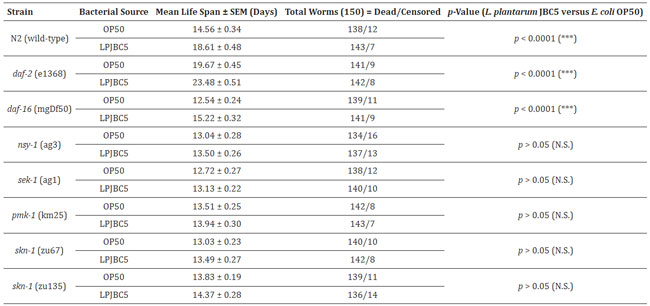 |
| 我々はさらに、LPJBC5 誘導性の長寿が p38 MAPK 経路の活性化によるものであるかどうかを研究しました。 線虫の 3 つの機能喪失変異体、つまり sek-1、nsy-1、および pmk-1 に LPJBC5 を与えても寿命は延長しませんでした (p > 0.05、ログランク検定) (図 5C–E、表 1) 。 次に、p38 MAPK 経路の下流遺伝子、つまり skn-1 が線虫の LPJBC5 誘発寿命に役割を果たしているかどうかを調べました。 2つのskn-1機能喪失対立遺伝子変異体、すなわちskn-1(zu67)とskn-1(zu135)にLPJBC5を与え、それらの寿命を測定したところ、LPJBC5を与えてもどちらのskn -1 対立遺伝子変異体 (p > 0.05、ログランク検定)でも寿命を延ばすことはできないことが示された。(図 5F、G、表 1)。 |
| 3.9. LPJBC5が誘発する線虫の健康な老化の分子メカニズムを解明する |
| LPJBC5 が線虫の健康的な老化をどのように可能にするかをさらに理解するために、qRT-PCR を実施して、長寿、脂肪蓄積、学習と記憶、ストレス反応、自然免疫、腸の完全性に関与する重要な遺伝子の発現を研究しました。 |
| まず、p38 MAPK および DAF-2/DAF-16 遺伝子に関与する重要な遺伝子の発現を分析しました。 daf-2 および daf-16 遺伝子の発現は、OP50 を給餌した線虫と比較して、LPJBC5 を給餌した線虫では変化しませんでした (daf-2 および daf-16 の両方について p > 0.05)。 sek-1、nsy-1、pmk-1 などの p38 MAPK シグナル伝達に関与する遺伝子の発現は、LPJBC5 を与えられた線虫で有意に上方制御されました (* sek-1 および nsy-1 については p < 0.05、*** p < 0.001) pmk-1 の場合)(図 6A)。 我々はさらに、LPJBC5誘導性のp38 MAPKシグナル伝達の供給がさらに下流の標的遺伝子skn-1を活性化するかどうかを研究した。 OP50 を与えた線虫と比較して、LPJBC5 を与えた線虫では skn-1 遺伝子の発現が約 2 倍増加したことが観察されました (図 6A) (** p < 0.01)。 しかし、線虫の食事制限による寿命の原因となるskn-1b遺伝子の発現には有意な変化はありませんでした(p > 0.05)。 |
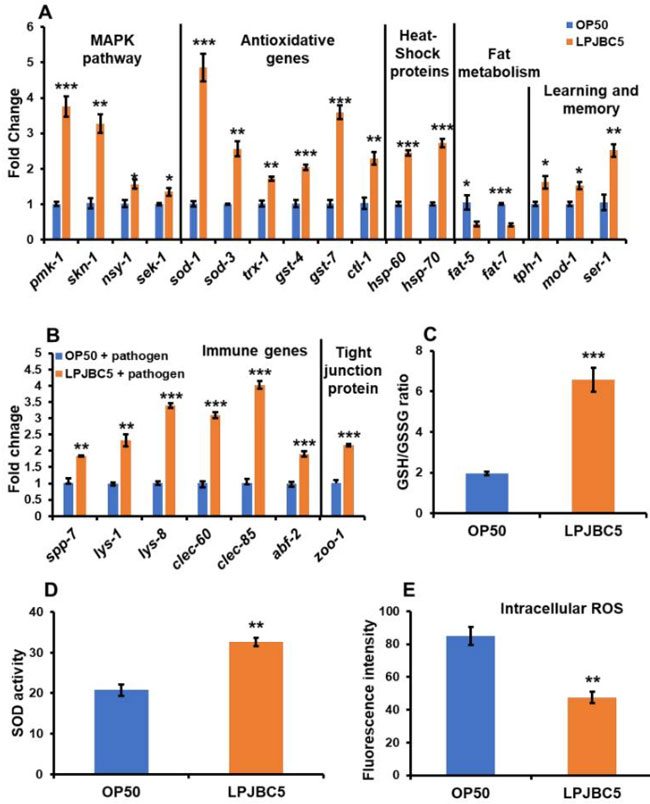 |
図6 長寿、ストレス耐性、脂肪蓄積、学習と記憶に関与する遺伝子の発現 (A):病原体黄色ブドウ球菌の感染に対する腸上皮の自然免疫およびタイトジャンクション (ZOO-1) タンパク質に関与する遺伝子。 (B)mRNA 発現は、ハウスキーピング遺伝子 act-1 を使用して正規化されました。 (C) LPJBC5 の給餌により GSH/GSSG 比が向上します。 (D) OP50 を与えた線虫と比較した線虫の SOD 活性および (E)細胞内 ROS レベル。 エラーバーは平均値±SEMを表します。 治療効果は、Student の t 検定を使用して比較されました (* p < 0.05、** p < 0.01、および *** p < 0.001)。 |
| 第二に、活性化された転写因子 SKN-1 は、フェーズ 2 解毒に関与する遺伝子の転写を活性化します。 LPJBC5 を与えられた線虫では、GST (gst-4 および gst-7)、カタラーゼ (ctl-1 および ctl2)、trx-1 および SOD 遺伝子 (sod-1 および sod-3) の発現が増加しました。 OP50 を与えられた線虫における同じ遺伝子の数 (*** sod-1、gst-4、および gst-7 については p < 0.001; ** ctl-1、trx-1 および sod-3 p < 0.01; * p < ctl-2 の場合は 0.05) の発現が増加しました(図 6A)。 さらに、LPJBC5 を与えた線虫では hsp-60 および hsp-70 遺伝子の発現が 2 倍増加しました (*** hsp-60 および hsp-70 について p < 0.001) (図 6A)。 |
| 第三に、脂肪代謝の主要な基質および酵素(脂肪-5、脂肪-6、および脂肪-7)をコードする遺伝子のmRNA発現を、LPJBC5を与えられた線虫で分析した。 我々の結果は、LPJBC5の給餌がfat5およびfat-7の発現を有意に減少させることを示唆しました(* fat-5についてはp<0.05、***fat-7についてはp<0.001)(図6A)。 ただし、OP50 を与えた線虫と比較して、LPJBC5 では fat-6 遺伝子の発現は変化していませんでした(fat-6 については p > 0.05)。 |
| 第四に、線虫のLPJBC5誘発学習能力に関与するセロトニンシグナル伝達遺伝子、すなわちser-1、mod-1、およびtph-1の役割が研究された[55]。 学習および記憶アッセイの結果と一致して、LPJBC5 を与えられた線虫では、OP50 を与えられた線虫と比較して、3 つすべてのセロトニンシグナル伝達経路遺伝子の発現が有意に上方制御されました (** ser-1 については p < 0.01、* mod については p < 0.05) -1 および tph-1) (図 6A)。 |
| 第五 に、結果はOP50 を与えられた線虫との比較して (*** lys-1、lys-8、clec-60、clec-85、および abf-2 については p < 0.001; ** spp-7 および lys-1 については p < 0.01; * p abf-3 では < 0.01) (図 6B) 、LPJBC5 を与えられた線虫における病原体S. aureusの感染に対する (abf-2 および abf-3) サポニン様タンパク質 (spp-7)、リゾチーム (lys-1 および lys-8)、CLEC 遺伝子 (clec-60 および clec-85)、抗菌因子 (ABF) などの自然免疫遺伝子の上方制御を示しました。 LPJBC5 を与えた線虫グループと OP50 を与えた線虫グループの間で、abf-1 および spp-1 遺伝子の発現に有意な変化は観察されませんでした (p > 0.05)。 |
| 最後に、病原体S. aureusに曝露した後、LPJBC5 で前培養した線虫では、OP50 で前培養した線虫と比較して、密着結合タンパク質小帯オクルディン Zoo-1 の発現が 2 倍増加しました (*** p < 0.001) ( 図6B)。 |
| 3.10. LPJBC5の給餌により活性酸素種の生成が減少した |
| 線虫の酸化還元環境を示す線虫のグルタチオン/グルタチオンジスルフィド (GSH/GSSG) 比に対する LPJBC5 の効果を調べました。 我々の結果は、LPJBC5の給餌は、OP50を給餌した線虫と比較して、14日目にGSH/GSSG比を約3倍増加させることを示唆した(GSSG、** p < 0.01; GSH、*** p < 0.001; GSH/GSSG * ** p < 0.001) (図 6C および図 S4C)。 LPJBC5 の給餌は、OP50 を給餌した線虫と比較して、14 日目の線虫の SOD 活性も 57.35% 改善しました (** p < 0.01) (図 6D)。 |
| 次に、2',7'-ジクロロフルオレセイン ジアセテート (H2DCFDA) を使用して、線虫の in vivo 細胞質 ROS レベルを検出しました。 OP50 を与えた線虫と比較して、LPJBC5 を与えた線虫では蛍光強度が 44.12% 減少しました (** p < 0.01) (図 6E)。 |
| 3.11. LPJBC5 線虫のミトコンドリア機能の改善 |
| JC-1 色素は、ミトコンドリアの膜貫通電位に対する LPJBC5 の効果を調査するために使用されました。 JC-1 は非アポトーシス細胞に浸透して凝集体を形成し、赤色蛍光を示しますが、アポトーシス細胞内にモノマーとして存在する JC-1 は緑色蛍光を示します。 我々の結果は、LPJBC5を給餌した線虫は、OP50を給餌した線虫と比較して、有意に低いレベルの緑色蛍光強度とより高いレベルの赤色蛍光強度を示したことを示唆しました(***赤色蛍光と緑色蛍光の両方についてp <0.001)(図S4D)。 さらに、赤色/緑色蛍光強度の比は、OP50 を与えた線虫と比較して、LPJBC5 を与えた線虫では 3 倍高かった (*** p < 0.001) (図 7A)。 |
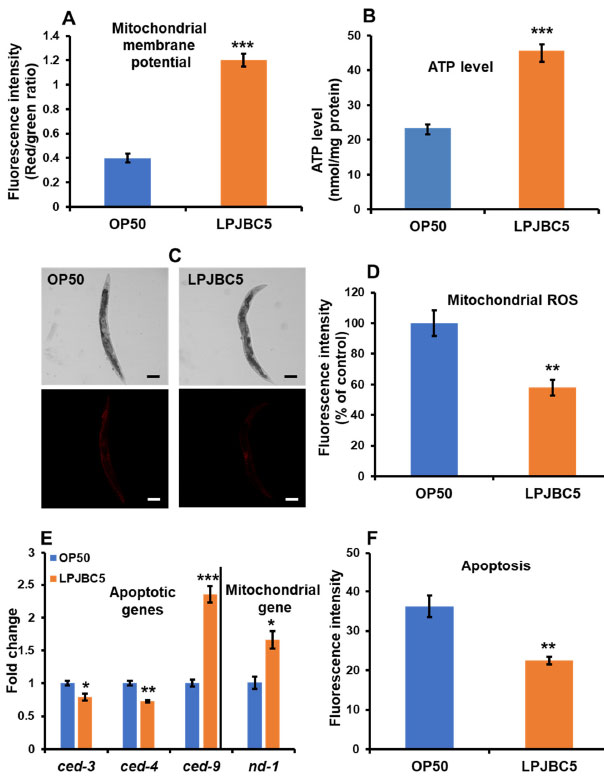 |
図7LPJBC5による処理は、ミトコンドリア膜電位( A)、ATP合成(B)を改善し、ミトコンドリアROSレベル(C、D)を低下させる(スケールバー、100μm)。 LPJBC5 処理により、ミトコンドリア遺伝子およびアポトーシスに関与する遺伝子の発現が変化しました (E)。 LPJBC5 処理は、線虫のアポトーシス (F) の速度も抑制しました。 エラーバーは平均値±SEMを表します。 治療効果は、Student の t 検定を使用して比較されました (* p < 0.05、** p < 0.01、および *** p < 0.001)。 |
| 我々は、線虫の ATP レベルの合成に対する LPJBC5 の影響をさらに調査しました。 LPJBC5 を与えられた線虫は、同じ実験条件下で OP50 を与えられた線虫と比較して、14 日目の線虫において 95.65% 高い ATP レベルを示しました (*** p < 0.001) (図 7B)。 次に、LPJBC5 を与えられた線虫を MitoTracker Red CMXRos で染色して、ミトコンドリア ROS のレベルを分析しました。 OP50 を与えた線虫と比較して、LPJBC5 を与えた線虫ではミトコンドリア ROS が 42.09% 減少しました (** p < 0.01) (図 7C、D)。 |
| さらに、ミトコンドリア DNA (mtDNA) によってコードされる遺伝子 nd-1 の発現の変化も研究しました。 結果は、OP50 を与えられた線虫と比較して、LPJBC5 を与えられた線虫における nd-1 の発現の増加を示しました (* p < 0.05) (図 7E)。 全体として、LPJBC5 の給餌は、線虫の高齢期におけるミトコンドリアの機能を大幅に改善しました。 |
| 3.12. LPJBC5 は線虫のプログラムされた細胞死を遅らせる |
| 我々の結果は、LPJBC5 を与えられた線虫では、OP50 を与えられた線虫と比較して、アポトーシス細胞死が 37.74% 減少したことを示しました (** p < 0.01) (図 7F)。 これを裏付けるように、我々の qRT-PCR 結果は、抗アポトーシス遺伝子 ced-9 の発現の増加を示しましたが、アポトーシス促進遺伝子 (ced-3 および ced-4) の発現は、OP50 を与えられた線虫と比較して、LPJBC5 を与えられた線虫では有意に減少しました ( *** ced-9 の場合は p < 0.001; * ced-3 の場合は p < 0.05; ** ced-4 の場合は p < 0.01) (図 7E)。 |
| 4.討議 |
| 医学の急速な進歩により寿命は延びています。 国連の最近の報告書では、2019 年の時点では 11 人に 1 人であったのに対し、2050 年までに 65 歳以上になる人は 6 人に 1 人になると予測しています [3]。 平均余命の延長は、高齢者の生活の質に比例しません[3]。 さらに、寿命の延長は、がん、肥満、糖尿病、心血管疾患、神経変性障害などの加齢に伴う疾患のリスクの増加と関連している[56]。 平均寿命の延長に伴い公共支出が大幅に増加しているため、これは世界経済に重大な負担をもたらしている[57]。 腸内マイクロバイオームと発酵食品の最近の発展に基づいて、科学者たちは人間の健康のための多くの民族食品とその微生物を理解することを思い出しています。 この研究では、ヨーグルトから分離された潜在的なプロバイオティクス細菌 L. plantarum JBC5 が、線虫の寿命を延ばし、健康な老化を促進する能力について評価されました。 |
| 私たちの研究では、LPJBC5 は in vitro 模擬胃腸試験でも持続し、生存率を大幅に低下させることなく、低 pH (pH 1.0、3.0、および 7.0) および胆汁酸 (0.3 ~ 1.0%) に耐えることができました。 我々の発見は以前の研究と一致しており、LPJBC5が模擬胃液および胆汁酸に対して良好な生存能力を示したことを示唆している[58]。 第二に、LPJBC5 は腸細胞株 HT-29 にも接着できました。 さらに、LPJBC5 では、潜在的なプロバイオティクス遺伝子 (コラーゲン結合タンパク質および胆汁酸塩加水分解酵素) および抗菌性プランタリシン遺伝子が確認されました。 LPJBC5 におけるコラーゲン結合タンパク質の存在は、LPJBC5 が宿主の腸に効率的に定着する候補であることを裏付けました。 これは、LPJBC5 がヒトの胃腸疾患 (胃、小腸、大腸) に耐性があり、腸粘膜に定着できることを示唆しています。 |
| 私たちの結果は、生きたプロバイオティクスと死んだプロバイオティクスLPJBC5の両方が線虫の寿命を延ばす可能性があることを示唆しています。 老化は、さまざまなシグナル伝達メカニズムによって制御される多因子現象です。 老化防止プロセスにおいて重要なメカニズムはほとんどありません[5]。 p38 MAPK や DAF-2/DAF-16 経路などのいくつかの機構が、線虫の寿命を延ばすことが確認されています [59]。 長寿のメカニズムは、ストレス耐性、抗酸化経路、免疫、代謝に関与する保存された遺伝子も調節している可能性がある[59]。 この研究では、p38 MAPK 経路変異線虫 (sek-1、nsy-1、および pmk-1) では、LPJBC5 が寿命を延長できないことが観察されました。 活性化された p38 MAPK 経路は、解毒、免疫応答、代謝などのいくつかのプロセスを調節する下流転写因子 SKN-1 の発現も誘導する可能性があります。 我々は、対立遺伝子skn-1変異体線虫にLPJBC5を与えても寿命が延長しないことを確認した。 対照的に、DAF-2/DAF-16 経路の変異体 (daf-2 および daf-16) に LPJBC5 を与えると寿命が延長されました。 我々の qRT-PCR の結果では、p38 MAPK 経路とその下流の標的 skn-1 に関与する遺伝子の発現も増加しました。 それにもかかわらず、DAF-2/DAF-16 経路に関与する遺伝子発現には大きな変化はありませんでした。 したがって、我々は、LPJBC5 を摂食すると、p38 MAPK シグナル伝達経路を介して skn-1 を活性化し、線虫の寿命を延長したと結論付けています。 この結果は、Zhou らによる最近の研究と一致しています [60]。 |
| 以前の報告では、長寿は単純ではないことが示唆され、発育の遅れと長寿との基本的な関係が実証されている[61]。 私たちの研究では、LPJBC5 の給餌は OP50 の給餌と比較して、線虫の発育速度が遅くなり、体の大きさが減少することがわかりました。 線虫の体サイズが小さいことは寿命の延長と関連していることが多く、これは発育速度の低下の結果であると考えられています [41,62]。 一般に、長寿には、咽頭ポンピング速度、運動活動、リポフスチン蓄積の減少など、線虫の老化バイオマーカーにプラスの影響を与えることが伴う[63]。 私たちは、LPJBC5 を与えると咽頭ポンプの速度と体を曲げる回数が改善し、線虫におけるリポフスチンの蓄積が減少することを発見しました。 これらの結果は、LPJBC5 の摂取が高齢者の生活の質を効果的に改善することを示唆しました。 |
| 新たな証拠は、脂肪代謝が老化プロセスにおいて厳密に調節されていることを示唆している[64]。 線虫では、RNA干渉(RNAi)と変異体の研究により、fat-6、fat-5、fat-7などの脂肪遺伝子をサイレンシングすることで、通常の生理学的条件下で脂肪の蓄積が減少することが判明した[65,66]。 線虫におけるfat-7遺伝子の過剰発現は脂肪の蓄積を促進し、トランスジェニック線虫の寿命を短縮した[67]。 我々の結果は、LPJBC5を給餌すると、OP50を給餌した線虫と比較して線虫の脂肪蓄積が減少することを示唆しました。 それを裏付けるように、我々は、LPJBC5が、OP50を与えられた線虫と比較して、脂肪代謝の主要な基質および酵素(脂肪-5および脂肪-7)をコードする遺伝子の発現を減少させることを発見した。 |
| 食事は、摂食、感覚、学習、記憶に至るまで行動に影響を与える可能性があります[10]。 私たちの研究では、成虫はOP50よりもLPJBC5を摂食する傾向がないことが実証されました。 さらに、LPJBC5 で線虫を訓練し、学習と記憶におけるその役割を評価しました。 LPJBC5で訓練された線虫は、OP50よりもLPJBC5を好むことが観察され、OP50で前培養された線虫と比較して、LPJBC5で前培養された線虫はOP50よりもLPJBC5を選択するためのLPJBC5に対する学習と記憶が向上したことを示唆しました。 以前の研究では、セロトニンシグナル伝達が線虫の行動を調節することが示唆されています[68]。 我々のqRT-PCR結果は、LPJBC5の給餌によりセロトニンシグナル伝達に関与する遺伝子の発現が改善されることを示し、したがって中枢神経系と胃腸管の間のコミュニケーションの関連性を示唆している。 今回の研究は、LPJBC5 で事前に条件付けまたは訓練された線虫が学習と記憶を改善するという証拠を提供しただけであるが、腸-脳軸におけるその役割についてコメントするにはさらに、機械論的なアプローチが必要である。 |
| 哺乳類では、p38 MAPK 経路は、リポ多糖 (LPS) への曝露に対する炎症性サイトカインおよび抗菌薬に関与する遺伝子の転写を活性化します [69、70、71]。 p38 MAPK の重要な構成要素である PMK-1 は、病原体に対する線虫の自然免疫防御において重要です [72]。 これまでの研究では、腸内病原体であるS. aureusが主に寄生し、線虫の腸の膨張を引き起こし、その後5〜7日で線虫を殺すことが示唆されている[73]。 我々は、LPJBC5 がS. aureus感染に対する線虫の生存率を向上させることを観察しました。 LPJBC5を給与するとpmk-1が過剰発現することが確認されました。 |
| さらに、LPJBC5 は抗菌タンパク質および抗菌ペプチド (lys-1、lys-8、clec-60、clec-85、abf-2、および spp-7) の遺伝子の発現も増加させました。 C. elegansの自然免疫には、抗菌ペプチド (ディフェンシン様ペプチド) およびタンパク質 (リゾチーム、セナシン、サポニン様タンパク質、C 型レクチンドメイン含有 (CLEC) タンパク質) が関与します [11]。 リゾチームは、N-アセチルムラミン (NAM) と N-アセチルグルコサミン (NAG) の間の化学結合を切断します。 以前の研究では、lys-1 や lys-8 を含む線虫におけるリゾチーム発現により、腸内での病原体 (Serratia marcescens) の蓄積が制限されました [74]。 サポニン様タンパク質 (spp.) は、病原性膜に細孔を形成する 35 個を超えるアミノ酸残基を含む N 末端の小さなリソソームタンパク質です。 サポニン様タンパク質遺伝子のサイレンシングにより、腸内の細菌量が減少した[75]。 CLEC タンパク質は、いくつかの機能、特に細胞間接着および病原体に対する免疫応答を実行することが知られている炭水化物結合タンパク質ドメインです。 Miltschら[76]によって行われた研究は、clec 遺伝子 (clec-39 および clec-49) のノックダウンにより、病原体 Serratia marcescens に対する C. elegans の生存率が低下することを報告しました [76]。 抗菌因子 (abf) またはディフェンシン様ペプチドは、システインに富むカチオン性タンパク質です。 病原体の細胞膜に電位依存性チャネルを作成し、それを破壊する上で重要な役割を果たします。 RNAiによるabf-2のノックダウンは、腸内の微生物(Salmonella typhimurium)の増殖を可能にし、線虫の生存を減少させた[77]。 |
| これを裏付けるように、我々は、LPJBC5 が病原体S. aureusによって引き起こされる腸上皮の破壊に対抗することを観察しました。 腸管バリアの障害は、上皮の密着結合の喪失を特徴とします。 特に、オクルディン小帯 ZOO-1 (ヒト ZO-1 ホモログ) はタイトジャンクションタンパク質であり、タイトジャンクションの完全性の代表的なマーカーとして機能します [78]。 機構的には、LPJBC5 を与えると、タイトジャンクションタンパク質、zoo-1 をコードする遺伝子の発現が増加することがわかりました。 Bifidobacterium bifidium などの他のいくつかのプロバイオティクス細菌も、上皮単層モデルにおける腸上皮の密着結合を強化することが示されています[79]。 |
| 以前の研究では、ROS レベルは加齢とともに増加し、関節リウマチ、神経変性疾患、胃腸疾患などの 60 以上の疾患に関与していることが示唆されています [80]。 特に、細胞の酸化還元状態は、一般的に SOD 活性のレベルと GSH/GSSG 比によって決定されます [81]。 OP50 を与えられた線虫と比較して、LPJBC5 を与えられた線虫では SOD 活性および GSH/GSSG 比が増加し、それによって ROS レベルの蓄積が減少することが観察されました。 さらに、LPJBC5 の給餌により、酸化ストレスおよび熱ストレス条件下での線虫の全体的な生存率が増加することがわかりました。 それを裏付けるように、LPJBC5 の摂取はヒートショックタンパク質 (HSP) (hsp-60 および hsp-70)と同様に、必須の抗酸化遺伝子 (sod-1、sod-3、ctl-1、ctl2、gst-4、gst-7、 と trx-1)をコードする遺伝子も含まれます。 過剰発現したヒートショックタンパク質は、細胞の酸化還元状態の変化によるタンパク質のミスフォールディングに対抗する可能性があります [82,83]。 |
| ミトコンドリアは、細胞内で ROS を生成する主な供給源です。 ミトコンドリアフリーラジカル老化理論(MFRTA)は、ROSと細胞防御機構の間の不均衡がミトコンドリアの機能不全を誘発し、その結果、より多くのROSが生成され、それがさらに老化と細胞死につながる可能性があると提案した[84]。 ミトコンドリア機能の低下は、代謝障害、2型糖尿病、がんなどのさまざまな病状の発症と相関している[85]。 我々は、LPJBC5を給餌すると、OP50を給餌した線虫と比較して、ミトコンドリアROSの産生が減少し、ミトコンドリア膜電位が向上することを発見した。 ミトコンドリアの電気化学的勾配は、ATP 合成をさらに制御するミトコンドリアの機能にアクセスするための重要な生体エネルギーパラメーターです。 さらに、LPJBC5 の摂取により、ミトコンドリア DNA (mtDNA) にコードされた NADH ユビキノン酸化還元酵素鎖 1 (nd-1) の発現も上方制御されました。 その結果、LPJBC5 は OP50 を与えられた線虫と比較して ATP 合成レベルを増加させました。 |
| 特に、高度なミトコンドリア機能不全は、アポトーシス率の増加またはプログラムされた細胞死と相関していることが多い[86]。 また、LPJBC5 が OP50 を与えた場合と比較して、17 日目の線虫のアポトーシス細胞死を減少させることも確認しました。 この観察を裏付けるように、qRT-PCR の結果は、LPJBC5 を与えられた線虫ではアポトーシス促進遺伝子の発現が大幅に減少しているのに対し、抗アポトーシス遺伝子の発現が増加していることを示しました。 この結果は、LPJBC5 がミトコンドリア機能を効果的に改善し、線虫のアポトーシス率を低下させたことを示唆しています。 |
| 5.結論 |
| 1世紀以上前、エリー・メチニコフ博士は、ブルガリア人が食事で十分な量のヨーグルトを摂取しているため、乳酸菌が人間の長寿と健康的な老化を促進するという仮説を立てました。 最近の研究では、C. elegansでも同様の寿命と老化のメカニズムが働いていることが示唆されています。 私たちの研究は、LPJBC5の給餌がp38 MAPK経路とその下流の標的を活性化し、線虫のストレス耐性や免疫力、その他の加齢に伴う病理を改善することで寿命を延ばすことを示唆しています(図8)。 私たちは、LPJBC5 には、長寿と健康的な老化を可能にし、哺乳類のいくつかの加齢に関連する障害を予防する大きな可能性があると信じています。 したがって、それは次世代のプロバイオティクスとして宣伝されるべきです。 |
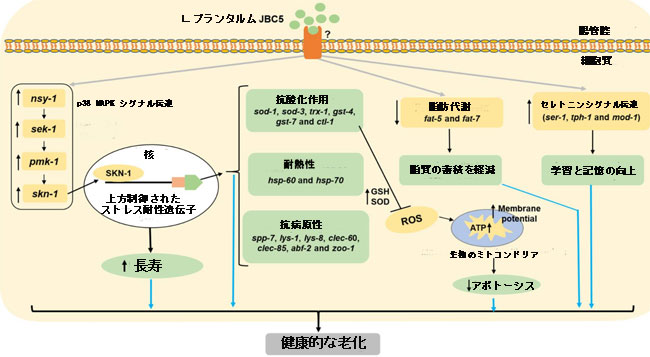 |
| 図 8 線虫における LPJBC5 によって誘発される健康的な老化の提案されたメカニズム。 LPJBC5 を摂取すると、p38 MAPK シグナル伝達カスケード (nsy-1-sek-1-pmk-1) が活性化され、下流の SKN-1 転写因子がさらに活性化されます。 活性化された SKN-1 は、フェーズ II の解毒遺伝子または抗酸化遺伝子の転写をさらに活性化します。 これらの上方制御された抗酸化遺伝子は寿命を延ばし、ストレス (酸化と熱) や病原体S. aureusに対する感染に対する抵抗力を高めます。 改良された抗酸化機構により、ミトコンドリア機能と ATP 合成が増加し、それによって線虫のアポトーシスが減少します。 LPJBC5 を摂取すると、脂肪 5 や脂肪 7 などの脂肪代謝の重要な基質や酵素をコードする遺伝子の下方制御によって脂肪の蓄積も減少します。 さらに、LPJBC5 を与えられた線虫では、セロトニンシグナル伝達に関与する遺伝子が上方制御されることにより、線虫の学習と記憶が強化されました。 したがって、LPJBC5 を摂取すると、skn-1 誘導経路が活性化されて、寿命延長され、ストレス耐性、免疫力が強化され、その他の加齢に伴う病状が軽減されます。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Antioxidants 2022, 11, 268.に掲載されたA Potential Probiotic Lactobacillus plantarum JBC5 Improves Longevity and Healthy Aging by Modulating Antioxidative, Innate Immunity and Serotonin-Signaling Pathways in Caenorhabditis elegans.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |