
Natalia Garcia-Gonzalez et al., |
概要 |
| 発酵プロセスは、食品の生産と保存のために何世紀にもわたって使用されてきました。 食品の品質に対する発酵の貢献に加えて、最近では、プロバイオティクス候補の貯蔵庫としての発酵食品の有益な性質に対する科学的関心が高まっています。 発酵食品の微生物は、健康増進の可能性と、ヒトのプロバイオティクス細菌と遺伝的に関連しているため、注目を集めています。 その中でも、Lactiplantibacillus (Lpb.) plantarum 株は、さまざまな発酵食品の製造におけるスターターカルチャーとして食品業界で長い歴史を持ち、プロバイオティクス株と同様の有益な特性が研究されています。 それらは臨床介入にも適用されます。 食物関連のLpb. plantarumは、胃腸管内で良好な適応能力と接着能力を示し、いくつかのin vitro および in vivo 研究で、抗菌、抗酸化、抗原毒性、抗炎症、免疫調節などのさまざまな有益な活性を通じて宿主の健康に影響を与える可能性を示しました。 このレビューでは、発酵に関連したLpb.plantarumの健康上の利点の概要を臨床研究の証拠とともに説明します。 発酵関連微生物が満たすべきプロバイオティクスの基準も報告されています。 |
| 目次(クリックして記事にアクセスできます) |
| 2. 健康増進菌の選択基準 |
| 3. 食物媒介Lpb.plantarum種に関するゲノム的洞察 |
| 3.1. エキソ多糖類の生成 |
| 3.2. バクテリオシンの生産 |
| 4. 食品関連Lpb.plantarum株の健康上の利点 |
| 4.1. 抗菌活性 |
| 4.2. 抗原毒性および抗変異原性活性 |
| 4.3. 胆汁酸塩加水分解酵素活性 |
| 4.4. 抗酸化特性 |
| 4.5. 免疫調節 |
| 5. 臨床研究 |
| 6. 結論 |
| 本文 |
| 1. はじめに |
| 伝統的な発酵食品は、生きた活性微生物の豊富な貯蔵庫です。 実際、それらは自然界の乳酸菌 (LAB) の主な供給源であると考えられています [1]。 発酵食品は、その栄養特性に加えて、発酵食品に含まれる微生物にも注目を集めています。 これらの微生物は、有機酸、短鎖脂肪酸、ビタミン、ペプチドなど、健康を調節する可能性が高い化合物を発酵中に合成することができます[2]。 食品関連微生物は、生理活性化合物や栄養化合物を生成する能力以外にも、同じ種のプロバイオティクス株に存在するものと同様の他の遺伝的および表現型の形質を共有しています[2]。 プロバイオティクスと同様に、食品由来の微生物は胃腸 (GI) 管内で生存し、宿主に有益な効果を及ぼすことができます。 正確な数値を示した実証研究はありませんが、発酵食品の摂取を通じて大量の生きた乳酸菌 (約 108 ~ 1011 CFU/日) が摂取されると推定されています [3]。 |
| 発酵食品の摂取は、数多くの健康上の利点と関連付けられています [2,4]。 近年、主に健康の改善と病気のリスクの軽減に関連するその利点を確認する疫学的および臨床報告が増加しています[5]。 最近の研究では、有益で安全な微生物と接触すると腸内微生物叢が形成されることが指摘されています[3]。 Marco ら [3] によれば、食品媒介微生物の可能性は「旧友仮説」で扱うことができ、これは「食品中の無害または共生微生物への曝露が消化器官の粘膜表面に「関与」する可能性がある」ことを示唆しています。 腸の機能を強化し、免疫系を微調整し、腸の機能を強化し、慢性疾患の発症に対する感受性を軽減する人間の共生生物の能力を強化します。 |
| 乳酸菌はその無害な性質により、何十年にもわたって食品発酵に広く使用されてきました。 乳酸菌の中で、より多用途で有望な種の 1 つは、Lactobacillus plantarum、または最近命名されたように、Lactiplantibacillus (Lpb.) plantarum subsp plantarum です [6]。 Lpb plantarum は、真っ直ぐな棒状 (桿菌) で、グラム陽性、非運動性、非芽胞形成性、微好気性、中温性の細菌です。 カタラーゼ陰性ではありますが、特殊な条件下で生育した一部の菌株は、真のカタラーゼ活性とマンガン含有擬似カタラーゼ活性を保有しています[7]。 細胞壁にはリビトール型またはグリセロール型のテイコ酸が含まれていますが、一部の株は珍しいテイコ酸を持っています。 細胞壁のペプチドグリカンはメソジアミノピメリン酸(DAP)タイプです。 通性ヘテロ発酵桿菌のグループに含まれる Lpb plantarum 株は、異なる生態環境への適応を可能にする炭水化物利用遺伝子のカセットを持っています。 通常、発酵食品から分離される Lpb plantarum 株は、とりわけ胃腸管、便、発酵食品、植物など、さまざまなニッチで遭遇する可能性があります。 Lpb plantarum 株は、何十年もの間、チーズ、オリーブ、さまざまな発酵食品や飲料の製造におけるスターターカルチャーとして食品業界で使用されており、それらの官能特性、風味、食感に貢献しています[8]。 高濃度の Lpb plantarumが含まれる食品の一例は、生食用オリーブです。 テーブルオリーブは最も古く、最も人気のある発酵食品の 1 つで、世界中で消費されており、主に地中海地域 (イタリア、スペイン、ギリシャ) で生産されています。 その主な分離株である Lpb pentosus および Lpb plantarum は、約 108 CFU/g の量で見つかる可能性があります [9,10]。 しかし、これらの食物優勢菌株を直接摂取した場合、または発酵食品の一部として摂取した場合の宿主に対する影響はまだ不明です。 さらに、食品に関連する菌株が腸内マイクロバイオームのメンバーになるかどうかはまだわかっていません。 現在、Lpb plantarum株も、その健康増進特性について研究されています [7]。 |
| 文献レビュー全体で議論するように、食品源から分離されLactiplantibacillus plantarum株は、治療用プロバイオティクス株と同様の特性を示すことが示されています。 |
| 2. 健康増進菌の選択基準 |
| これまでのところ、FAO/WHO によれば、ヒトの消化管から分離された微生物のみが、ヒトにおけるプロバイオティクスとしての使用を推奨されています [11]。 プロバイオティクスは、適切な量を投与すると宿主に健康上の利益をもたらす生きた微生物です[12、13]。 しかし、新たな証拠により、食品関連微生物のプロバイオティクスとしての可能性が強調されています[14]。 すべての株について、起源に関係なく、選択手順は同じ基準に従います。 プロバイオティクスとみなされるためには、ヒトの胃腸管から分離された食品関連菌株と共生菌株の両方を単離し、慎重に特徴づけ、健康上の利点を提供することが実証される必要があります。 FAO/WHO は、プロバイオティクスと健康増進菌株を評価するための世界標準を確立しました。これは次のように要約できます [11、12]。 |
| ● 菌株の同定 |
| 欧州食品安全機関 (EFSA) によると、食物連鎖で意図的に使用されるすべての微生物について、株レベルでの明確な分類学的同定を実行する必要があります [15]。 |
| ●安全性 |
| 多くの乳酸菌には、人間が安全に使用できる長い歴史があり、発酵食品のスターター培養物として使用されてきました。 その結果、多くの乳酸菌が FDA によって「一般に安全と認められる」と分類され、欧州食品安全機関 によって「安全性の適格推定」を受けています。 それにもかかわらず、産業用途またはプロバイオティクスとして意図的に使用されるすべての菌株は、実際の用途で検討される前に、堅牢な方法で安全性を評価する必要があります[16]。 2019年、欧州食品安全機関は食物連鎖で意図的に使用される微生物の全ゲノム配列分析の要件を述べた公開諮問書を発表した。 この文書は、正確なリスク評価を行うために全ゲノム配列決定(WGS)からデータを取得することを「推奨」している。 in silico解析からのデータは、抗菌薬耐性をコードする遺伝子に関する情報を提供することができます。つまり、毒性、病原性、および/または毒性に関連する遺伝子を評価する必要があります。 |
| ●プロバイオティクスの特性に関する機能的菌株の特性評価 |
| 酸/胆汁ストレスに対する耐性と腸上皮細胞への接着が、最初に評価される特性です。 細菌を摂取すると、浸透圧変動や低 pH など、消化管内で遭遇するいくつかのストレスを克服する必要があります。 唾液に含まれるリゾチームによって口の中で始まる微生物へのストレスは、pH 1.5 ~ 3.0 の範囲にある胃でも続きます。 微生物はペプシンやリパーゼにも曝露され、最終的には腸上部で胆汁にも曝露される可能性があります[17]。 したがって、潜在的なプロバイオティクス候補の選択に向けた重要なステップは、胃腸管、特に酸/胆汁耐性を模倣する条件下での菌株の挙動を調査することです。 |
| 消化管の内腔は、共生微生物叢、粘液層、および上皮細胞で構成されています。 上皮細胞の単層は、杯細胞によって生成される腸粘膜および共生微生物叢を免疫細胞から分離し、腸上皮バリアを形成します[18]。 この腸上皮バリアは感染症に対する防御として機能し、その変化は多くの疾患状態と関連している[19]。 定期的に摂取すると、摂取された細菌やプロバイオティクスは「一時的なマイクロバイオーム」の一部を形成します。つまり、それらは安定した定着体ではありませんが、この一時的な通過により共生細菌や上皮細胞と相互作用することが可能になり、最終的には健康上の利点を提供します[20]。 |
| ● 臨床検証 |
| すべてのプロバイオティクス候補は、ヒトまたは対象となる生物を対象とした二重盲検およびランダム化臨床研究を通じて、その健康上の利点を検証する必要があります[13]。 |
| 3. 食物媒介Lpb.plantarum種に関するゲノム的洞察 |
| 近年の次世代配列決定の進歩により、かなりの数の Lpb.plantarum ゲノム配列が完成し、公開されました。現在(2020年12月)までに、560個のLpb.plantarumゲノムがNCBIリポジトリから公開されており、そのうち135個は完全なものである。 発表されたデータによると、Lpb.plantarum株のゲノムサイズは長さ2.91~3.7 Mbpの範囲であり、Lpb. plantarumは乳酸菌グループ内で最大のゲノムの1つであり、GC含量は約44%です。 さらに、コード配列 (CDS) の数は、Lpb.plantarum WHE92 の 1964 から Lpb.plantarum SRCM101258 の 3526 までの範囲にあります。 |
| 完全に配列決定された最初の Lpb.plantarum は、2003 年にヒトの唾液から分離された WCFS1 株でした [21]。 しかし、発酵食品から分離された最初の菌株であるATCC14917Tの配列が決定されたのは2009年になってからでした。 それ以来、さまざまな供給源から分離された Lpb.plantarum の多数の新しいゲノムが配列決定され、NCBI データベース (https://www.ncbi.nlm.nih.gov/genome/genomes/1108、2021年2 月 9 日にアクセス) から入手可能です。 これらの菌株は、乳製品、肉製品、野菜、伝統的な発酵食品 (キムチなど) などを含むがこれらに限定されない、幅広い分野を網羅しています。 |
| WCFS1 のゲノム配列の詳細な分析により、この種についての理解が深まり、表現型を予測するための最初のアプローチとしての遺伝子の予測/注釈に基づくさらなる in silico 研究の参考として役立ちました。 発酵食品から単離された Lpb.plantarum について、胃腸生存、他の微生物や宿主との相互作用、酸化ストレスに対する抵抗力、菌株の環境適応性に関連する遺伝子の同定における大きな進歩が記載されています。 これに関して、マンノース特異的接着(msa)やコラーゲン結合タンパク質(cnaB)など、腸の細胞や粘液への接着のための遺伝子をコードするLpb.plantarum配列は、両方とも細菌の定着と病原性細菌に対する競合に関与している[22]。 食中毒による Lpb.plantarum 株は、多くのストレス関連タンパク質の遺伝子をコードしています。 浸透圧調節システム OpuC、シャペロン groES-groEL および hcrA-dnaK-dnaJ-GrpE オペロン、NADH オキシダーゼおよびペルオキシダーゼ、またはチオールおよびマンガン トランスポーターの存在がこの株に利点をもたらします。 これにより、胃腸管の過酷な条件でも生存できるようになります[23,24]。 さらに、プロファージの Lpb.plantarum 株と CRISPR-Cas システムがゲノム中に存在することも、両方ともバクテリオファージ感染に対する防御に関与しているため、有利であると考えられています。 Lpb.plantarum プロファージのゲノム配列分析により、Sha1 と Phig1 が最も豊富に存在することが示されました [22]。 CRISPR-Cas システムの存在に関しては、ほとんどの Lpb.plantarum は、4 つの遺伝子、つまり cas9、cas1、cas2、および csn2 を持つクラス 2 CRISPR-Cas システム (タイプ II) を表示します [25]。 |
| Lpb.plantarum株は、そのゲノム内にライフスタイル適応領域またはライフスタイルアイランド、すなわち主に糖の輸送と利用からなるLpb plantarum株に特有の領域、ならびに遺伝子のコード化などの細胞外機能を果たすことが提案されている。 [23]。 この領域は、Lpb.plantarum株の環境適応性の成功の鍵であると考えられます。 Lpb. plantarum株のさまざまな糖を発酵する能力は、その効率的な輸送システムが高い適応性とさまざまな生態的ニッチでの生存能力につながるため、大きな注目を集めています。 さまざまな供給源から単離されたLpb.plantarum株の比較ゲノム研究では、「ライフスタイル適応領域」にコードされている遺伝子のほとんどが株間で保存されておらず、予測されるプランタリシンおよびエキソ多糖生合成遺伝子、プロファージおよび可動要素をコードしていることが示された[23]。 これらの発見は、Lpb.plantarumの高いゲノム可塑性を裏付けており、効率的な代謝と相まって、Lpb.plantarumを最も遊牧的で多用途な種の1つとしている。 |
| 次のサブセクションでは、食品に関連する Lpb.plantarum 株で発見されたエキソ多糖類とプランタリシン生成に関する主な発見について説明します。 |
| 3.1. エキソ多糖類の生成 |
| エキソ多糖類 (EPS) は、糖および糖誘導体の単糖残基によって形成され、広範囲の細菌によって生成される高分子量の生分解性ポリマーです [26]。エキソ多糖類は、その構造に基づいてヘテロ多糖とホモ多糖の2つのグループに再分類できます。つまり、それぞれ繰り返しオリゴ糖または繰り返し単糖で構成されます。 |
| エキソ多糖類産生株は通常、「ロープ状」または「ノンロープ状」と呼ばれ、コロニーの表面または エキソ多糖類産生培養物を含む発酵液の表面から針で引き出された糸を表します [27]。乳酸菌によって産生されるエキソ多糖類は、莢膜多糖 (CPS) の形で細胞エンベロープに付着したままになるか、周囲の環境に放出される分泌多糖です [28]。 乳酸菌によるエキソ多糖類の生産は広く普及している現象であり、その生分解性、生体適合性、非毒性などの特性に基づいて、近年大きな注目を集めています。 細菌においては、エキソ多糖類には保護的な性質もあります。 これにより、細菌が他の細菌や表面に付着して認識できるようになり、重金属、ファージ感染、バイオフィルム形成から保護されます[29]。 |
| Lpb.plantarum のゲノム研究では、種内のエキソ多糖類遺伝子座の遺伝的特徴と組織化の多様性が浮き彫りになっています。 単一のクラスターをコードするLatobacillus (Lb) johnsonii や Lb. helveticus などの他の種とは異なり、Lpb.plantarum は複数の エキソ多糖類関連クラスターを保有し、個々の株に最大 5 つの独立した遺伝子座を持ちます [30]。 Lpb.plantarum で最もよく特徴付けられた エキソ多糖類クラスターの 1 つは、WCFS1 株の エキソ多糖類 EPS クラスターです [24]。 WCFS1 のゲノムは、エキソ多糖類遺伝子の 4 つの染色体クラスターをコードしており、そのうち 2 つは莢膜多糖類の形成に関与しており (cps2A-J および cps4A-J)、別の 2 つのクラスターは鎖長制御機能とプライミンググリコシルトランスフェラーゼ (cps1A-JI および cps3A-J)) をコードする遺伝子を欠いていると予測されています [31]。 エキソ多糖類を産生する Lpb.plantarum 株はさまざまな供給源から単離されており、その分子的特徴は通常株に依存します [31,32]。 ワインから単離された株 Lpb.plantarum LP90 は、cps3 と cps4 および株依存性の cps2 を持っていますが、ST-III と ZJ316 は cps3 と cps4 クラスターをコードし [33,34]、JDM1、P8、および 16 は cps4 クラスターのみをコードします [ 34]。 Lpb.plantarum 株の エキソ多糖類クラスター間の変動は、クラスター cps1A-I から cps3A-J 内で観察されます。 遺伝子クラスター cps4A-J は、種の中で最も保存されています [31]。 クラスターcps4A-J内で見出される必須遺伝子の中には、チロシンキナーゼ、ホスホチロシンホスファターゼ、プライミンググリコシルトランスフェラーゼ、グリコシルトランスフェラーゼ、フリパーゼおよび多糖ポリメラーゼが含まれる[30]。 |
| Lpb.plantarum のような複数の エキソ多糖類クラスターを持つ種では、各クラスターが異なる機能と異なる生物学的影響を持つことが以前に示されています。 Remusらによって行われた研究では、Lpb.plantarum WCFS1によってコードされる4つのCPS遺伝子クラスターと、宿主と微生物の相互作用におけるそれらの影響が評価された[31]。 cps1A-I の欠失は多糖類の生成に影響を与えませんでしたが、他の 3 つのクラスターの変異は表面多糖類のレベルを大幅に低下させることが示されました。 ただし、cps1A-I クラスター内の変異のみがエキソ多糖類のモル質量と組成に影響を与えました。 さらに、これらのクラスターの変異はトール様受容体 (TLR) の認識にも影響を及ぼし、したがって活性化 B 細胞の核因子カッパ軽鎖エンハンサー (NF-kB) の活性化にも影響します。 野生型と比較すると、クラスター内の個々の変異は TLR2 シグナル伝達応答をわずかに変更するように見えますが、すべてのクラスターの欠失により NF-κB 活性化が大幅に増加しました [31]。 |
| エキソ多糖類の生産は、その物理化学的特性により、薬理学および食品産業に大きな影響を与えています。 一部の乳酸菌で生産されたエキソ多糖類は食品の食感を改善し、発酵食品の仕上がりの品質とともに、口当たりやマトリックス形成などのレオロジー特性に影響を与えることが示されています [35]。 さらに、抗発がん性、抗血栓性、抗酸化作用、免疫調節作用などの有益な効果もエキソ多糖類に起因すると考えられています [36]。 中国のパオカイから分離された食品関連菌株 C70、Y0175、OF101、および伝統的な発酵シリアル飲料から分離されたエキソ多糖類は、それぞれ抗酸化特性を示しました [37,38]。 さらに、ラクダの乳から単離されたエキソ多糖類、KX041 は、免疫活性と DPPH/ABTS ラジカル消去活性の両方を示しました [39]。 抗腫瘍特性と抗菌特性は、それぞれ Lpb.plantarum 株 MTCC9510 および 86 から単離された エキソ多糖類からも観察されています [40,41]。 これらの理由から、エキソ多糖類生産のスケールアップと、食品および製薬産業への適用可能性が研究されてきました [35,36]。 |
| 3.2. バクテリオシンの生産 |
| バクテリオシンは、定義上、細菌が他の細菌に対する防御機構として使用するリボソーム合成ペプチドです。 乳酸菌によって生成されるバクテリオシンのほとんどは、小さく、カチオン性、熱安定性、両親媒性、膜透過性のペプチドです [42]。 Lpb.plantarumによって産生されるバクテリオシンは、プランタリシンとして知られています。 近年、乳酸菌によって生成されるバクテリオシンは、生物防腐剤としての潜在的な役割のために産業界で関心を集めています [43]。 バクテリオシンはタンパク質分解酵素によって分解される可能性があるため、現在の化学保存料や抗生物質の使用と比較して、食品媒介病原体や腐敗細菌と戦うための自然で安全かつ効果的な戦略として提示されています[44]。 ただし、バクテリオシンの使用には、病原体除去の有効性やコストの上昇など、いくつかの制限があります。 |
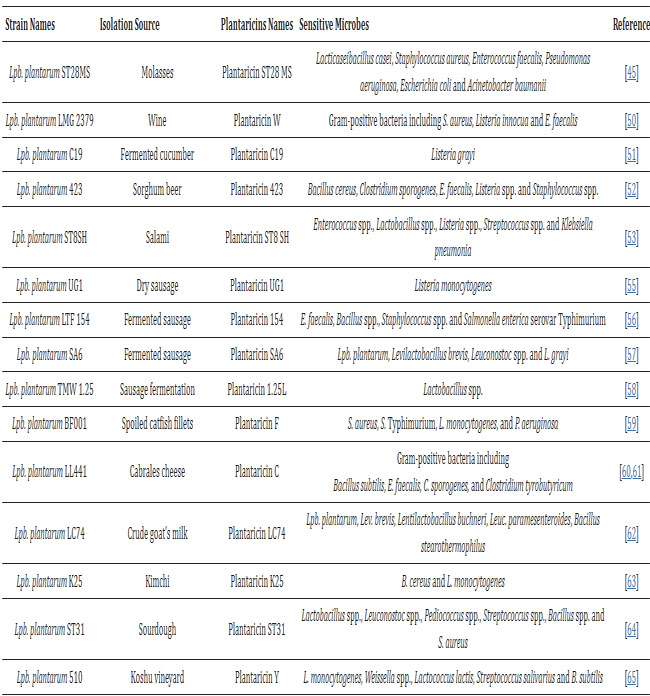
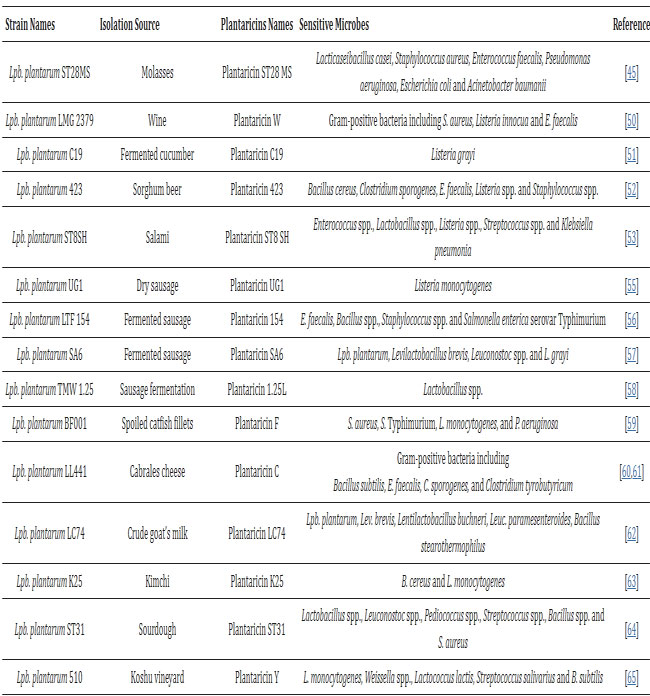
| 遺伝子配列、組成および組織の変動がバクテリオシンの抗菌活性に影響を与える可能性があることが証明されているため、バクテリオシン遺伝子座の特徴付けと完全な理解が重要である[45]。 Lpb.plantarum株によって産生されるプランタリシンには6つの主な特徴がある[46]。 すべてのプランタリシンは、遺伝子 plnE および plnF によって二重グリシン部分を持つ前駆体として生成され、さらに PlnG および PlnH タンパク質によって輸送されます [47]。 バクテリオシンは、構造、分子量、熱持続性、分子組織に基づいて 4 つのカテゴリーに分類されます [48]。 Lpb.plantarum によって生成されるプランタリシンの大部分は、通常、クラス I とクラス II の両方に含まれます。 クラス I には、ランチオニンを含む翻訳後修飾されたバクテリオシンが含まれ、一般的にランチビオティックと呼ばれます。 このグループでは、プランタリシン C および W が見つかります [49,50]。 一般に、クラス II に属するバクテリオシンは熱に安定で、修飾されておらず、ランチオニンを含まないものです。 クラス II は、バクテリオシンのような不均一なグループで、クラス IIa、ペディオシン PA-1 などのバクテリオシンIIb、2ペプチドのバクテリオシン、 IIc、環状ペプチドバクテリオシン、 IId、ドメインを持たない直鎖状の単一ペプチドであるペディオシンのバクテリオシンなどに細分されます。 プランタリシン JK、EF S および NC8 はクラス IIb に属し、プランタリシン STSH8、C19 および 423 はクラス IIa に属します [16、51、52、53]。 プランタリシン JK および EF の産生は、クラス IIc に属するプランタリシン A によって誘導されます [54]。 最後に、クラス III は、乳酸菌ではほとんど表現されない大きな熱不安定性バクテリオシンで構成されます。 1 つ以上のタイプのプランタリシンを生成する Lpb.plantarum 株は、さまざまな発酵食品から分離されています [16] (表 1)。 一般に、Lpb.plantarum種は、さまざまな強力なプランタリシン生成源であると考えられています。 |
| 表 1 さまざまな発酵食品から分離された Lpb.plantarum 株によって生成される最も特徴的なプランタリシン |
 |
 |
 |
| 4. 食品関連Lpb.plantarum株の健康上の利点 |
| 以下のサブセクションでは、発酵食品から分離された Lpb.plantarum 株の最も特徴的な健康に有益な活性のいくつかについて説明します。 一般に、プロバイオティクス細菌がその健康上の利益を仲介するメカニズムは次のとおりです。(1) 共生微生物叢の調節。 (2) 病原体の排除または阻害。 (3) ムチン産生とタイトジャンクション形成の増加による腸上皮バリアの強化。 (4) 免疫系の調節。 (5) 生理活性分子の生成。 図 1 は、Lpb.plantarum 株の主な作用機序の簡略図を示しています。これについては、この総説でさらに説明します。 |
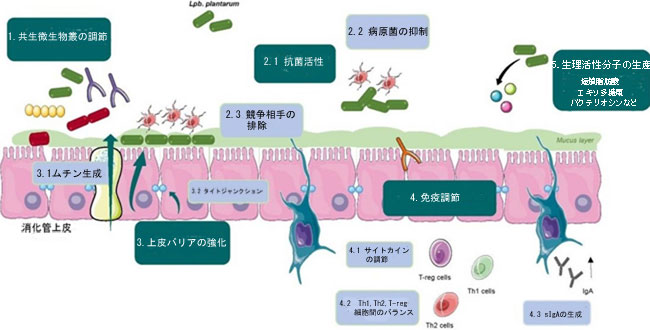 |
| 図1 Lpb.plantarumの健康上の利点の作用機序 |
| 4.1. 抗菌活性 |
| Lpb.plantarumの有益な効果の中で、プロバイオティクスの特性の中で最も研究され、望ましいものの1つは、その抗菌力です。 Lpb.plantarum種は、多くの食品腐敗微生物(細菌、酵母、カビなど)やさまざまな腸内病原性細菌に対して広範囲の抗菌活性を備えていることが示されている[86]。 したがって、いくつかの Lpb.plantarum 株は、それぞれ生物防腐剤および生物治療薬の代替品として食品産業および人間の医療に適用される有望なプロバイオティクス候補と考えられています。 最近の研究では、食品関連Lpb.plantarum株が、Listeria monocytogenes, Staphylococcus aureus, Enterococcus, Bacillus, Clostridium, Pseudomonas aeruginosa, Helicobacter pylori, Yersinia enterocolitica, Campylobacter jejuni, Klebsiella, Salmonella, Shigella および Escherichia coli( E. coli 0157:H7を含む)などのグラム陽性菌とグラム陰性菌の両方を阻害する能力を示した(表1)。 良好な抗真菌活性は、Aspergillus, Candida spp.およびFusariumを含むさまざまな酵母やカビの種に対しても示されています[87]。 いくつかの研究では、食品の腐敗および/または病原性微生物に対する、さまざまな発酵食品から単離された Lpb.plantarum 株のアンタゴニスト効果が検討されています [88、89、90、91]。 抗菌活性は主に、有機酸、過酸化水素、エキソ多糖類、バクテリオシンの生成などの抗菌化合物の生成によって発揮されます。 これは、他の多くの有益な特性と同様に、株固有のものであると考えられるため、株レベルで特徴付ける必要があります。 |
| 食品の腐敗や食品病原菌の抑制に関しては、Lpb.plantarum種は、多くの発酵食品(ザワークラウト、テーブルオリーブ、乳製品、発酵ソーセージなど)の発酵プロセスにおけるスターターカルチャーとして適用されています。 このような発酵プロセスは食品の品質と安全性の両方を改善し、主に有機酸の生成と栄養素の競合を通じて食品を腐敗させる微生物を抑制することで最終製品の保存期間を延長します[92]。 オリーブが発酵すると、Lpb.plantarumによる乳酸生成によりpHが低下し、酸性条件に敏感な腐敗微生物の増殖が抑制され、微生物学的安定性と食品の安全性が大幅に改善されます[10]。 グラム陰性菌(大腸菌やサルモネラ・エンテリティディスなど)、芽胞形成菌、多様な酵母やカビに対して、低pHでの乳酸の強力な阻害活性が報告されている[93]。 Lpb.plantarumの抗真菌活性は主に有機酸[94]、3-ヒドロキシル化脂肪酸(すなわち、5-オキソドデカン酸、3-ヒドロキシデカン酸、3-ヒドロキシ-5-ドデセン酸[95])の生成によるものです。 環状ジペプチドとしては、シクロ(Gly-Leu)、シクロ(Phe-Pro)、シクロ(Phe-OH-Pro)、シクロ(Leu-Pro)などがある[96]。 |
| 上記の抗菌化合物に加えて、Lpb.plantarum株は エキソ多糖類とバクテリオシンの生産者でもあり、病原体の活性を顕著に阻害します [87]。 現在、バクテリオシンは、現在の化学保存料や抗生物質の使用と比較して、食品媒介病原体や腐敗細菌に勝つための自然で安全かつ効果的な戦略として提示されています[44]。 プランタリシンの作用範囲は非常に多様です。 通常、ほとんどのプランタリシンはグラム陽性菌またはグラム陰性菌のいずれに対しても活性ですが、プランタリシンが両方に対して活性を示す場合もあります (プランタリシン ZJ5 または LP84 など) [16] (表 1 を参照)。 プランタリシン C11 や NA などの一部のプランタリシンの可能性は注目に値します。 これらは、侵襲性の食中毒病原体である Listeria monocytogenesを阻害します[53]。 表 1 は、さまざまな発酵食品から分離された Lpb.plantarum 株によって生成される最も特徴的なプランタリシンを報告しています。 エキソ多糖類産生に関しては、Lpb.plantarum によって産生されるこれらの化合物の病原体に対する生物活性 (抗付着性や抗バイオフィルム特性など) がいくつかの研究で報告されています [29,36]。 一部の病原体の抗生物質に対する耐性による病原体の残留とバイオフィルムの生成は、慢性感染症を引き起こす可能性があり、食品産業に深刻な課題をもたらす可能性がある[97]。 Lpb.plantarumの抗菌活性は、生物防腐剤としての潜在的な役割のため、食品業界で関心を集めています[43]。 |
| 一方、Lpb.plantarum は、最も有害な細菌であるStaphylococcus aureus や Escherichia coliを含む広範囲の宿主病原性細菌を阻害できることが示されています。 そのため、それらは抗生物質の有望な代替品と考えられています[98]。 Zhangらは、発酵豆から単離された菌株であるLpb.plantarum ZDY 2013による顕著な病原体阻害を報告した。 Lpb.plantarum ZDY 2013は、よく知られた腸毒性および病原体種である Bacillus cereusに勝って阻害すること、またHelyicobacter pylori感染および関連する胃粘膜炎症の予防の前治療として効果的であることが示されている[99]。 |
| Lpb.plantarum種は、一部の菌株を創傷感染症の生物防除剤として使用する可能性を目的として、ヒトの皮膚病原体(Pseudomonas aeruginosaやメチシリン耐性 Staphylococcus aureus種など)に対する潜在的な抗菌特性についても研究されている[100]。 プロバイオティック乳酸菌は、女性の間でCandida albicansによる一般的な感染症である外陰膣カンジダ症の再発を予防するための可能な代替治療法として広く研究されている[101]。 さらに、いくつかの研究では、Lpb.plantarum株によるCandida albicansに対する強いin vitroおよびin vivo抗真菌活性が報告されている[102,103]。 興味深いことに、Beckらは最近、韓国の伝統的な発酵食品であるキムチから単離された3つのLpb.plantarum株のCandida albicansおよびGardnerella vaginalisに対する抗菌活性を調査し、粘膜感染症の治療におけるプロバイオティクス候補としての可能性を示唆している[103]。 |
| 多種多様な食品腐敗菌や病原性微生物に対する Lpb.plantarumの強力な抗菌活性を確認するすべての証拠と、スターター培養物としての確立された応用に基づいて、食品関連Lpb.plantarum株は生物防腐剤として、食品産業や医療における代替生物療法用のプロバイオティクスとして有望です。 |
| 4.2. 抗原毒性および抗変異原性活性 |
| 主に西洋の食生活や現代のライフスタイルに関連した、多種多様な環境および食品関連の突然変異原への日々の曝露により、遺伝毒性および関連する消化器疾患のリスクを調整するための食事介入に対する科学的関心が高まっています。 腸内では、さまざまな遺伝毒性化合物(主に食物によって運ばれる)がしばしば検出されます。 それらは、一次食品突然変異原(すなわち、マイコトキシン、植物配糖体)、二次食品突然変異原(すなわち、多環芳香族炭化水素や複素環式アミンなどの調理プロセスに由来する)および内因性化合物(すなわち、ニトロソアミン)として広く定義することができる[104]。 前臨床および臨床研究では、結腸直腸がん、前立腺がん、乳がんなどのさまざまな腫瘍の発症に関与していることが示されています [105,106] さらに、私たちは、化粧品、食品包装、および/または何千もの日用品に一般的に使用されている、さまざまな環境および外因性化合物に常にさらされています。 重金属、フェノール誘導体 (BPA)、フタル酸エステル、ニトロソアミン、ポリ臭化ジフェニル エーテル (PBDE)、ポリ塩化ビフェニル (PCB) など、内分泌かく乱物質 (ED) とも呼ばれます。 最近、内分泌かく乱物質への曝露は、糖尿病、肥満などの代謝障害 [107] や、さまざまな臓器 (肝臓、膵臓、腸) における DNA 損傷による発がん性影響など、他の多くの有害な結果と関連付けられています [108]。 |
| しかし、腸内に生息する一部の微生物群集は、これらの化合物の生物学的活性の大幅な低下を引き起こす可能性がある抗原毒性特性を持っています[109]。 これらの保護活性は、発酵豆乳などの一部の発酵食品でも報告されています[110]。 疫学および臨床実験の証拠も、共生細菌が腸レベルでの遺伝毒性および変異原性リスクの調節に重要な役割を果たしている、食事と健康の密接な関係を裏付けている[111,112]。 |
| この観点から、いくつかの研究は、広く摂取されている食品関連微生物が、食事や外因性生体異物などの環境危険因子による結腸がん発生率の減少に関連している可能性があると指摘している[106]。 最近、Garcia-Gonzalez らは in vitro と in vivo の両方の研究を徹底的にレビューし、食品関連および/またはプロバイオティクス乳酸菌が遺伝毒性化合物の生物学的活性を阻害することによって 胃腸レベルで保護的な役割を果たす能力があるという裏付けとなる証拠を提供しました。 したがって、発がんの初期事象である DNA 損傷を防ぐことができます [108]。 食品関連乳酸菌は、そのような化学分子を非反応性化合物に結合または生物変換することによって、その遺伝毒性を軽減できることが示唆されている[113]が、その正確なメカニズムはまだ完全には理解されていない。 乳酸菌の中でも、イタリアの乳製品から分離された Lpb.plantarum株は、ニトロアレーン、4-ニトロキノリン-1-オキシド (4-NQO) およびアルキル化剤、N-メチル-N'-ニトロ-N-ニトロソグアニジン(MNNG)、2 つの強力なモデル遺伝毒素に対して効果があることが報告されています [104,109]。 |
| さらに、Waliaらは、ヒマラヤ北西部の発酵食品に関連する微生物の DNA 生体保護活性を調査し、一部の Lpb.plantarum株の 4-NQO およびフラゾリドンに対する高い遺伝毒性阻害 (>90%) を報告しました。 これは、よく知られているプロバイオティクス株、Lacticaseibacillus rhamnosus LGG 株によって発現されるもの (88.9%) です。 Preteらは、Lpb.plantarum種内でスクリーニングを実施し、さまざまな発酵食品(テーブルオリーブ、サワードウチーズ、生乳チーズ)から分離された18種のLpb.plantarum株の4-NQOに対する抗原毒性を評価した。 彼らの研究は、明らかな菌株特異性があるにもかかわらず、Lpb.plantarum種が発がん性化合物の遺伝毒性効果を阻害するかなりの可能性を確認した[114]。 肝発がん性効果を持つ最もよく知られたマイコトキシンの 1 つであるアフラトキシン B1 に対する、食品に関連した Lpb.plantarum DNA 生体防御効果も、ヒト結腸腺癌 (Caco-2) 細胞に対して確立されています [115]。 最近、発酵穀物由来の Lpb.plantarum LUHS135 および Lacticaseibacillus paracasei LUHS244 が、いくつかのマイコトキシン (すなわち、アフラトキシン B1、オクラトキシン A、HT-2 毒素、T-2 毒素) の削減の候補として研究されました [116]。 |
| 食品関連の突然変異原に対する生体防御の役割に加えて、Lpb.plantarum株は環境変異原に対抗する能力についても研究されており、水系カドミウム [117] やトリクロサン暴露 [118] の場合に生体防御効果を示しています。 食品微生物および/またはプロバイオティクスが環境化合物を解毒および分解する能力は、現在、新しいバイオレメディエーションツールとして浮上しています。 最近の研究では、BPA [119] および農薬 [120] に結合する乳製品 乳酸菌の潜在的な in vitro 能力が報告されています。 最近の研究では、2つの異なるEDに対する他の機能活性[114,121,122]が以前に特徴づけられていた2つのLpb.plantarumプロバイオティック株、IMC510およびIMC513の抗原毒性活性を調査し[108]、遺伝毒性とDNA損傷の阻害におけるLpb.plantarumの役割が確認された。 発がん性および変異原性化合物からの生体防御および生体修復の必要性が高まっていることを考慮すると、DNA 損傷から保護する微生物の能力が革新的な機能特性として浮上しており、新しい機能の基礎を表しています。 慢性的な腸の病状を軽減するための生体防御的な食事介入は、さらなる in vivo 研究で調査される価値があります。 |
| 4.3. 胆汁酸塩加水分解酵素活性 |
| 胆汁は、微生物が胃腸環境で生き残るために耐えなければならない環境課題の 1 つです。 通常、毎日 1 リットルの胆汁が肝臓から腸管に分泌され、これは摂取された菌株にとって深刻な問題となります [123]。 胆汁は、食事性脂肪、脂質、親油性ビタミンの乳化と腸吸収に必要な消化分泌物です。 胆汁酸(BA)、コレステロール、リン脂質、抱合型ビリルビンは胆汁の主要成分です。 胆汁酸は、肝臓でコレステロールから合成され、胆嚢に貯蔵され、食物摂取後に小腸で放出されるヒドロキシル化ステロイドです。 それらは、脂質の乳化と可溶化、吸収と消化の促進、およびコレステロールの除去において主要な役割を果たします[123]。 胆汁酸は表面活性な両親媒性分子であり、界面活性剤として作用するその能力により細菌の膜脂質と相互作用することも可能になり、細胞膜の破壊を引き起こすだけでなくDNA損傷を引き起こし、それによって胆汁に強力な抗菌特性を与えます[124]。 胆汁中に分泌される前に、一次胆汁酸は側鎖でタウリン (タウロ結合) またはグリシン (糖結合) と結合します。 十二指腸に放出された後、共役胆汁酸は腸内微生物叢によって細菌性胆汁酸塩加水分解酵素(BSH)を介して化学修飾を受ける[123]。 胆汁酸塩は、グリシンまたはタウリンを除去した後、脱抱合型になると、水溶性が低いため糞便とともに排泄される可能性があります[125]。 この点において、細菌性胆汁酸塩加水分解酵素(活性としても知られる胆汁酸塩を加水分解する能力は、プロバイオティック株の選択基準の中に含まれている[126]。 腸内環境における細菌の生存の観点からは、胆汁酸関連ストレスに耐える潜在的なプロバイオティクス細菌の能力を評価することが一般的に必要であると考えられている[126]。 共役胆汁酸は細菌にとって有毒であることが知られており、微生物の胆汁抵抗性と胃腸環境の定着の両方に寄与するため、細菌性胆汁酸塩加水分解酵素の生産は細菌に消化管内で生存するためのメカニズムを提供します。 微生物の保存された適応である胆汁酸を代謝する能力は、腸内微生物の共通の特徴と考えられており、腸内細菌の主要門および腸内古細菌に分布している[127]。 細菌性胆汁酸塩加水分解酵素脱結合活性は、主に、Lpb.plantarum 種 [134] を含む、Bifidobacterium [128], Clostridium [129], Enterococcus [130], Listeria [131], Lactobacillus [132,133], などの 胃腸共生種の間で特徴付けられています。 Lpb.plantarum WCFS1は、bsh遺伝子が記載された最初のLpb.plantarum株であった[135]。 他のLpb.plantarum株に対して行われた機能分析により、4つの胆汁酸塩加水分解酵素タンパク質のファミリーが明らかになり[125]、その中でBSH1がLpb.plantarumの胆汁酸を代謝する能力に関与する主なタンパク質であると思われる。 最近、Preteらは、腸関連株ではないにもかかわらず、食物関連Lpb.plantarum株における細菌性胆汁酸塩加水分解酵素活性の初期の証拠を報告した[136]。 さらに、いくつかの研究者によって以前に報告されているように、胆汁酸の脱共役の変動が株間で見つかり、この特性の株依存性が確認され、種または属内で一般化することはできない[123]。 |
| 現在、微生物の胆汁耐性は、生理学的プロセスに影響を与える可能性があるため、ますます注目を集めています。 したがって、細菌性胆汁酸塩加水分解酵素活性は菌株選択において望ましい特徴となる可能性があります。 この点において、微生物の細菌性胆汁酸塩加水分解酵素活性は、宿主の脂質代謝を機能的に調節し、コレステロール代謝において重要な役割を果たす微生物と宿主の対話を媒介する腸内微生物活動の一形態として最近特定された。 胆汁酸は生物学的シグナル伝達分子として機能し、核胆汁酸受容体(ファルネソイド X 受容体、FXR としても知られる)などのいくつかの宿主受容体と相互作用します。 または胆汁酸活性化膜Gタンパク質共役受容体であるTGR5(別名Gpbar-1、Gタンパク質共役胆汁酸受容体)は、エネルギー代謝を刺激し、肝臓と腸を炎症や脂肪症から保護し、症状を改善する役割を果たしているようです。 インスリン感受性だけでなく、体重減少にも重要な役割を果たしている[137,138]。 特に、核胆汁酸受容体は、肝臓および腸における 胆汁酸合成および腸肝循環の調節に関与しており、核胆汁酸受容体の活性化により、肝臓のコレステロール 7α-ヒドロキシラーゼ (CYP7A1) およびステロール 12α-ヒドロキシラーゼ(CYP8B1)の阻害を通じて胆汁酸合成が減少し、胆汁酸およびコレステロールのレベルが低下します。 そして、胆汁酸塩輸送ポンプ(BSEP)などの胆汁酸塩輸送体の活性化を通じてコレステロール排泄を促進し、それによって抗炎症および代謝の利点に関連した調節的役割を果たす[139]。 プロバイオティクス細菌の投与は、血清コレステロールレベルおよび関連する心血管疾患を調節するための予防戦略となり得ることが示されている。 いくつかの in vivo 研究では、動物モデルにおけるコレステロールとトリグリセリドのレベルの低下は主に微生物の細菌性胆汁酸塩加水分解酵素能力の存在と関連していることが確認されています [138,140,141]。 これは、コレステロール代謝に対する細菌性胆汁酸塩加水分解酵素活性プロバイオティクスの影響を評価しようとした臨床試験によっても確認されている[142]。 胆汁酸はその生物学的役割の中で、白色脂肪組織の褐変を刺激するTGR5受容体の活性化を介したグルコース恒常性とエネルギー消費におけるシグナル伝達分子として機能し、食後の熱産生は全身のグルコースおよび脂質代謝を改善する[137,143]。 TGR5 の活性化が自然免疫応答に関与していることも報告されています [143]。 胆汁酸適応免疫軸は、二次胆汁酸であるリトコール酸 (LCA) によるビタミン D 受容体 (VDR) の活性化が Th 細胞の炎症を直接緩和し、それによって適応免疫応答を調節するということが実証されています。 これはすべての炎症状態の基本です[143]。 免疫に加えて、ビタミン D 受容体は細胞の増殖と分化、カルシウム恒常性、生体異物解毒などの他の多くの生物学的機能の調節に関与しています[139]。 最近、非結合胆汁酸が宿主の概日遺伝子発現の制御に影響を及ぼし、概日リズムの微生物由来の調節因子として作用することが示されており、その変化は肥満や代謝機能不全に関連していることが知られている[144]。 全体として、胆汁酸分子の複数の生物学的役割は、宿主と微生物の密接なクロストークを反映しています。 発酵食品には、一度摂取すると宿主の代謝とホメオスタシスに積極的に寄与できる微生物が豊富に含まれていることを考えると、胆汁酸のプロファイルを調節する微生物の能力は、人間の健康を改善するための食品戦略の観点から大きな期待を示しています。 |
| 4.4. 抗酸化特性 |
| 現在、腸内に多くの変化や炎症状態を引き起こす活性酸素種 (ROS) および関連する酸化ストレスの影響に大きな関心が集まっています。 食物と微生物成分の両方を運ぶ食事は、腸内環境における酸化促進物質と活性酸素種前駆体分子の生成に主に関与しています。 最近、食品抽出物やプロバイオティクス株などの生理活性抗酸化物質を使用した食事介入が、酸化ストレス障害や関連する慢性疾患や炎症性疾患を治療するための革新的な自然なアプローチとして研究されています[145]。 過酸化水素 (H2O2)、ヒドロキシルラジカル (・OH)、スーパーオキシドアニオン (・O2 ̄) などの活性酸素種は細胞代謝中に生成され、細胞シグナル伝達、イオン輸送、遺伝子発現などの重要なプロセスにおける重要な要素です [146]。 しかし、活性酸素種の蓄積は、脂質やタンパク質などの生体分子の酸化損傷を引き起こす可能性があります。 この酸化損傷は、複数の関連疾患を引き起こすことが知られているため、正しい細胞機能を維持するには酸化還元ホメオスタシスのバランスと維持が不可欠です。 特に食品関連のLpb.plantarum 株は、活性酸素種およびフリーラジカルに対する抗酸化特性により広く研究されています。 食品由来のLpb.plantarumやその他のプロバイオティクス株の抗酸化活性の根底にあるメカニズムは、多因子であると考えられます。 抗酸化代謝産物(葉酸、酪酸、グルタチオンなど)の生成、抗酸化宿主遺伝子(スーパーオキシドジスムターゼやカタラーゼなど)の上方制御、活性酸素種ROS産生に関連する遺伝子の下方制御、または腸内細菌叢の調節は、いくつかのプロバイオティクス株で知られている既存のメカニズムの一部です。 Lpb.plantarum株の抗酸化特性は、分子やラジカルに対して直接評価することも、ジクロロフルオレセイン(DCF)アッセイのように細胞モデルにおける酸化ストレスとして定量化することもできる[147]。 |
| 菌株の抗酸化活性をテストするための化学アッセイには、1,1-ジフェニル-2-ピクリルヒドラジル (DPPH) ラジカル スカベンジング、ヒドロキシル ラジカル スカベンジング (HRS) 法、還元力などが含まれます。 抗酸化活性は複数の方法を使用して評価し、その結果を in vitro アッセイで確認することが常に推奨されます。 化学的アッセイ、in vitroアプローチ、およびin vivo活性の確認の間の相関関係を常に示すことはできませんが、特定の株の抗酸化活性を確認するには、この最初のスクリーニングを実行することをお勧めします。 Xingらは、乳酸菌株のコレクションの抗酸化活性を評価することによって、Lpb. plantarum CCFM8661 は、化学分析では弱い抗酸化活性を示しましたが、HepG2 細胞に対するラジカル媒介損傷の阻害にはその有効性が証明されました [148]。 さらに、発酵食品(ハルピ、グンドゥルク、シンキ、竹)から分離されたLpb.plantarum株と Lpb. paraplantarum株のコレクションを用いて行われた研究では、DPPHアッセイにより抗酸化活性が示された[149]。 Lpb.plantarumK46 は過酸化水素に耐性があり、優れたフリーラジカル消去活性を示しました [150]。 同じ特性がDM5株にも見られ、ヒドロキシルラジカルに対する強力な抗酸化能力、DPPH活性、過酸化水素耐性、アスコルビン酸塩の阻害も示されました[151]。 細胞が抗酸化特性を示しただけでなく、熱で殺菌した細菌や無細胞抽出物も同様でした。 伝統的な中国の発酵食品から分離された 3 つのLpb.plantarum株 (C88、C10、および K25) の無細胞抽出物は、強力なヒドロキシルラジカル消去活性を示し [146]、チベットのケフィアから分離された Lpb.plantarum MA2 の上清と細胞ホモジネートの両方が、 グルタチオンペルオキシダーゼ活性およびスーパーオキシドジスムターゼ活性[152]を示した。 Lpb.plantarumは、真核細胞ほど酸化を防御する複雑な制御システムを持っていませんが、酸化ストレスが発生した場合には、ニコチンアミドアデニンジヌクレオチド(NADH)オキシダーゼ、スーパーオキシドジスムターゼ、NADHペルオキシド、非ヘムカタラーゼなどのいくつかの酵素の存在が重要です。 [153]。 他の研究では、乳酸菌によって生成されるエキソ多糖類がLpb.plantarum株の抗酸化能力の原因であることが特定されている[154]。 |
| Lpb.plantarumの抗酸化特性の背後にある分子機構と、微生物と宿主の相互作用が酸化炎症をどのように改善できるかを理解することは、研究者にとって依然として未解決の課題です。 活性酸素種の直接中和に加えて、微生物細胞は活性酸素種レベルの調節を介して炎症経路を調節したり、さらには遮断したりできることが示されている [155]。 最近、さまざまな発酵食品から単離されたいくつかのLpb.plantarumプロバイオティクス候補が、in vitro 化学アッセイと細胞ベースのアッセイを組み合わせたアプローチを用いて、その抗酸化能力について調査されました [122]。 Preteらは、酸化ストレスに対する腸細胞モデルにおけるLpb.plantarum の潜在的な二元的効果を発見した。 特に、彼らの結果は、腸粘膜の生理学的状態、つまり健康または炎症に基づいた食品関連Lpb.plantarum株の予防または保護効果を示唆しており、直接的な活性酸素種中和を超えた親密で複雑な微生物と宿主の相互作用を示唆しています [122]。 最近の研究では、共生微生物とプロバイオティクス微生物の両方が活性酸素種調節を介して腸シグナル伝達に直接関連しており、上皮バリア機能と腸炎症の回復に関与するさまざまな伝達経路に影響を与える可能性があることが指摘されています[156,157]。 これにより、酸化ストレスと炎症ストレスに関連する胃腸消化器疾患を改善するための、食物関連Lpb.plantarumの治療的使用の証拠が提供される。 |
| 4.5. 免疫調節 |
| 共生細菌とプロバイオティクスの最も魅力的な特性の 1 つは、免疫系を調節することによって宿主の恒常性に貢献することです。 この調節は、免疫調節化合物の産生および/または免疫細胞および上皮細胞の直接刺激によって駆動されます[158]。 胃腸消化管におけるプロバイオティクスの定着は一時的ですが、細菌はその通過中に共生微生物および上皮細胞の両方と相互作用することができます。 この短い接触により、プロバイオティクスおよび/または摂取した細菌が上皮細胞の活性を調節することが可能になり、その結果、樹状細胞やマクロファージなどの免疫細胞が活性化される可能性があります[159]。 プロバイオティクスには分泌型免疫グロブリン A (sIgA) 産生の増加、前炎症性および抗炎症性サイトカインの産生の調節、およびヘルパーT細胞(Th1、Th2)と制御性T細胞(T-reg)の間のバランスの調節などさまざまな効果が関係しています{160]。 |
| 宿主の腸細胞と免疫細胞は、パターン認識受容体 (PRR) を通じて共生細菌と食中毒菌を認識します。 特に、宿主と微生物のクロストークに関与する主な受容体は、トール様受容体(TLR) およびロイシンリッチリピート含有受容体 (NLR) です。 微生物成分を認識するトール様受容体(TLR)およびロイシンリッチリピート含有受容体(NLR)は、免疫応答の開始に関与している[161]。 トール様受容体(TLR)は、細胞表面上、またはとりわけ樹状細胞、ナチュラルキラー細胞、上皮細胞および内皮細胞などの免疫および非免疫哺乳類細胞の細胞内小器官上に発現できる膜貫通受容体である[162]。 トール様受容体(TLR)は、リポテイコ酸 (LTA) やリポ多糖類 (LPS) などの細菌細胞壁のさまざまな成分を認識できます。 対照的に、NOD1 と NOD2 (ロイシンリッチリピート含有受容体(NLR)ファミリー内) は細胞内細菌の細胞質微生物センサーとして機能し、ペプチドグリカンを認識します [163]。 |
| 共生細菌とプロバイオティクス細菌は、腸細胞や免疫細胞と相互作用する能力を共有し、選択されたサイトカインの産生を誘導します。 食品由来の Lpb.plantarum 株も同じ能力を持つことが示されています。 モンゴルの乳製品から単離された Lpb.plantarum 株 06CC2 は、マウスマクロファージ J7741.A との共培養においてインターロイキン (IL)-12 の放出を増加させることができます。 さらに、細菌の経口投与は Th1 サイトカインの産生を誘導し、正常なマウスの免疫応答を活性化することが示されました [164]。 さらに、さまざまな供給源から分離されたいくつかの Lpb.plantarum 株による前処理は、炎症を起こした結腸細胞 (NCM460) の IL-8 濃度を低下させる能力 [121] と、IL-23/IL-17 軸を調節する能力 [122] を示しました。 キムチから単離されたLpb.plantarum LC27は、NF-κBの活性化とそれに伴うIL-8の放出を阻害することにより、マクロファージ、KATO III細胞およびマウスにおけるエタノール誘発効果を相殺することができた[165]。 Vitaliらは、Lpb.plantarum株に遭遇したいくつかの自生乳酸菌のプロバイオティクスの可能性を調べた[166]。 免疫調節アッセイにより、食品に関連する Lpb.plantarum 株は、末梢血単核球 (PMBC) でサイトカインの放出を誘導することができました。 特に、Lpb.plantarum POM42は、抗炎症活性を持つ最も多くのサイトカイン(IL-4、IL-1ra、IL-10およびIL-13)を刺激することができました[166]。 乳製品から単離された Lpb.plantarum 株 FRP16 と HT-29 細胞をプレインキュベートすると、Salmonella Typhimurium DT104 によって誘導される IL-8 の産生を阻害することができました [167]。Lpb.plantarum 137は、in vitroで脾臓細胞によるIL-12およびインターフェロン-γ(IFN-γ)の産生を誘導した[168]。 |
| マウスでは、発酵乳豆腐から単離されたLpb.plantarum JLK0142による治療により、腸内sIgAおよび血清IL-12および腫瘍壊死因子(TNF)-αサイトカインレベルが増加することが示された[169]。 同じ傾向が、チーズから分離された Lpb.plantarum 株を与えられた生後 6 週目の BALB/c マウスでも観察されました [170]。 Lpb.plantarum株を摂取すると、腹腔マクロファージの貪食活性とIgA産生細胞の数が増加しました。 さらに、防御免疫反応は、日本の伝統的な発酵食品から分離された Lpb.plantarum YU の摂取と関連していました [171]。 他の食品由来の Lpb.plantarum 株について報告されているように、Lpb.plantarum YU の摂取により IL-12 放出と IgA 活性が増加し、Th1 免疫応答の強化につながりました。 プロバイオティクスの摂取は、体液性適応免疫応答の構成要素の 1 つである sIgA の増加と関連しています。 IgA の産生と腸固有層へのさらなる移行は、病原体の免疫排除によって上皮バリアを強化します [160]。 細菌と上皮細胞との接触は、パターン認識受容体 (PRR)、特に トール様受容体(TLR) によって媒介されるようです。 前述したように、トール様受容体(TLR) は微生物の表面に関連する MAMP に応答する膜貫通受容体です。 トール様受容体(TLR) が細菌を認識すると、骨髄分化一次応答 88 (Myd88) の動員によってこのシグナルを伝達できるようになり、これにより、NF-κB およびマイトジェン活性化プロテインキナーゼ (MAPK) の活性化のための Myd88 依存性シグナル伝達経路が誘導されます。 [158]。 免疫応答の誘導におけるトール様受容体(TLR) TLRの重要な役割は証明されています。 キムチから単離された Lpb.plantarum株 CLP-0611 は、LPS-マクロファージにおける IL-1β および IL-6 の発現、ならびに NF-KB およびアクチベータータンパク質 1 (AP1) の活性化を阻害および 2,4,6-トリニトロベンゼンスルホン酸 (TNBS) 誘発大腸炎マウスにおける NF-κB 活性化の阻害できることが示されました。 両方の結果は、免疫応答の調節における Lpb.plantarum の効果が標準的な TLR/NF-κB シグナル伝達経路の調節によって媒介されることを示唆している可能性があります [172]。 Ren らによって行われた研究 [173] では、いくつかの食物関連 Lpb.plantarum 株のコレクションによる THP-1 の刺激がトール様受容体(TLR)依存性であることが示されました。 |
| 食品由来のLpb.plantarum株に関連する免疫系への影響は多岐にわたります。 トール様受容体(TLR)活性化後のさまざまな生物学的反応は、エキソ多糖類産生に加えて、細菌の細胞壁の組成および構造組織の小さな違いによるものである可能性がある[174]。 明らかなことは、プロバイオティクスや摂取した細菌による腸の恒常性に対する免疫調節効果は、パターン認識受容体 (PRR)の単一の活性化の結果ではなく、トール様受容体(TLR)とロイシンリッチリピート含有受容体(NLR)の活性化の相乗的な組み合わせの結果であるということです。 プロバイオティクスや共生細菌によるトール様受容体(TLR)の上方制御は、免疫系を警戒状態に保つ可能性があるため、防御機構とみなされる可能性があります。 sIgA 産生の増加、サイトカイン産生の調節、Th1、Th2 と制御性 T 細胞間のバランスの調節が、プロバイオティクスの作用機序における重要な要素であると考えられます。 |
| 5. 臨床研究 |
| プロバイオティクスの健康上の利点は、プロバイオティクス株が調剤される健康強調表示を裏付ける少なくとも 1 つの成功した人体試験で実証されなければなりません [13] |
| これらの基準に従って、感染症)[99,175]、腸管炎症症候群(過敏性腸疾患(IBD)および潰瘍性大腸炎)[176,177]、心血管疾患[178]、高コレステロール血症および肥満[179,180]、糖尿病[181]、婦人科疾患[182]も 結腸がん[183]や認知障害[184]などいくつかの広範な疾患、特に急性および慢性の胃腸感染症(すなわち、C. difficileおよびH. pylori)を予防および/または改善するための食事介入として、多様なヒトプロバイオティクスLpb.plantarum株を使用することに成功したことが、実質的な証拠によって確認された。 |
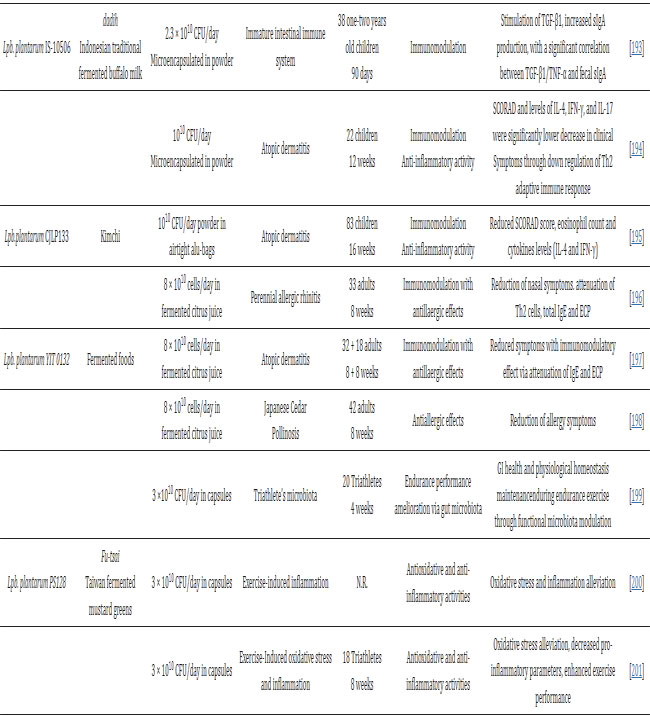
| 最近、さまざまな発酵食品から分離されたLpb.plantaru株が、健康な被験者と病気の被験者の両方に対する食事介入として臨床研究に応用されています (表 2)。 Lpb.plantaru株の大部分が、健康増進における発酵食品の基本的な役割を確認する民族の伝統的な発酵食品(キムチ、台湾からし菜、モンゴルの酸乳、インドネシアの伝統的な自然発酵水牛乳であるダディなど)から分離されたことは注目に値します。 現在、西洋社会ではそのような食品の消費はほとんど失われています。 |
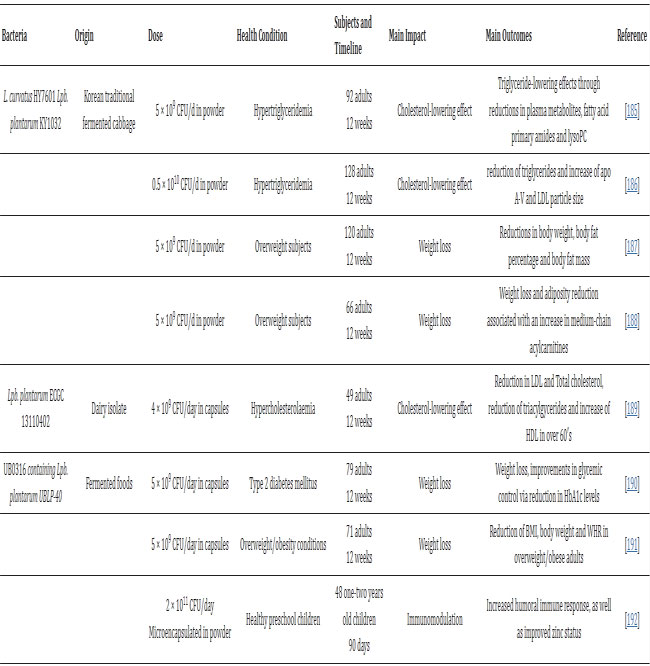
| 表2 食品に関連する Lpb plantarum 株の臨床研究は、いくつかの疾患の治療に有効であることを示しています |
 |
 |
 |
| ※略語リスト。 lysoPC: リゾホスファチジルコリン。 apo A-V: アポリポタンパク質 A-V。 LDL: 低密度リポタンパク質。 SCORAD: アトピー性皮膚炎指数のスコアリング。 IL-4: インターロイキン 4; IFN-γ: インターフェロン-γ; IL-17: インターロイキン 17; Th2: T ヘルパー タイプ 2。 TGF-β1: トランスフォーミング成長因子-β1。 sIgA: 分泌型免疫グロブリン A; TNF-α: 腫瘍壊死因子-α。 URTI: 上部気道感染症。 HDL: 高密度リポタンパク質。 IgE: 免疫グロブリン E; ECP: 好酸球カチオン性タンパク質。 TBA: 総胆汁酸。 SCFA: 短鎖脂肪酸。 BMI: 肥満指数。 WHR: ウエストとヒップの比率。 hs-CRP: 高感度 C 反応性タンパク質。 N.R.: 報告されていません。 |
| 特に、食品に関連するプロバイオティクス株は、単独、カプセルまたは粉末として(すなわち、Lpb. plantarum PS128、P8、DR7)、または、異なる種に属する他のプロバイオティクス株(すなわち、UB0316 多種配合物中の Latilactobacillus (Lat.) curvatus HY7601 および Lpb.plantarum KY1032、Lpb.plantarum UBLP-40)と組み合わせたプロバイオティクス製剤として投与されています。または有益な効果を相乗的に高めるために発酵食品の食事(すなわち、発酵大豆粉末中の Lpb.plantarum C29、発酵柑橘類果汁中の Lpb.plantarum YIT 0132)として摂取することもできます。 さまざまな Lpb.plantarum 株を、高トリグリセリド血症および体脂肪蓄積を伴う過体重被験者に投与して、トリグリセリド低下効果を調査することに成功しています。 興味深いことに、Lat.curvatus HY7601 と Lpb.plantarum KY1032 (韓国の伝統的な発酵キャベツから分離) の 2 つの菌株を 12 週間投与すると、血漿代謝産物、脂肪酸一級アミド、およびリゾホスファチジルコリン (lysoPC) の減少を通じて顕著なトリグリセリド低下効果が示されました [185] 、 そして、その後、過体重ではあるが糖尿病ではない成人におけるアポリポタンパク質A-VとLDLコレステロールの増加[186](それぞれn = 92とn = 128)、さらに、高トリグリセリド血症を伴う過体重の非糖尿病成人患者を対象とした2件のヒト試験において、Lat. curvatus HY7601およびLpb.plantarum KY1032の投与後の体重減少と肥満の減少の証拠が提示されている[187,188]。 Costabileらは、正常から軽度の高コレステロール血症の参加者を登録した臨床研究において、注目すべき細菌性胆汁酸塩加水分解酵素(BSH)活性のために選択された菌株である食品関連Lpb.plantarum ECGC 13110402がコレステロール値を低下させるという同様の有益な結果を発見した[189]。 メタボリックシンドロームに対するプロバイオティクスの潜在的な影響に沿って、Lpb.plantarum UBLP-40を含むマルチ株プロバイオティクス製剤UB0316が、最近、2型糖尿病の影響を受けた患者の治療介入として[190]、また体重管理の臨床研究[191]に適用された。 |
| プロバイオティクス特性に関する主な健康強調表示は、抗炎症作用と免疫系の積極的な調節です。 danhiのLpb.plantarum IS-10506は、健康な未就学児の体液性および腸管免疫反応を刺激するための食事療法の早期介入として成功裡に投与された[192,193]。 同様に、免疫調節不全を特徴とする慢性再発性炎症性皮膚疾患であるアトピー性皮膚炎に罹患した子供の治療にも使用される[194]。 キムチやその他の発酵食品から分離されたLpb.plantarum CJLP133およびLpb.plantarum YIT 0132の炎症軽減および免疫調節効果(すなわち、IgE減弱、好酸球数の減少)を介して、アトピー性皮膚炎に罹患した患者の生活の質を改善する能力 [195,196] も示されています。 フルーツジュースに入れて投与されるLpb.plantarum YIT 0132は、アレルギー症候群の治療にも応用されています。 これらは、通年性アレルギー性鼻炎やスギ花粉症など、日本で蔓延している疾患であり、どちらも急性、場合によっては重度の炎症状態を特徴としています[196,198]。 |
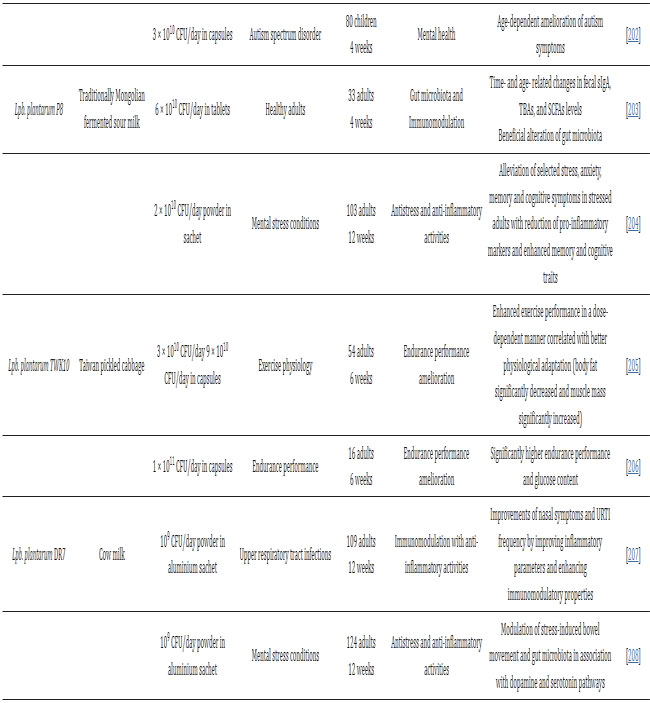
| さまざまな食品関連Lpb.plantarum株(Lpb.plantarum P8およびPS128)による酸化ストレスと炎症の改善が、運動生理学と持久力パフォーマンスにおけるプロバイオティクスの役割を調査することを目的とした新興研究分野で観察されている[199,200,201,203,204]。 Huangらは、トライアスリートの運動パフォーマンスが向上し、運動誘発性炎症が明らかに軽減されたことを報告し、高強度トレーニングライフスタイルにおけるLpb.plantarum PS128のエルゴジェニックな役割の可能性を示唆している[200]。 |
| 最後に、腸と脳の軸に基づいた新たな健康強調表示により、食品由来のLpb.plantarum株が、脳の健康に有益な効果をもたらす有望なプロバイオティクス候補であることが証明されました。 乳製品分離株であるLpb.plantarum DR7は、不安やストレスを軽減し、ドーパミンとセロトニン経路の刺激を通じて認知機能を改善することにより、精神的ストレス状態において効果的であることが示されている[208,209]。 軽度認知障害のある成人100人を登録した臨床研究では、発酵大豆と組み合わせたLpb.plantarum C29(キムチ分離物)の12週間投与後に、血清脳由来神経栄養因子の増加による認知機能の改善も観察された[211]。 興味深いことに、自閉症スペクトラム障害を持つ子供に対する食事介入としての Lpb. plantarum PS128 の有益な効果が最近報告されました [202]。 |
| 食品に関連する多様なLpb.plantarum株は、同種のヒト株によってすでに実証されているように、十分に文書化されたLpb.plantarum299v や Lpb.plantarum TENSIA など健康な被験者の疾病予防のための自然に安全で効率的な戦略であることが証明されており、またさまざまな病理学的状態に適切な介入であることが証明されています。 これらの食品由来の菌株の多くについては、in vitroおよびin vivoの研究、さらには人体試験で有益な効果が証明されています。 しかし、投与量、治療時間、そして多くの場合、分子メカニズムはまだ定義されていません。 進行中および将来の研究では、菌株の特異性を考慮し、分子レベルでのプロバイオティクスの作用機序の理解を見落とさず、適切な用量と治療時間の観点から、特定の疾患の改善に対する各プロバイオティクスの有効性を評価する必要があります。 |
| 6. 結論 |
| このレビューでは、食品由来の Lpb.plantarum 株の健康増進特性に関する最新の in vitro、in vivo、および臨床証拠をまとめました。 前述したように、このような株は、とりわけ免疫調節特性、抗酸化特性、抗原毒性特性を発揮することにより、宿主の健康にプラスの影響を与える可能性があります。 その結果、微生物の起源はプロバイオティクスの選択基準ではなくなりつつあり、発酵食品が生きた活性細菌の豊富な供給源であることを示す新たな証拠が示されています。 特に、さまざまな発酵食品(サワードウ、テーブルオリーブ、チーズ)に含まれる Lpb.plantarum種に属する菌株は、胃腸管から単離されたものと同様の in vitro 抗炎症特性および抗酸化特性を発揮することが示されています [121,122] 。 さらに、発酵食品から直接単離された細菌は、発酵環境への適応の長い歴史により、食品製造プロセスにおいて有利である可能性があり、それにより、扱いが難しいプロバイオティック細菌の使用に関連する技術的障害を克服することができる。 |
| しかし、菌株間の固有のばらつきと決定的かつ再現可能な結果の欠如により、食品由来の菌株が立法上の空白に陥り、産業界と科学パートナーの間で紛争が生じています。 さらに、ほとんどの場合、食品に関連する菌株が作用機序を発揮する正確な機構は十分に解明されていません。 他の著者によって提案されているように、これらのメカニズムの複雑さは、これらの利点が細胞表面によって媒介される直接的な効果の結果であるのか、それとも所定の形成条件のセットの下で生成される代謝産物の二次的な効果によるものであるのかについての理解を引き起こします。 胃腸エコシステムが登場すると、この問題はさらに悪化します。したがって、これらの複雑なネットワークの性質を解明するには、さらにin vitro、in vivo、臨床試験を実施する必要があります。 これらの問題を解決するために、科学界は、ターゲットベースの発見戦略と個人中心の試験に従って設計された、精密なプロバイオティクス戦略に移行することを提案しました。 この戦略は、メカニズムの活性と宿主反応についての理解を深め、特定の治療目的のためのプロバイオティクスや機能性微生物の設計に役立つでしょう[212]。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Microorganisms. 2021 Feb; 9(2): 349.に掲載されたHealth-Promoting Role of Lactiplantibacillus plantarum Isolated from Fermented Foods.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |