
Agnieszka Kaczynska et al., |
概要 |
| アレルギー性鼻炎(AR)の病因解明は近年大きく進歩しましたが、その有病率は依然として上昇しており、患者の生活に大きな影響を与えています。 そのため、アレルギー性鼻炎の発症における新しい因子の役割を解明し、新しい治療アプローチの発見を促進する、従来とは異なるさらなる研究が必要とされています。 これらの要因の 1 つは腸内細菌叢であり、健康と病気においてその特定の役割があります。 このレビューでは、免疫系への影響に焦点を当て、特に幼少期における腸内細菌叢の発達のプロセスを紹介します。 それは、腸内細菌叢の組成とアレルギー性鼻炎の発達に関与する免疫変化との間の関連性を強調しています。 具体的には、腸内に定着する細菌とTh1/Th2の不均衡との間の重要な関連性が解明される。 プロバイオティクス、プレバイオティクス、および腸内細菌の組成を回復し、アレルギー性鼻炎の臨床経過に間接的に影響を与える薬剤である細菌溶解物についても説明します。 |
| 目次(クリックして記事にアクセスできます) |
| 2. 腸内細菌叢の発達とアレルギー性鼻炎のリスク |
| 2.1. 出生前期 |
| 2.2. 誕生モード |
| 2.3. 幼児期 |
| 3. 健康およびアレルギー性鼻炎における腸内細菌叢の構成 |
| 4. 腸内細菌叢による免疫システムの形成 |
| 5. 腸内微生物叢の組成に影響を与える製剤とアレルギー性鼻炎の治療におけるその効果 |
| 5.1. プロバイオティクス |
| 5.2. プレバイオティクス |
| 5.3. 細菌溶解物 |
| 5.4. 糞便微生物叢の移植 |
| 6. 結論 |
| 本文 |
| 1. はじめに |
| 人間の生体は無菌の閉鎖系ではありません。 複数の微生物がその表面と内部に定着し、局所的な微生物叢を形成します。 細菌が存在する主な場所は、腸、皮膚、泌尿生殖器および気道です [1]。 図 1 は、腸内細菌叢の発達に影響を与える重要な要因を示しています。 近年、微生物叢が人間の健康に与える重大な影響について、多くの情報がまとめられています。 免疫系の反応を調節するその能力は、依然として 21 世紀の科学で最も人気のある問題の 1 つです。 |
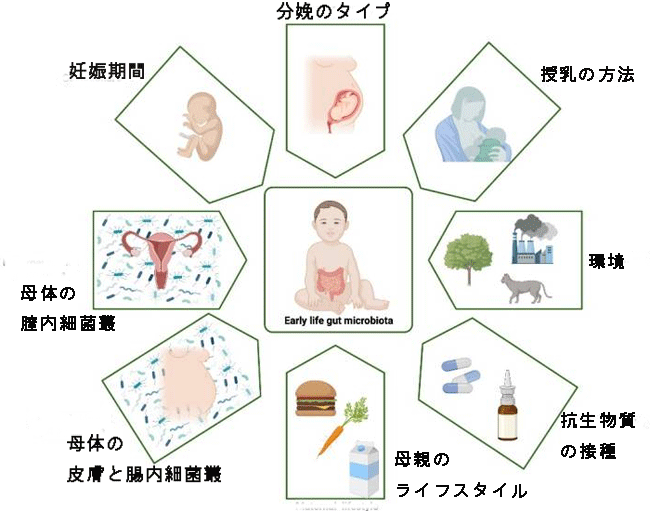 |
| 図 1 幼少期の腸内微生物叢に影響を与える主な要因 |
| 腸内定着の最初のステップはおそらく子宮内ですでに始まっており、母体の腸内微生物叢の影響を受けます。 おそらく、新生児は出生時に特異的に定着しており、腸内に局在する細菌の組成は出産の種類によって異なります。 生後 2 年間、腸内微生物叢の構成は、主に摂食方法、環境、抗生物質の摂取など、複数の要因の影響を受けます。 biorender.com で作成、2022 年 9 月 24 日にアクセス。 |
| 免疫系の障害は、アレルギー疾患を含む複数の病気の原因となります [2]。 それらの発生に関する推測は、自然免疫応答異常と獲得免疫応答異常を中心に考えられています。 まず、衛生仮説は、適切な生得的反応の成熟の重要性を啓発します。 第二に、Th1/Th2 応答の不均衡は、アレルギー疾患の発症に重要な役割を果たしているようです [3]。 |
| アレルギー性鼻炎 (AR) は、上気道の広く蔓延している症状です。 世界中の人口の最大 40% が主に子供に影響を及ぼします [4]。 鼻漏、くしゃみ、鼻づまりやかゆみが特徴です[5]。 このような症状は患者の生活の質に影響を与え、睡眠障害、学習障害、行動の変化などのさまざまな問題を引き起こします。 さらに、アレルギー性鼻炎は副鼻腔炎、中耳炎、喘息の増悪を促進します [6,7]。 アレルギー性鼻炎の治療は、主に鼻コルチコステロイドと鼻および経口抗ヒスタミン薬に基づいています。 さらに、抗コリン薬、抗ロイコトリエン薬、アルファ模倣薬、クロモンも使用されます。 しかし、これらの薬剤の有効性は限られており、複数の副作用を抱えています[8]。 |
| 前述したように、免疫系は、リポ多糖、非メチル化 CpG モチーフ、脂肪酸、フラジェリンなど、腸内に定着した細菌によって提示される大量のリガンドによって常に刺激されています [9]。 これらはトール様受容体 (TLR) によって認識され、免疫系を刺激します。 これは、ナイーブ T 細胞の制御性T細胞(Treg)、Th1、Th2、および Th17 への分化を形成します。 好酸球、好塩基球、マスト細胞のレベルを変更します。 そしてIgEの産生に影響を与えます[10]。 これらのプロセスが腸内微生物叢の構成に密接に関連していることを考慮すると、アレルギー性疾患の発症におけるその重要な役割は依然として有効です[11]。 |
| このレビューは、腸内微生物叢とアレルギー性鼻炎の発症および臨床経過との相互作用を要約することを目的としています。 さらに、腸内に存在する微生物の組成を変化させる免疫調節製剤と、アレルギー性鼻炎治療におけるそれらの効果についても説明します。 |
| 2. 腸内細菌叢の発達とアレルギー性鼻炎のリスク |
| 2.1. 出生前期 |
| 腸内定着の正確な時期はまだわかっていません。 「無菌子宮パラダイム」は長年にわたって受け入れられてきた定説です。 微生物の導入は出生中または出生直後に始まり、分娩の種類に依存すると考えられていました [12]。 しかし、20世紀末になると腸内細菌叢の研究が加速し、健康な新生児がすべて無菌で生まれるわけではないという研究結果も出ている。 微生物は羊水 [13,14]、臍帯 [15]、胎盤 [14]、胎便 [16,17] で発見されました。 動物実験では、胎児の腸内の細菌は母親の腸の細菌と類似していました[16]。 妊娠中の複数のホルモン変化により、腸上皮から胎盤への細菌の移動が引き起こされたと考えられます。 |
| それにもかかわらず、母親の腸内微生物叢は、胎児の免疫系の発達に影響を与える化合物を生成する可能性が高くなります。 Thorburnらは、妊娠中のマウスに高繊維食を与えると独特の腸内細菌叢が生じ、それによって短鎖脂肪酸の酢酸のレベルが増加することを示した。 制御性T細胞の数と機能を強化することで、子供のアレルギー性気道疾患の症状を軽減しました [18]。 さらに、Venter らは、子孫のアレルギーの結果と関連する妊娠中の母親の食事指数を開発しました。 データは、腸内微生物叢の多様性を増加させると報告されている野菜とヨーグルトの多量摂取が、アレルギー性鼻炎、アトピー性皮膚炎(AD)、喘息のリスクを軽減することを示唆しています[19]。 注目すべきことに、このマイクロバイオームの多様性は、制御性T細胞の発生を刺激し、マクロファージの分化を促進する短鎖脂肪酸である糞便酪酸のレベルの上昇を促進します [20,21]。 それにもかかわらず、高度なグリコシル化最終産物を多く含む食品は母体の腸内に存在する細菌の多様性を減少させ、胎児の免疫発達に好ましい代謝産物の生成を最小限に抑えます[22]。 さらに、腸内微生物叢の構成に影響を与えるのは妊娠中の食事だけではありません。 数多くの薬剤が微生物の多様性を変化させ、未熟な胎児の免疫系を調節します。 マウスモデルでは、出生前に抗生物質に曝露されると、新生児の腸内細菌叢の組成が大きく変化しました。 この処理により、Bacteroides spp. およびFirmicutes spp. の存在が減少しました。 そして、対照群と比較して、腸内の Proteobacteria spp. の相対存在量が大幅に増加しました[23]。 注目すべきことに、Bacteroides spp. は、制御性T細胞の分化を促進し、Th1/Th2 バランスに影響を与える多糖を分泌します [24]。 |
| 2.2. 誕生モード |
| 前の段落で述べたように、長年の出生様式が腸内微生物叢の構成に影響を与える主な要因であると考えられていました。 実際、経膣分娩では、乳児は母体の腸、泌尿生殖管、皮膚からの微生物にさらされますが、帝王切開では主に皮膚、口、病院環境に関連する細菌による定着が引き起こされます[25]。 特に、すべての微生物が新生児の腸内に定着できるわけではありません。 微生物叢の構成は、生後 1 年が終わるまでにさまざまな方法で生まれた子どもの間で異なります。 経膣的に生まれた乳児の腸には、Bacteroides spp., Bifidobacteria spp., Lactobacillus spp. が高濃度で存在します。 一方、帝王切開で出産した新生児のマイクロバイオームは、主にStaphylococcus spp., Streptococcus spp., Clostridium spp.から構成されています[26]。 注目すべきことに、細菌種には免疫システムを調節する独自の能力があります。 例えば、Pangらは、Bacteroides spp.がTh2サイトカイン(IL-4、IL-5、IL-13)の分泌を減少させ、アレルギー性気道炎症を改善する制御性T細胞を活性化することを示した[27]。 さらに、Lactobacillus spp. は Th1/Th2 バランスの維持を促進し、炎症誘発性サイトカイン (IL-6 および TNF-α) のレベルを低下させ、IgE 分泌を阻害します [28]。 一方、Staphylococcus aureus のエンテロトキシンはスーパー抗原として作用し、Th2 型免疫応答、IgE 分泌、好酸球性炎症を促進します [29]。 これらの相互作用は、帝王切開で生まれた子供ではアレルギーのリスクが高まるという考えを裏付けるものと思われます。 それにもかかわらず、生後1年で腸内微生物叢が適切に成熟すれば、これらの異常を軽減できる可能性がある[30]。 |
| 2.3. 幼児期 |
| 多くの要因が、幼児期の腸内細菌叢の獲得と進化に影響を与えます。 その中でも、授乳状況が最も影響を与えると考えられます。 母乳は最初の栄養源として最も推奨されています。 成長と発達をサポートし、病原体から守る受動免疫を提供します[31]。 さらに、母乳の特定の組成は、胎児の腸に定着する細菌種に大きな影響を与えます [32]。 母乳で育てられた乳児には、数多くの健康上の利点で知られるBifidobacterium spp.が特に多量に含まれています。 さらに、完全母乳で育てられた子供では、Lactobacillus johnsonii, paracasei/casei 及び Bifidobacterium longum.などのプロバイオティクスとして使用される分類群のレベルが増加しています。 しかし、粉ミルクで育てられた乳児の腸は年長児の腸と著しく類似しており、Clostridium difficile, Granulicatella adiacens, Citrobacter spp. および Enterobacter spp.が大量に定着している[33]。 |
| 母乳中のBifidobacterium と Lactobacillus spp. は、新生児の腸内の IgA 産生形質細胞を活性化します [34]。 さらに、それらは粘膜宿主と微生物叢のクロストークによって局所的な炎症を制御することが注目されており、後年のアレルギーリスクの低下と関連している[35]。 |
| 興味深いことに、特に生後 2 年間に抗生物質に短期間さらされると、腸内細菌叢が長期的な腸内細菌叢の異常状態に移行する可能性があります。 多様性または特定の重要な分類群の喪失、代謝能力の変化、病原体に対する抵抗力の低下は、抗生物質投与後の腸内毒素症を示している可能性があります[36]。 特に、Enterobacteriaceaeの異常増殖とFirmicutes およびBacteroidetes の多様性の減少は、記載されている現象の典型的なものである[37]。 これらの障害は、Clostridium difficile [38] やvancomycin-resistant Enterococcus [39] の侵入に対する宿主の脆弱性を高めます。 Miterらによる後ろ向きコホート研究では、乳児期の抗生物質による治療とアレルギー疾患の発症との間に有意な関連性があることが示された。 たとえば、抗生物質にさらされた小児ではアレルギー性鼻炎が 75% 増加しました [40]。 |
| 3. 健康およびアレルギー性鼻炎における腸内細菌叢の構成 |
| 腸内細菌叢には 1,500 種を超える細菌種が含まれています [42]。 一部の細菌種は、すべての健康な人に典型的に存在します。 Firmicutes, Bacteroidetes, Proteobacteria および Actinobacteriaが全微生物集団の最大 90% を占めます [43]。 注目すべきことに、腸の多様性の変化は、アレルギー疾患に苦しむ患者でより一般的です。 Liuらは93人のアレルギー性鼻炎患者と72人の健康な対照(HC)を登録し、彼らの腸内細菌叢の組成を分析した。 研究では、アレルギー性鼻炎患者は微生物叢の多様性が著しく低く、Bacteroidetes の存在量が増加し、 Actinobacteria と Proteobacteriaのレベルが健康な対照 よりも低いことが示されました [44]。同様の発見が Watts らによって示されました。 Zhuらは、アレルギー性鼻炎患者におけるClostridialesの存在量の減少も指摘した[45,46]。 興味深いことに、すべてのアレルギー疾患が腸内に定着する同じ細菌種を特徴とするわけではありません。 アルツハイマー病、慢性蕁麻疹、アレルギー性鼻炎の患者間では微生物叢が大きく異なり、これは腸内細菌コロニーがアレルギー性皮膚疾患とアレルギー性鼻疾患の患者で大きく異なることを示しています。 さらに、腸-皮膚軸および腸-鼻軸の存在を検証します[47]。 |
| 4. 腸内細菌叢による免疫システムの形成 |
| 前述したように、腸内細菌叢は免疫系の発達に影響を与える新しい器官として機能します。 「腸と器官の軸」という用語は、腸に定着する細菌種と、鼻、肺、脳、皮膚で起こるプロセスとの間の重大なクロストークを指します。 経膣的に生まれ、母乳で育てられた健康な乳児の微生物叢は、その免疫システムを正しく形成します。 しかし、腸内組成のあらゆる乱れは未熟な免疫に悪影響を及ぼし、先天的および適応的反応を混乱させる可能性があります。 図 2 は、腸内細菌叢の組成の変化と アレルギー性鼻炎患者の免疫系への影響との関連性を説明しています。 |
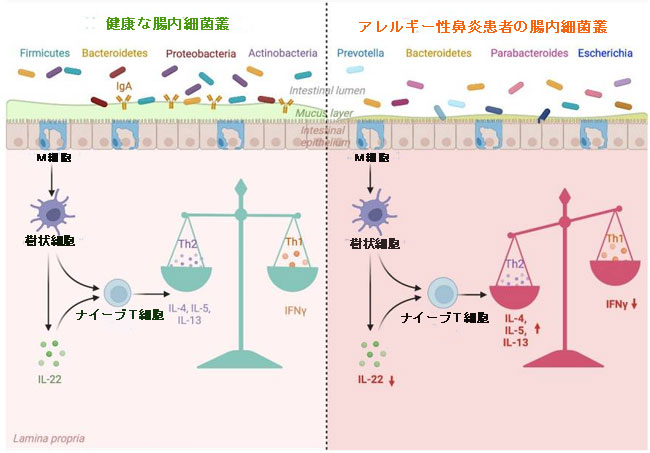 |
| 図 2 アレルギー性鼻炎患者における腸内毒素症(腸内細菌叢の異常)と Th1/Th2 バランスへの影響 |
| 腸内細菌叢の組成は、健康な個人と アレルギー性鼻炎患者の間で異なります。 アレルギー性鼻炎に典型的な腸内微生物叢はサイトカインの好ましくない変化を促進し、アレルギー性鼻炎の発生に関与する Th1/Th2 の不均衡を促進します。 |
| 腸上皮細胞 (IEC; マイクロフォールド細胞) は、細菌と宿主の免疫系の橋渡しをします。 それらは、共生細菌由来のシグナル (細菌の代謝産物、細菌の成分、細菌自体) を翻訳し、粘膜免疫細胞に送ります。 このようなクロストークは、腸上皮細胞が腸管免疫において重要な役割を果たしており、セグメント化した糸状細菌が定着した無菌マウスで観察された。 微生物は腸に定着し、腸上皮細胞を介して血清アミロイドAの産生を誘導し、これによりTh17の分化とIL-22産生が改善された[48]。 |
| 樹状細胞 は、自然免疫応答および獲得免疫応答との相互作用において重要な役割を果たします。 これらは二次リンパ組織に移動し、CD4+ T 細胞を刺激して活性化シグナルに基づいてサブタイプに分化します。 共生細菌由来の代謝産物は樹状細胞の機能に影響を与えます。 たとえば、短鎖脂肪酸はIL-12を抑制し、IL-10およびIL-23の産生を増加させます[49、50]。 さらに、それらは CCL3、CCL4、CCL5、CXCL9、CXCL10、および CXCL11 のレベルを低下させ、T 細胞機能を間接的に調節します [51]。 さらに、それらは B 細胞の IgA クラススイッチと IgA 産生を誘導し、樹状細胞の調節を介して他の適応応答細胞の機能を調節します [52]。 |
| 腸上皮に関連するマクロファージは、幅広い機能を持っています。 彼らは病原体を摂取し、他の免疫細胞に影響を与え、制御性T細胞の維持をサポートする複数のサイトカインを産生します。 Liuらは、微生物によって産生される短鎖脂肪酸がマクロファージによる抗炎症性IL-10分泌を促進することを示した[53]。 さらに、それらはマクロファージの代謝を変化させ、mTOR キナーゼ活性を低下させ、抗菌ペプチドの生産を増加させます[54]。 |
| このレビューでは、腸内細菌叢と T 細胞の間の相互作用は、Th1/Th2 バランスに対する微生物の影響と、アレルギー性鼻炎発生におけるその重要な役割に限定されています。 特に、人生の初期において、全身性免疫応答は Th2 に偏っています [55]。 したがって、腸内の細菌の適切な構成は、前述のバランスを維持する上で問題となります。 Qianらは、マウスの腸内微生物定着に対するさまざまな幼少期の曝露の影響を調査した。 この研究では、幼少期の腸内細菌叢の多様性がIL-4およびIFN-γのレベルに影響を及ぼし、Th1/Th2バランスを調節することで喘息の気道の炎症を防ぐ可能性があることが示された[56]。 さらに、Jakobssonらは、生後2年間の微生物の多様性が低いとBacteroidetesの定着が遅れ、Th1型反応が低下することを指摘した[12]。 |
| 2 型自然リンパ球 (ILC2) は、表面マーカーが欠如している自然免疫細胞であるため、識別が困難です。 これらは Th2 型細胞を反映しており、アレルギーの発症に重要な役割を果たしています [57]。 特に、腸内微生物叢は、腸 - 肺軸を通した腸から肺への ILC2 の移動に影響を与えます。 例えば、Proteobacteria は、前記遊走を著しく促進し、IL-33の産生を促進する[58]。 さらに、Chuaらは、呼吸器アレルギーの発症とRuminococcus gnavusの存在量の増加とを関連付けた。 彼らは、腸内毒素症が ILC2 と DC を刺激して 2 型サイトカインを産生し、好酸球と肥満細胞による肺浸潤を促進することを示した [59]。 一方、腸内細菌叢による食物繊維の発酵に由来する短鎖脂肪酸は、ILC2の機能を阻害し、肺の炎症を予防します[60]。 したがって、研究では、ILC2 の活性が腸内微生物叢によって調節されていることが示唆されていますが、その根底にあるメカニズムはまだ十分に解明されていません。 |
| 5. 腸内微生物叢の組成に影響を与える製剤とアレルギー性鼻炎の治療におけるその効果 |
| アレルギー有病率の上昇に伴い、胃腸管に存在する微生物叢とその有益な効果に関する知識がますます重要になっています。 一方で、プロバイオティクス、プレバイオティクス、シンバイオティクスは、望ましくない細菌の活動を抑制し、宿主の代謝を調節することにより、腸内細菌叢の組成に影響を与えます。 一方、細菌溶解物(BL)は、腸粘膜内の樹状細胞を刺激し、免疫応答を調節することにより、腸内環境に間接的に影響を与えます。 最後に、新しい治療法としての糞便微生物叢移植 (FMT) は、安定した腸内微生物叢の維持を確実にする可能性があります。 |
| 5.1. プロバイオティクス |
| 世界保健機関は、プロバイオティクスを「適切な量で投与すると宿主に健康上の利益をもたらす、厳密に選択された微生物の生きた菌株」と定義しています[61]。 注目すべきことに、すべての有益な細菌種がプロバイオティクスになるための要件を満たすことができるわけではありません。 細菌株の安全性は、その起源、病原性の欠如、および抗生物質耐性プロファイルによって定義されます。 さらに、プロバイオティクスは製造が容易であり、流通プロセスを通じてその特性を容易に維持できる必要があります[62]。 |
| プロバイオティクス製品には、1 つ以上の細菌株が含まれています。 最も使用されるのは、Lactobacillus(乳酸菌), Bifidobacterium(ビフィズス菌), Lactococcus, (乳酸球菌)Streptococcus (連鎖球菌)およびEnterococcus(腸球菌)です[63]。 その主な利点は、人間の健康に影響を与える微生物間の適切なバランスを確保できることです。 それらは抗菌製品の生産を通じて拮抗作用を促進し、病原体と競合し、細菌毒素の生産を阻害し、宿主の免疫系を調節します[64]。 |
| いくつかの人体研究では、アレルギー性鼻炎を含むアレルギー疾患の予防と治療におけるプロバイオティクスの有効性が評価されています。 アトピー性疾患に対するLactobacillus GG の影響を調査した最初の臨床試験は、Kalliomäki らによって実施されました。 まず、アレルギーの家族歴を持つ母親に対し、出生前にLactobacillus GG 株を補給しました。 第二に、彼らの乳児は生後6か月間、同じストレスを受けました。 この研究では、プロバイオティクス群のアレルギー疾患の頻度がプラセボ群の半分であることが示され(23%対46%)、アレルギー疾患の予防におけるプロバイオティクスの有望な有効性に注目した[65]。 その後、Wang らは、アレルギー性鼻炎患者の生活の質 (QOL) に対するLactobacillus paracasei -33 (LP-33) を含む発酵乳の影響を調査しました。 この結果は、Lactobacillus paracasei -33強化発酵乳を 30 日間摂取すると、アレルギー性鼻炎患者のQOLを効果的かつ安全に向上させることができ、代替治療として使用できる可能性があることを示唆しました [66]。 前述の研究の有望な結果に勇気づけられた研究者たちは、細菌株の有効性がその活性に依存するかどうかを調べることにしました。 Pengらは、ヒト被験者のイエダニによって誘発されるアレルギー性鼻炎の治療における、熱で死滅させたLactobacillus paracasei -33の影響をその生きた菌株と比較した。30日間の治療後、結果は同等でした。熱処理したLactobacillus paracasei -33は生変異体に劣らず、どちらの介入もプラセボ群と比較してアレルギー性鼻炎患者のQOLを改善した[67]。 最近、Yanらはアレルギー性鼻炎への介入としてプロバイオティクスを用いた30件のランダム化対照試験(RCT)を収集し、メタ分析を準備した。 その結果、プロバイオティクスの補給後、プラセボ群と比較して、鼻炎の生活の質(RQLQ)総合スコア、RQLQ鼻スコア、および鼻症状の鼻炎総症状スコア(RTSS)が大幅に改善されたことが示されました。 しかし、血中好酸球数、RQLQアイスコア、RTSSグローバルスコア、RTSSアイスコア、総血清IgEレベルおよび抗原特異的血清IgEレベルにおいては、プラセボ群とプロバイオティクス群の間に有意差はありませんでした。 注目すべきことに、含まれた研究の大部分では、LactobacillusとBifidobacterium株からなるプロバイオティクスが使用されていました。 ほとんどの研究では悪影響は報告されていません。 しかし、一部の研究には定量化可能なデータが不足しており、その結果は不完全でした。 したがって、より質の高いランダム化対照試験を実施することが緊急に必要である[68]。 |
| アレルギー性鼻炎のリスクを軽減し、臨床経過を改善するプロバイオティクスの作用メカニズムは完全には理解されていません。 しかし、Kukkonenらは、プロバイオティクスの補給が、抗原の除去に関与する粘膜IgAの大量分泌と関連している可能性があることを示した[69]。 さらに、プロバイオティクスの摂取は、抗原特異的 IgE および Th2 サイトカイン (IL-4、IL-13) の分泌を減少させる可能性があります [70]。 |
| アレルギーと鼻学に関する国際コンセンサス声明:アレルギー性鼻炎では、プロバイオティクスの害が最小限であり、症状を改善する効果が証明されているため、アレルギー性鼻炎患者の補助療法としてプロバイオティクスを考慮することを推奨していることは指摘する価値があります[71]。 |
| 5.2. プレバイオティクス |
| プレバイオティクスは、腸内細菌叢の組成と活性に影響を与える特定の食事成分です。 サプリメントとなるには、いくつかの包含基準を満たさなければなりません。 第一に、プレバイオティクスは胃酸性、酵素による加水分解、および胃腸吸収に対して耐性がなければなりません。 第二に、それらは腸内微生物叢によって発酵され、有益な細菌の増殖を刺激できる必要があります[72]。 最も使用されるプレバイオティクスは、ラクチトール、ラクツロース、イヌリン、ラクトスクロース、フラクトオリゴ糖、ガラクトオリゴ糖、および大豆オリゴ糖である[73]。 それらは、プロバイオティクスの代替品として、またはプロバイオティクスのサポートとして使用される場合があります。 |
| IgE レベルの高いアレルギー性鼻炎の成人に対するプレバイオティクスの影響を調査した研究は 1 件だけでした。 患者には52週間にわたりラクトスクロースが投与され、血清IgEレベルが測定されました。 1 年間の治療後、血清 IgE レベル (特に花粉アレルゲンに対する) が大幅に減少し、アレルギー症状の軽減が見られました [74]。 さらに、Derakhshanらは、成人アレルギー性鼻炎患者に対する乾燥Ma-al-Shaeer(大麦をベースにした処方の、繊維が豊富なイランの伝統的な薬)とフェキソフェナジンの効果を調査した。 登録された参加者は、14 日間連続して 1 日 2 回、口頭で説明された製剤を受けました。 アレルギー性鼻炎の臨床経過は両方のグループで改善されましたが、Ma-al-Shaeer グループでは鼻づまり、後鼻漏、頭痛スコアが大幅に減少しました [75]。 |
| プレバイオティクスは、乳児用の粉ミルクのサプリメントとして広く使用されています。 Arslanogluらは、プレバイオティクスオリゴ糖のアレルギーに対する保護効果を評価した。 このランダム化対照試験では、アトピーのリスクがある健康な乳児に、生後 6 か月間プレバイオティクスまたはプラセボを添加したミルクを与えました。 追跡期間は5年間続きました。 アレルギー発現の累積発生率は、プレバイオティクスを補給したグループで有意に低かった。 この介入は、アレルギー性鼻結膜炎とアレルギー性蕁麻疹の予防に特に有益でした[76]。 |
| アレルギーのマウスモデルでは、2'-フコシルラクトースと6'-シアリルラクトースがIL-10の産生を刺激し、マスト細胞を安定化させた[77]。 Gourbeyreらによる研究では、プレバイオティクスを補給したマウスとプレバイオティクスを補給しなかった感作マウスは、同様のレベルのIgE、IgG1、IL-4、IL-17およびアレルギー症状を示すことが示された。 ただし、IgG2a、特異的 IgA、IL-10、TGF-β、および IFN-γ のレベルは、プレバイオティクス治療グループの方が有意に高かった。 これは、マウスモデルにおいて、周産期および離乳後期間中のプレバイオティクスへの曝露が、アレルギーに関連するバイオマーカーに影響を与えることなく、耐性に関連するバイオマーカーの最も高い発現を誘導することを示唆している[78]。 |
| 結論として、アレルギー性鼻炎の予防と治療におけるプレバイオティクスの使用に関するデータはまだ不十分です。 それにもかかわらず、サイトカイン放出を調節するそれらの能力は、アレルギー疾患の治療に対する新しい有望なアプローチであるようです。 |
| 5.3. 細菌溶解物 |
| 細菌溶解物は、気道病原体に由来する抗原からなる免疫調節製剤です。 最も一般的なものは、Streptococcus pneumoniae(肺炎球菌), Haemophilus influenzae(インフルエンザ菌), Moraxella catarrhalis(モラクセラ・カタラーリス), Streptococcus pyogenes(化膿レンサ球菌), Streptococcus viridans(ビリダンス連鎖球菌), Staphylococcus aureus(黄色ブドウ球菌), Klebsiella pneumoniae (肺炎桿菌)および Klebsiella ozaenae(オザエナ桿菌)である[79]。 この調製物は、化学的または機械的溶解を使用して取得できます。 製造方法が異なると、免疫効果も異なります。 細菌溶解物は、経口、鼻腔内、舌下に投与できます [80]。 このレビューでは、腸内環境への影響による経口投与について説明します。 |
| 前述したように、細菌溶解物の作用機序は病原体抗原への自然な曝露とそれに続く免疫反応に基づいています。 これらは、Toll 様受容体を介して樹状細胞を活性化し、抗ウイルスサイトカインの放出、ナチュラルキラー(NK)細胞の活性化、および Th1/Th2 バランスの回復を促進します。 細菌溶解物の作用の詳細なメカニズムについては、以前の出版物 [81] で説明されています。 |
| アレルギー性鼻炎コースに対する細菌溶解物の影響を調査した研究は 5 件のみでした。 そのうち 2 名は経口投与の OM-85 を使用していました。 Koatzらは、アレルギー性鼻炎、喘息、または慢性閉塞性肺疾患の患者における気道感染率、初発疾患増悪率および症状の重症度に対するOM-85の使用に関する非盲検の連続研究を実施した。 患者は、連続 10 日間の摂取とそれに続く 20 日間の休憩からなる 3 サイクルで製剤を受けました。 彼らは、OM-85療法により、患者が標準的な最適化された治療のみを受けた前年と比較して、気道感染症とアレルギー性鼻炎増悪の数、およびアレルギー症状の重症度が減少したことを示した。 さらに、血清および唾液の IgA レベルの増加が実証されています [82]。 研究をさらに拡大するために、Mengらは、多年性アレルギー性鼻炎患者60人を対象にその臨床効果を評価した。 登録された参加者には、前述の研究と同じレジメンに従って OM-85 が投与されました。 治療後、OM-85 グループは、総鼻症状スコア、かゆみスコア、鼻鼻漏スコア、くしゃみスコア、投薬スコアの有意な減少を示しました。 さらに、鼻腔 IFN-γ の増加、鼻腔 IL-4 および IL-13 レベルの減少、鼻腔スワブ中の好酸球の数が観察されました [83]。 |
| 細菌溶解物は腸内細菌に直接影響を与えません。 ただし、それらによって刺激されたサイトカインは腸内環境に影響を与える可能性があります。 Van Averbekeらは、宿主免疫が腸内微生物叢の構成に影響を与えると示唆している。 研究者らは、マウスモデルにおいて、ナイーブ野生型マウスとTh2応答またはTh1応答とTh2応答の両方が欠損しているマウスの体液性、細胞性、サイトカイン免疫とそれに関連する腸内細菌叢の変化を特徴づけた。 この研究では、野生型マウスには有益な短鎖脂肪酸の産生を刺激できる細菌が豊富に含まれていることが示されました。 さらに、Th1 傾斜マウスは、ナイーブな野生型マウスと比較して、微生物の多様性が低かった。 これらのデータは、Th1/Th2 バランスの変化または Th1/Th2 応答の完全な除去により、腸内細菌叢の組成と機能が大きく変化する可能性があることを示唆しています [84]。 |
| 5.4. 糞便微生物叢の移植 |
| 糞便微生物叢の移植(FMT) は、健康なドナーの便を便懸濁液に変え、患者の腸に投与して腸内細菌叢のバランスを再確立する手順です [85]。 現在のところ、アレルギー性鼻炎の 治療における使用に関する研究はありません。 ただし、腸内細菌の組成を回復するには有望な方法である可能性があります。 潜在的に、それは、はるかに豊富に注入された微生物と腸に永続的に定着する能力により、プロバイオティクスよりも効果的である可能性がある[86]。 |
| この推定は、成人アルツハイマー病患者における FMT の影響を調査した Mashiah らの研究によって支持されています。 糞便微生物叢の移植後にアトピー性皮膚炎スコアリング (SCORAD) が大幅に減少することが示されました。 さらに、毎週のコルチコステロイドの局所使用は、研究および追跡期間中に減少しました。 腸内細菌叢のメタゲノム解析により、ドナーから患者への重大な細菌株の伝播が示されました。 治療による副作用は観察されなかった[87]。 それにもかかわらず、アレルギー疾患への使用に関するデータはまだ不十分です。 したがって、より大規模なサンプル研究が必要です。 |
| 6. 結論 |
| 要約すると、腸内微生物叢がアレルギー性鼻炎の発症に関与している可能性が非常に高いと思われます。 この分野で発表される証拠が増え続けるにつれ、アレルギー性鼻炎の新しい予防と治療に対する期待も同時に高まっています。 |
| 免疫システムの不均衡は、腸内細菌叢の組成の減少に関連していると考えられています。 出生前、新生児、幼児期の細菌の定着は腸内環境を変化させ、免疫系の発達に影響を与えます。 したがって、幼少期の定着における障害は、将来の宿主の免疫に影響を与え、アレルギーを引き起こす可能性があります。 しかし、プロバイオティクス、プレバイオティクス、および細菌溶解物は、この不均衡を回復するための有望な治療アプローチであると思われます。 |
| 将来的には、アレルギーのリスクが非常に高い患者を特定したり、腸内細菌叢を効果的かつ永続的に調整したりすることも可能になるでしょう。 それにもかかわらず、最終的な結論を導くためには、より厳密で詳細な試験が必要です。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Nutrients. 2022 Oct; 14(20): 4328に掲載されたThe Crosstalk between the Gut Microbiota Composition and the Clinical Course of Allergic Rhinitis: The Use of Probiotics, Prebiotics and Bacterial Lysates in the Treatment of Allergic Rhinitis.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |