| 目次(クリックして記事にアクセスできます) |
1.はじめに |
| 2. マイクロバイオームの起源 |
| 3. 膣および上部生殖管の微生物環境 |
| 4. 女性の生殖器官における乳酸菌の役割 |
| 5. 子宮頸がんの発症に対するヒトパピローマウイルスと膣微生物叢の影響 |
| 6. 子宮内膜がん |
| 7.治療 |
| 7.1. ワクチン |
| 7.2. プロバイオティクスとプレバイオティクス |
| 8. 将来の展望と限界 |
| 9. 結論 |
| |
|
| 1.はじめに |
| 子宮頸がんは、統計によると、世界中の女性の腫瘍関連死の 3 番目に多い原因であるため、重要な健康問題です [1]。 この病気の推定有病率は 530,000 の新しい症例に達し、年間約 275,000 人の女性が子宮頸癌で死亡しています [2]。 この感染関連新生物は、ヒトパピローマウイルスの株によって引き起こされます。 同定された 100 を超える ヒトパピローマウイルス株のうち、13 (ヒトパピローマウイルス-16 および ヒトパピローマウイルス-18 を含む) が 100% の症例で子宮頸がんの原因であることが判明しました [3,4]。 ほとんどの場合 (90%)、ヒトパピローマウイルス感染は免疫系によって 6 ~ 18 か月以内に消失するようです [5]。 トール様受容体 (TLR) やナチュラル キラー (NK) 細胞の活性化を含むさまざまな宿主メカニズムの開始は、多くの場合、ヒトパピローマウイルスを根絶するのに十分であることが実証されています [6]。 ヒトパピローマウイルス感染に対する最初の免疫は、局所的な自然免疫系によって提供されます。 ヒトパピローマウイルス感染の頻度は、獲得免疫を高めるヒトパピローマウイルスワクチン接種によって減少させることができます。 しかし、持続的な高リスクヒトパピローマウイルス感染は、細胞構造の変化を介して直接的に、または慢性炎症と免疫逃避を介して間接的に、子宮頸がんの発症につながる可能性があります [7,8]。 ウイルスの持続性は、免疫不全、クラミジア・トラコマチス感染、喫煙、および年齢によって促進されます。 頸膣微生物叢と炎症の不均衡も、ウイルスの持続性とその結果としてのがんの発生の調節に重要な役割を果たすことが実証されました [1,3]。 生理学的条件下では、膣内の豊富な細菌が動的バランスの維持に有利に働きます。 しかし、膣の微小生態系のバランスが乱れると、膣の炎症、高度な子宮頸部上皮内腫瘍、子宮頸がんなど、さまざまな婦人科疾患の発症につながる可能性があります[9]。 多くの研究により、健康な個人と比較した子宮頸がんの女性におけるStaphylococcus epidermidis, Mycoplasma genitalium, Mycoplasma hominis, Escherichia coli, enterococci, および Bacteroidesの豊富さを含む膣内細菌叢の違いが確認された[10,11]。 このレビューの目的は、微生物叢、特にLactobacillusと腸内細菌叢が子宮頸がんおよび子宮内膜がんの発症リスクに及ぼす影響、ならびに新規の実験的治療法に関する既存および新たなデータを要約することでした。 次のキーワードを使用して、PubMed、Medline、および Cochrane データベースを検索しました。 子宮頸がん、子宮内膜がん、腸内細菌叢、Lactobacillus、ヒトパピローマウイルス、単純ヘルペス、および膣微生物叢。 |
| |
|
| 2. マイクロバイオームの起源 |
| 人体、特に腸内に生息する多くの微生物は、健康に有益であることが証明されています [12]。 1000 を超える異なる細菌種が消化器だけに存在します [13]。 マイクロバイオームの組成は個人によって大きく異なるため、「健康な微生物叢」の統一された定義はありません [14]。 腸内細菌叢 (主として細菌ですが、いくつかの真菌、ウイルス、および古細菌も含む) の定着と発達は、生後 3 年間で始まり、最終的に成人のようなプロファイルを採用します [15,16]。 動的で非ランダムなプロセスは、出産方法、給餌方法と食事、抗生物質の使用、母親の年齢、代謝状態、ライフスタイル、遺伝学など、さまざまな周産期の状態の影響を受ける可能性があります [12]。 研究結果は、母親の微生物叢による最初のコロニー形成が胎児期に始まることを示しています。 Nagpal ら [17] は、帝王切開分娩 (CS) 新生児と比較して、経膣分娩 (VG) 新生児の方が胎便中の乳酸菌の量が多いことを示しました。 経膣分娩の乳児は、母体の膣および糞便の微生物叢にさらされるようになりますが、帝王切開で分娩された乳児は、母体の皮膚、病院環境、および病院スタッフからの環境微生物と接触します。 これが、両方のケースで新生児の腸内コロニー形成が異なる理由です [18,19,20]。 乳児におけるLactobacillusおよびPrevotella微生物叢の存在は、母体の膣管に生息する種の垂直感染と関連している可能性があることが示唆されました [21]。 腸内微生物叢も、母乳で育てられた乳児と粉ミルクで育てられた乳児の間で異なりました。 Bifidobacteriaが豊富な「牛乳指向の微生物叢」は母乳で育てられた乳児に見られましたが、後者のグループの腸内細菌叢はより多様であり、staphylococci, enterococci, bacteroides, enterobacteria, clostridiaおよびAtopobium属が含まれていました[22,23,24]。 安定した後でも、腸内細菌叢は、抗生物質の使用、食事、年齢、ストレス、一部の病気、および酸素レベル/酸化還元状態、pH、温度などの環境パラメーターなど、さまざまな要因の影響を受ける可能性があります [12]。 これらの微生物は、特定の栄養素のアクセシビリティを高め、異物代謝を促進し、病原体のコロニー形成を防ぎ、自然免疫および獲得免疫プロセスを調節および強化するため、人間の健康に不可欠です [12,13,25,26]。 初期の微生物叢は、免疫システム、腸管の発達、および代謝のプログラミングに不可欠です。 幼少期の腸内細菌叢の恒常性の乱れは、成人期の健康状態にも影響を与え、免疫系を損ない、代謝障害のリスクを高めることがわかっています。 さらに、腸の微生物群集の持続的な障害 (dysbiosis として知られる) は、心血管疾患、炎症性腸疾患 (IBD)、肥満、糖尿病、がん、および中枢神経系障害に関連しています [13]。 したがって、妊娠の第 2 および第 3 トリメスター(訳者注:3カ月間、【語源】ラテン語trimestris(3カ月の)、米国では臨月を第9月と表現し、妊娠9カ月を3分割し、第1期(first trimester)、第2期(second trimester)、第3期(third or last trimester)と呼ぶ)中のLactobacillus rhamnosusによる治療を含む、妊娠中の母体の膣および糞便微生物叢を変更するための戦略が開発されました。 このような治療法は、低い膣pHと病原体のない膣環境を維持するのに役立つだけでなく、乳児の腸でのBifidobacteriaのコロニー形成にも関連していました[27,28,29]。 |
| |
|
| 3. 膣および上部生殖管の微生物環境 |
| 女性の生殖管には、健康や病気の状態に影響を与えるさまざまな微生物が共存しています [30]。 生殖年齢の健康な女性の膣内微生物叢は多様ではなく、通常、1 つまたは少数のLactobacillus spp.から構成されています [26,31]。 生殖年齢の女性の膣内細菌叢は、主にLactobacillus gasseri, Lactobacillus crispatus, Lactobacillus jensenii,およびLactobacillus inersを含むさまざまなLactobacillus sppで構成されています [31,32,33]。 有益な微生物の枯渇は、性感染症、骨盤内炎症性疾患、早産、自然流産のリスクを高める可能性があることが研究で示されています [34]。 研究によると、各女性の膣マイクロバイオームのプロファイルは、6 つのコミュニティ ステート タイプ (CST) に分類できます [3,35]。 Lactobacillus、特に L. crispatus, L. gasseri, L iners, and L. jensenii,は CST-I、II、および III で優勢であり、Streptococcus および Prevotella は CST IV-A で優勢であり、 Atopobiumは CST IV- Bで非常に優勢です。 CST-IV に属する細菌の存在は、しばしば細菌性膣炎と関連しています。 CST-IV に属する細菌の存在は、しばしば細菌性膣炎と関連しています。 前述のLactobacillusは、他のタイプのLactobacillusが膣ニッチで観察されていないため、膣ニッチで優勢に適応しているようです [36,37]. この現象の説明は不明です。 ただし、進化の問題に関連している可能性があります [38]。 膣のLactobacillus spp.の優位性は、この微小環境を病原体の侵入から保護します。 Gardnerella vaginalisもまた、膣のマイクロバイオームにおいて優勢である可能性があることが観察されています。 非Lactobacillus優勢の膣マイクロバイオームは、白人およびアジア人女性 (10–20%) と比較して、ヒスパニック系および黒人女性 (30–40%) でより頻繁に見られるようです [39,40,41]。 民族的および人種的格差は、さまざまな環境的および社会経済的要因、ならびに性的および衛生関連などの多様な行動に起因する可能性があります[42]。 しかし、いくつかの報告では、少なくとも 1 つのLactobacillusが病状に関連している可能性があることが示されています。 たとえば、L iners,は、膣環境の障害を持つ女性で特定されました [43,44,45]。 L iners,優勢な膣マイクロバイオームの存在は、非Lactobacillus優勢なコミュニティへの移行中に頻繁に観察されます [46]。 |
| 膣のマイクロバイオームは、ヒトパピローマウイルスやその他の STI による感染、性行為、潤滑剤の使用、性的パートナーの数、避妊の使用、衛生習慣、健康管理、食事と栄養(高脂肪食と高血糖負荷)、喫煙、身体活動、肥満、アルコール消費へのアクセスなど、さまざまな要因の影響を受ける可能性があります。 年; 遺伝的およびエピジェネティックな要因; ホルモンレベル; 妊娠; 免疫系障害; ストレス; また、生体異物、発がん物質、毒素、抗生物質への曝露もその組成に影響を与えます [47,48,49]。 膣内微生物叢のプロファイルは民族によって異なります。 Lactobacillusは、ヒスパニック系および黒人女性と比較して、白人およびアジア系女性でより一般的です [3]。 微生物叢の民族差は、粘膜免疫と代謝経路に影響を与える遺伝的要因、または衛生習慣に関連している可能性があります[3]。 腸内微生物叢は、エストロゲン放出の調節を介して膣の微小環境におけるLactobacillusの存在量に間接的に影響を与えることが実証されており、これは腸-膣軸の存在を示唆している可能性があります [50,51,52]。 微生物によって分泌されるβ-グルクロニダーゼとβ-グルコシダーゼはエストロゲンに結合し、循環への再吸収が促進されます[53,54]。 次に、結合していないエストロゲンが女性の生殖管に到達し、そこでグリコーゲン合成の増加、生殖器上皮の肥厚、および粘液の生成に関連する細胞内シグナル伝達を活性化します。 したがって、エストロゲンやプロゲステロンを含む女性ホルモンは、Lactobacillusの膣内コロニー形成を調節します。 これらのホルモンのレベルが高いと、膣内微生物叢の多様性が低くなり、Lactobacillusが優勢になります[55,56]。 エストロゲンレベルと膣内のLactobacillus の量との関係は、月経前、つまりエストロゲンレベルが大幅に低下している女性のLactobacillus 量が減少しているという発見に反映されています[57,58]。 エストロゲンレベルが低下するこの時期に、一部の種は濃縮されますが、他の種は膣環境で枯渇します[35]。 一時的なエストロゲン欠乏症は、膣の萎縮を引き起こす可能性があり、これは細菌の多様性の増加に部分的に関与しています [35]。 乳酸菌プールの減少は、嫌気性菌の優位性とそれに続く子宮頸がん発症のリスクと関連しています。 膣のホルモン関連微生物組成の根底にあるメカニズムは完全には理解されていませんが、 Lactobacillus spp.の優位性は、エストロゲンによる膣上皮の成熟、α-アミラーゼの産生、およびグリコーゲンの蓄積と関連している可能性があることが示唆されています [59]。 α-アミラーゼによるグリコーゲンのマルトース、マルトトリオース、マルトテトラオース、α-デキストリンなどの単純な生成物への分解は、 Lactobacillus spp.の増殖とコロニー形成を促進します [60]。 避妊薬などの合成ホルモンの使用も、細菌性膣炎の発生率または再発を減少させることが報告されている [61]。 次に、喫煙、性交、および膣洗浄は、 L. crispatusの量を減少させ、種の多様性を増加させ、細菌性膣炎のリスクを高めるように思われる [62,63,64]。 |
| 子宮、卵管、または卵巣に生息する一般的な微生物叢に関するデータは、その評価の問題により限られている[65]。 女性の上部生殖管の微生物叢は、組成と量において膣の微生物叢とは非常に異なることがわかった[42]。 Chen ら [66] は、子宮内の細菌数が膣内の細菌数と比較して約 10,000 分の 1 になる可能性があることを示唆しました。 ただし、この推定は、経頸管コレクション中に管の下部からの細菌との交差汚染のリスクが高いため、不正確である可能性があります。 さらに、上部生殖管の微生物叢は、下部生殖管の微生物叢と比較してより多様であることが示唆されています。 しかし、さまざまな研究が異なる微生物叢組成を示しているため、真のメンバーは特定されていません [66]。 Lactobacillus spp.は上部管にも見られましたが、その存在量は膣と子宮頸部からの撤退とともに徐々に減少しました。 |
| 多くの研究により、さまざまな体の部位が性器微生物の貯蔵庫として機能する可能性があることが明らかになりました。 例えば、Lactobacillus, Gardnerella, Sneathia, Prevotella, Atopobium, Gemella, Peptoniphilus, およびFinegoldia, などの一般的な膣内細菌は、通常、女性と男性の両方の尿路に見られます [67,68,69]. Thomas-White ら [69] は、膣と膀胱の微生物叢が、腸内細菌叢とは異なる同等の機能的能力を示すことを観察しました。 膀胱および膣内の Lactobacillus spp.の存在は、侵入する尿路病原体に対して保護効果を発揮する可能性があります。 さらに、膣と直腸の両方に、L. crispatus, L. jensenii, L. iners, および L. gasseri,などの膣のLactobacillus spp.が共存していることは、細菌性膣炎の有病率が最も低いことと関連していました [70,71]。 したがって、直腸は膣乳酸菌の重要な貯蔵庫である可能性が示唆されました. 男性の陰茎の皮膚、精液、および尿検体に膣マイクロバイオームのメンバーが存在することは、性的パートナーが尿生殖路に存在する微生物叢を交換できることを意味している可能性があります [72]。 いくつかの研究によると、子宮内膜微生物叢の組成は、着床、妊娠、出生率に影響を与える可能性がある [73]。 Lactobacillus spp.が優勢の子宮内膜液と膣吸引液は、より良い結果と相関しています。 子宮内微生物叢は、受胎中に免疫環境に影響を与えることが示唆された [74]。 子宮内膜液中の微生物組成の変化は、子宮内膜内で炎症反応を誘発する可能性があり、その結果、胚着床の成功の可能性が低下します [75]。 |
| |
|
| 4. 女性の生殖器官における乳酸菌の役割 |
| 体の多くの部分では微生物の多様性が有益であると思われるのとは対照的に、膣では微生物叢の多様性がより高いため、しばしば腸内細菌叢の異常や病状の進行を引き起こします。 多くの研究で、Lactobacillus spp.を含む膣内微生物叢が、日和見感染に対する生殖管および消化管の保護に関与していることが実証されています [1,7]。 Lactobacillus spp.がグルコースの発酵 (解糖) を介して乳酸を生成する能力は、この有機酸が膣の酸性環境を維持するのに役立つため、膣の真正生物形成をサポートします [76]。 酸性環境は、 C. trachomatis, G. vaginalis,および Neisseria gonorrhoeaeを含むいくつかの潜在的な病原性種の増殖を制限します [32,77,78,79]。 膣の pH が 5.0 を超えると、閉経前の女性の ヒトパピローマウイルスのリスクが 10 ~ 20% 増加することがわかった [80]。 この発見は、ウイルスの形質転換に重要な ヒトパピローマウイルスタンパク質である E5 が低 pH に対して脆弱であるという事実によって部分的に説明できます [81]。 さらに、子宮頸部および膣細胞の代謝機能に最適な条件を提供します [82]。 環境の pH に影響を与えることは別として、乳酸自体の化学構造は、ヒトパピローマウイルス感染と扁平上皮内病変の発生を調節する可能性があります [3]。 キラル分子として、乳酸はD-およびL-異性体の形で生成することができます。 研究では、高レベルの D-乳酸が、膣上皮細胞における細胞外マトリックスメタロプロテイナーゼ誘導因子 (EMMPRIN) 産生の調節を介して、Chlamydia感染症および上部生殖管感染症から保護できることが実証されています [83,84]。 L-乳酸と D-乳酸の比率が高いほど、細胞外マトリックスメタロプロテイナーゼ誘導因子の発現の増強とマトリックスメタロプロテイナーゼ 8 (MMP-8) の活性化に関連し、最終的には子宮頸部の完全性が損なわれ、ヒトパピローマウイルスが基底ケラチノサイトに侵入しやすくなります。 [83]。 Nunnら[85]は、L. crispatusの優位性と比較的高レベルのD-乳酸が頸膣粘液の粘度を上昇させ、ウイルス粒子のトラップを引き起こす可能性があることを明らかにしました. 乳酸はまた、ナチュラル キラー (NK) 細胞の細胞毒性を制限し、炎症誘発性サイトカイン IL-12 の合成を減少させ、抗炎症性インターロイキン 10 (IL-10) の放出を促進します [86,87]。 乳酸とは別に、有益な微生物叢は、バクテリオシンや過酸化水素 (H2O2) などの他の抗菌ペプチドを放出することもできます [88,89]。 バクテリオシンは直接的な殺菌効果を発揮しますが、炎症性免疫応答を調節し、獲得免疫応答を媒介することもできます [1]。 それらは、細胞毒性と細胞溶解の刺激から生じる抗腫瘍特性を持っています。 ガセリシン (バクテリオシン) は、 L. gasseriだけでなく、L. crispatus や Lactobacillus reuteri,の他の菌株によって産生され、グラム陰性菌とグラム陽性菌に作用します [90,91]。 バクテリオシンとは別に、一部の細菌 (Lactobacillusなど) は、表面張力を変更するバイオサーファクタントも放出することができるため、細菌の付着、バイオフィルムの形成、および病原性嫌気性菌の過剰な増殖を妨げます [92]。 Lactobacillus上皮アドヘシン (LEA) は、 L. crispatusによって産生され、線毛を介した G. vaginalis の接着を防ぎます [93]。 前述のバクテリオシンとバイオサーファクタントは、ウイルスの浸潤を妨害することも実証されています [94]。 さらに、バクテリオシンと界面活性成分の両方が、腫瘍原性物質の合成を抑制する可能性がある [95]。 H2O2 を生成できる細菌の膣レベルが低下している女性では、細菌性膣炎の発生率が高いことが報告されている [96]。 さまざまな抗菌ペプチド (AMP) の子宮腔への放出は、重要な防御メカニズムをもたらし、病原体によって分泌されるタンパク質分解酵素から上皮組織を保護します [97,98]。 いくつかの研究は、低酸素症が細菌性膣炎の発症を促進する可能性があることを示唆している。そのような状態では、細菌は病原菌の増殖を阻害するのに十分な量の H2O2 を生成できないからである [99,100]。 共生細菌と子宮内膜上皮細胞との相互作用は、病原体に対する抗菌バリアを形成することがわかった[101]。 膣内のLactobacillus の存在は、上皮組織への病原性細菌の付着に対する保護と関連しています。 これらのバクテリアは、領土と栄養素を求めて病原性微生物と競合します[102]。 膣上皮細胞 (VEC) を占めるLactobacillus は、侵襲性病原菌の凝集を防ぎ、悪性腫瘍の発生を妨げることがわかっている [103,104]。 Lactobacillus は、リン酸化多糖類、エキソ多糖類、およびペプチドグリカンの分泌を介して悪性腫瘍の増殖を妨げることが実証されています [87,105]。 さらに、これらの細菌は、マクロファージによる一酸化窒素(NO)の産生を刺激し、がん細胞のエネルギー代謝を損なう可能性がある [106]。 共生細菌は、子宮内膜細胞による中性で安定した粘液の産生を刺激し、密着結合を維持します [65,107]。 無傷の上皮バリアは、日和見微生物の侵入と定着に対する保護に不可欠です。 さらに、共生細菌は細胞レベルで免疫応答を変更することができる[101]。 研究では、Lactobacillus が胸腺由来細胞 (T 細胞) の増殖と分化を促進し、B 細胞の免疫学的認識と増殖を改善することが実証されています [108,109]。 Lactobacillusの付着と栄養素の吸収は、補体系を誘発し、その後微生物の増殖を調節することが実証されている[110]。 |
| Motevaseli et al [111] は、膣の乳酸菌 (L. gasseri およびL. crispatus) が子宮頸部腫瘍細胞に細胞毒性の影響を与える可能性があることを実証しましたが、正常な細胞は影響を受けませんでした。 さらに、彼らは、この効果が乳酸やpHとは無関係であることを観察しました。 研究により、Lactobacillusとその亜属およびその上清の抗転移性および抗増殖性が実証されています [87]。 ヒトパピローマウイルスがん遺伝子の調節により、Lactobacillus は子宮頸がん細胞の生存率を制限することが示されました。 別の研究は、 L. crispatusが他の細菌の共コロニー形成およびCST IVへの移行に対して非常に耐性があることを示唆している[46]。 これらの細菌は、他の種と共存することはめったにありません。 さらに、これらの細菌を持つ女性は膣の pH が最も低く、細菌性STI、ヒトパピローマウイルス、単純ヘルペス ウイルス 2 (HSV-2)、または ヒトパピローマウイルス による感染の影響を受けにくい [31,112]。 細菌性膣炎は ヒトパピローマウイルスおよび単純ヘルペス ウイルス 2の排出を促進するため、腸内毒素症(dysbiosis)とLactobacillus の量の減少が、感染の持続を誘発し、扁平上皮内病変の発生につながる環境の形成をサポートする可能性があることが示唆されている [113] . 女性の下部生殖器におけるLactobacillus の基本的な有益な効果を図 1 に示します。 |
| |
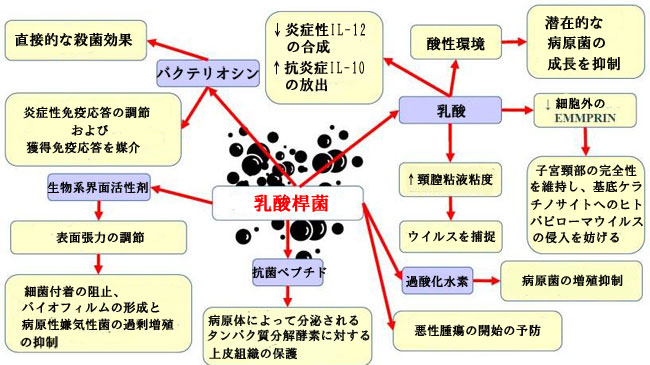 |
| 図 1 女性生殖器における乳酸菌の基本的な有益なメカニズム |
| 略語: EMMPRIN - 細胞外マトリックスメタロプロテイナーゼインデューサー。 IL-10 および -12—インターロイキン 10 および -12。 |
| |
|
| 5. 子宮頸がんの発症に対するヒトパピローマウイルスと膣微生物叢の影響 |
| 膣内微生物叢のバランスは動的です。 女性は寛大な膣内細菌異常(dysbacteriosis)から回復することができます。 ただし、この状態が続くと、婦人科がんの発生を刺激する可能性があります [9]。 Lactobacillus の量および/または活性の低下は、Atopobium vaginae, Gardnerella, Fusobacterium spp.およびSneathia,を含む嫌気性細菌の過増殖、ならびに発がんリスクの増大と関連しています [35,114,115]。 植民地化に続いて、嫌気性細菌は、このバリアを損なう代謝産物と酵素を生成し、ヒトパピローマウイルスの侵入を可能にします。 子宮頸部上皮バリア機能の保存は、基底ケラチノサイトへのヒトパピローマウイルスの侵入を妨げる [116]。 腸内毒素症は、ヒトパピローマウイルス感染の発生 (ヒトパピローマウイルス定着、クリアランス、持続性、および宿主免疫応答) をサポートすることが示されているため、子宮頸がんのリスクが増加します [42]。 マイクロバイオームの調節不全、感染、および炎症の存在の組み合わせが、子宮頸がんの発症を成功させるために必要であると思われます。 腸内毒素症の存在は、微好気性細菌に対する嫌気性細菌の比率の増加の結果として、子宮頸部と膣の微生物代謝産物の変化につながります [117]。 乳酸の代わりに、新しい優勢細菌がアミンを生成する[118,119]。 研究により、子宮頸がんの発症における腸内毒素症の重要性が確認されました。 1つは、子宮頸がんと診断された女性の4分の3近くが膣のマイクロバイオームを乱していたことを示した[120]。 腸内毒素症の女性は、そうでない女性と比較して、膣の炎症誘発性サイトカインのレベルが高いことが報告されている[121]。 慢性炎症の存在は、体のさまざまな部分での発がんに関連している [122]。 Caselli ら [123] は、前がん病変と子宮頸がんの患者では、炎症誘発性サイトカインのレベルが上昇していることを示しました。 子宮頸部上皮内腫瘍(CIN)の女性は、健康な個人と比較して、膣内のIL-1α、IL-1β、IL-6、IL-8、およびTNF-αのレベルの上昇を示しました。 核因子カッパ B (NF-κB) は、ヒトパピローマウイルス感染時に重要であると思われます。 このウイルスは、免疫系が自由に複製する抑制効果を無効にし、持続感染の状態を促進することが明らかになった [124]。 しかし、高悪性度上皮内腫瘍および子宮頸がんへの転換には、増殖、VEGF依存性血管新生、転移、および細胞不死に関与する遺伝子の発現のためにNF-κBの再活性化が必要である[124]。 Bifidobacterium longum, Lactobacillus johnsonii, Lactobacillus plantarum, Lactobacillus fermentum, およびLactobacillus delbrueckii,などのプロバイオティクスは、さまざまなシグナル伝達経路(NF-κBを含む)を阻害し、炎症を軽減できることが研究で示されている[125,126]。 NF-κB とは別に、シグナルトランスデューサーおよび転写活性化因子 3 (STAT3) も子宮頸がんの発生、特に前がん状態の子宮頸部病変のがんへの変換に関与している可能性がある [127,128,129]。 |
| 腸内毒素症は、酸化ストレスの増強とも関連しており、DNA の損傷を引き起こします。 酸化ストレスは、炎症誘発性サイトカインとともに、がんの発症または進行に適した環境の形成を促進する [130]。 腸内毒素症は、主要な膣上皮細胞骨格タンパク質の機能と構造を損ない、ヒトパピローマウイルスの侵入を促進することがわかっています。 最近の研究では、CST III および IV と、ヒトパピローマウイルス感染の存在およびその後の前浸潤性子宮頸部疾患の発症との間の関連性に関する証拠が提供されている [131,132,133]。 低悪性度または高悪性度の扁平上皮内病変および浸潤性子宮頸がん (ICC) を有する女性の研究により、疾患の発症および進行における微生物の不均衡の役割が確認されました。 子宮頸部上皮内腫瘍の女性では、疾患の重症度は、膣内微生物叢の多様性の増加とLactobacillus spp.の相対量の減少と相関していました。 [133]。 さらに、CST IVの発生率は、健康な対照と比較して、子宮頸部上皮内腫瘍および子宮頸がんの女性で高かった。 さらに、閉経前の女性と ヒトパピローマウイルス不一致の双子から収集された膣微生物叢の研究では、ヒトパピローマウイルス陰性の女性と比較して、ヒトパピローマウイルス陽性の女性では微生物の多様性が著しく増加しているが、Lactobacillus の量が少ないことが示された [131]。 Sneathia spp.を含むFusobacterium の濃縮は、ヒトパピローマウイルス感染に関連する可能性のある微生物学的マーカーであることが示唆されました。 研究によると、Fusobacterium spp.に属するSneathia spp.の豊富さは、扁平上皮内病変および子宮頸がんとも関連していることが示されている [7,131,133]。 これらの種は、WNTシグナル伝達経路を介して細胞の増殖、移動、および生存を調節する毒性因子FadAを産生することができる[134]。 これらの種は、WNTシグナル伝達経路を介して細胞の増殖、移動、および生存を調節する毒性因子FadAを産生することができる[134]。 さらに、扁平上皮内病変または子宮頸がんのいずれかを有するメキシコ人女性の研究では、Sneathia spp. と Fusobacterium spp.の多様性と相対レベルの増加が、より高い疾患重症度と関連していました [7]。 高レベルのAnaerococcus tetradius, Sneathia sanguinegens, および Peptostreptococcus anaerobius.の場合にも、同様の効果が観察されました。 これらの細菌の豊富さは、高グレードの子宮頸部上皮内腫瘍で発見された [133]。 別の研究では、CST IVの発生率は低悪性度の扁平上皮内病変(LSIL)で2倍になり、高度の扁平上皮内病変(HSIL)および浸潤癌の症例ではさらに高いことがわかった[133]。 頸膣微生物叢の障害は、膣の酸性度、サイトカインの放出、免疫抑制因子、局所免疫抑制、および ヒトパピローマウイルスの持続性を変化させることにより、子宮頸がんの発症を助長します [45]。 多くの研究で、膣内微生物叢のプロファイルが局所免疫に影響を与え、ヒトパピローマウイルスクリアランスと子宮頸がんの発症を予防または促進できることが示されている [9,135]。 Audirac-Chalifour ら [7] は、Fusobacterium spp.の相対量が多い女性で IL-4 および TGF-1β mRNA のレベルが上昇することを示しました。 同様に、韓国の子宮頸部上皮内腫瘍の女性では、L. crispatus を L. iners, G. vaginalis, および Anaerococcus vaginaeに置き換えると、子宮頸部上皮内腫瘍発症のリスクが最も高い組み合わせであることがわかった [43]。 |
| 腸内毒素症は、酸化ストレスの増強とも関連しており、DNA の損傷を引き起こします。 酸化ストレスは、炎症誘発性サイトカインとともに、がんの発症または進行に適した環境の形成を促進する [130]。 腸内毒素症は、主要な膣上皮細胞骨格タンパク質の機能と構造を損ない、ヒトパピローマウイルスの侵入を促進することがわかっています。 最近の研究では、CST III および IV と、ヒトパピローマウイルス感染の存在およびその後の前浸潤性子宮頸部疾患の発症との間の関連性に関する証拠が提供されている [131,132,133]。 低悪性度または高悪性度の扁平上皮内病変および浸潤性子宮頸がん (ICC) を有する女性の研究により、疾患の発症および進行における微生物の不均衡の役割が確認されました。 子宮頸部上皮内腫瘍の女性では、疾患の重症度は、膣内微生物叢の多様性の増加とLactobacillus spp.の相対量の減少と相関していました。 [133]。 さらに、CST IVの発生率は、健康な対照と比較して、子宮頸部上皮内腫瘍および子宮頸がんの女性で高かった。 さらに、閉経前の女性と ヒトパピローマウイルス不一致の双子から収集された膣微生物叢の研究では、ヒトパピローマウイルス陰性の女性と比較して、ヒトパピローマウイルス陽性の女性では微生物の多様性が著しく増加しているが、Lactobacillus の量が少ないことが示された [131]。 Sneathia spp.を含むFusobacterium の濃縮は、ヒトパピローマウイルス感染に関連する可能性のある微生物学的マーカーであることが示唆されました。 研究によると、Fusobacterium spp.に属するSneathia spp.の豊富さは、扁平上皮内病変および子宮頸がんとも関連していることが示されている [7,131,133]。 これらの種は、WNTシグナル伝達経路を介して細胞の増殖、移動、および生存を調節する毒性因子FadAを産生することができる[134]。 これらの種は、WNTシグナル伝達経路を介して細胞の増殖、移動、および生存を調節する毒性因子FadAを産生することができる[134]。 さらに、扁平上皮内病変または子宮頸がんのいずれかを有するメキシコ人女性の研究では、Sneathia spp. と Fusobacterium spp.の多様性と相対レベルの増加が、より高い疾患重症度と関連していました [7]。 高レベルのAnaerococcus tetradius, Sneathia sanguinegens, および Peptostreptococcus anaerobius.の場合にも、同様の効果が観察されました。 これらの細菌の豊富さは、高グレードの子宮頸部上皮内腫瘍で発見された [133]。 別の研究では、CST IVの発生率は低悪性度の扁平上皮内病変(LSIL)で2倍になり、高度の扁平上皮内病変(HSIL)および浸潤癌の症例ではさらに高いことがわかった[133]。 頸膣微生物叢の障害は、膣の酸性度、サイトカインの放出、免疫抑制因子、局所免疫抑制、および ヒトパピローマウイルスの持続性を変化させることにより、子宮頸がんの発症を助長します [45]。 多くの研究で、膣内微生物叢のプロファイルが局所免疫に影響を与え、ヒトパピローマウイルスクリアランスと子宮頸がんの発症を予防または促進できることが示されている [9,135]。 Audirac-Chalifour ら [7] は、Fusobacterium spp.の相対量が多い女性で IL-4 および TGF-1β mRNA のレベルが上昇することを示しました。 同様に、韓国の子宮頸部上皮内腫瘍の女性では、L. crispatus を L. iners, G. vaginalis, および Anaerococcus vaginaeに置き換えると、子宮頸部上皮内腫瘍発症のリスクが最も高い組み合わせであることがわかった [43]。 |
| G. vaginalisは思春期の膣に比較的豊富に存在し、思春期にヒトパピローマウイルス感染に対する感受性が高まるため、これらの細菌が観察されたより大きな脆弱性に関与している可能性があることが示唆された [56,139]。 L. inersによって提供される保護の低下は、それが抗菌性および抗ウイルス性の H2O2 をほとんど生成しないという事実と関連している可能性がある [140]。 さらに、更年期障害は、Lactobacillus種の割合が減少し、微生物叢の多様性が高まるため、ヒトパピローマウイルス感染の一因となるようです。 次に、32 人の性的に活発な閉経前の女性のコホートの縦断的研究の結果に基づいて、Brotman ら [35] は、CST II における L. gasseriの優位性が急性 ヒトパピローマウイルス感染のクリアランス率を高める可能性があることを示唆しました。 クリアランスは、ヒトパピローマウイルス陽性状態から陰性状態への移行として定義されました。 したがって、大量の L. gasseriが子宮頸部の健康を維持するのに役立つ可能性があるようです。 |
| 腫瘍の発生は、TLR 2、4、および 5 のより強力でより細胞質での発現を含む多くのメカニズムに関連している [141]。 腫瘍細胞の増殖と子宮頸がんの発生は、IL-6、IL-8、IL-1βなどの炎症性サイトカインによって刺激されることがわかった[142,143]。 さらに、いくつかのシグナル伝達経路の異常な活性化は、子宮頸がんの発生を引き起こします。 たとえば、ヤヌス キナーゼ (JAK)/STAT 経路の活性化は、免疫逃避に寄与します。 STAT3 は、免疫恒常性の調節に関与する抑制性サイトカイン (TGF-β、IL-6、および IL-10) の発現を高め、調節性 T 細胞の凝集を刺激し、樹状細胞の成熟を妨げ、腫瘍発生のための免疫抑制性微小環境を提供する[144]。 転写因子の発現は、ヒトパピローマウイルス関連の腫瘍性タンパク質 (E6/E7) によっても増加する可能性がある [145]。 NF-κB の E6/E7 腫瘍性タンパク質による調節不全は、異常な細胞増殖と分化、炎症反応、免疫逃避、血管新生、組織浸潤、および転移を刺激することがわかった [146]。 いくつかの研究では、微生物によって引き起こされる炎症誘発性腫瘍の原因となる要因として、酸化ストレスと硝化ストレスが指摘されている [118,147]。 酸化ストレスは、免疫細胞の機能を制限することがわかっています。 硝化ストレスは、生体アミンとニトロソアミンのより高い産生と、宿主防御システムに対するより大きな病原体耐性と関連している[118]。 さらに、生体アミンは、細菌のバイオフィルムの形成を促進する可能性があります。 大量のLactobacillus は、アミン産生細菌のコロニー形成を防ぎ、子宮頸がん細胞に細胞毒性効果を及ぼすことが実証されています[45]。 |
| Zhang ら [148] は、ヒトパピローマウイルス16 E7 が miR-27b をアップレギュレートして、子宮頸がんの増殖と浸潤を促進することを実証しました。 さらに、高リスクヒトパピローマウイルス腫瘍性タンパク質 (E6/E7) は、プログラム細胞死-1/プログラム細胞死-リガンド 1 (PD-1/PD-L1) 軸を刺激するため、がんの進行が促進されます。 PD-1/PD-L1経路を標的とするチェックポイント遮断は、転移性子宮頸がんであっても、がんの発生を妨げ、生存率を改善することがわかっている[149]。 子宮頸がんの発生に対する腸内毒素症とヒトパピローマウイルス感染の影響を示す臨床研究の要約結果を表 1 に示します。 |
| |
| 表1.子宮頸がんの発生に対する腸内細菌叢と HPV 感染の影響を示す研究の結果 |
| 研究の種類 |
調査対象人口 |
主な結果 |
参照 |
| オープンな単一施設研究 |
子宮頸がん(FIGO I 期)が確定している 38 ~ 55 歳の女性 32 人 |
- 膣微生物叢の障害は、FIGO I 期の子宮頸がん患者の 71% で発生しました。 |
[ 120 ] |
| 志向の観察、前向き、コホート研究 |
CIN2/CIN3 と診断された 85 人の女性、LEEP の候補 |
- CIN2Lactobacillusspp. が優勢なマイクロバイオームですが、嫌気性グラム陰性 BV 関連細菌 (特にA. vaginae、G. vaginalis、およびUreaplasma parvum ) の存在が高く、Candida albicans、Finegoldia magna、Peptoniphilus asaccharolyticusなどのあまり広まっていない微生物が存在します。、P. anaerobius、Prevotella bivia、およびStreptococciが観察されました。 |
[ 123 ] |
|
|
- CIN3L. inersを除く乳酸菌の減少、およびA. vaginae、G. vaginalis、およびU. parvumの高い有病率、ならびにAerococcus christensenii、Anaerococcus prevotii、Leptotrichia amnionii、M. hominis、Parvimonas micra、Peptoniphilus asaccharolyticus、Porphyromonas asaccharolitica、P. bivia、Prevotella buccalis、およびS. sanguinegens。 |
|
|
|
- IL1α、IL1β、IL6、IL8、および TNFα を含む CIN 患者の膣環境における炎症誘発性サイトカインの高濃度。 |
|
| |
|
- hrHPV 関連の CIN 病変の外科的除去は、それ自体がマイクロバイオームの再調節を引き起こしました。 |
|
| 子宮頸がん細胞株 C33a (HPV-)、SiHa および CaSki (HPV16+)、HeLa (HPV18+) 細胞の in vitro 研究 |
120 の新鮮な子宮頸部組織生検 (70 の悪性、30 の前悪性、および 20 の正常な (対照) 子宮頸部組織) |
- 異常に発現し、構成的に活性な STAT3 は、子宮頸がん細胞株と子宮頸部前がんおよびがん病変の両方で発見されました。 |
[ 129 ] |
|
|
- STAT3 の発現増加は、転写レベルで調節されていました。 |
|
|
|
- STAT3 の二量体化、核輸送、DNA 結合およびトランス活性化の調節に関与する Tyr705 および Ser727 でのリン酸化の同時上昇。子宮頸部の前がん病変およびがん病変に存在する二重リン酸化 STAT3 は、核に局在し、機能的な DNA 結合活性を持っていることがわかりました。 |
|
| 前向き研究 |
Healthy Twin Study に参加した 23 人の HPV 陽性女性と 45 人の HPV 陰性女性 |
- Lactobacillusspp.のパーセンテージ。HPV感染群ではかなり減少しました。 |
[ 131 ] |
| |
|
- HPV 陰性グループと比較して、HPV 陽性グループの膣内細菌叢の多様性が高い。 |
|
| |
|
- HPV 感染は、Prevotella、Sneathia、Dialister、 Bacillus などのさまざまな膣微生物叢の存在量と強く相関していました。 |
|
| |
|
-スニーシア種 高リスク HPV 感染の微生物学的マーカーでした。 |
|
| |
|
- HPV 陽性の閉経前女性の 17% が CIN (子宮頸がんの潜在的前駆体) を持っていました。 |
|
| 前向きコホート研究 |
169 人の女性: 健康 (n = 20)、低悪性度の扁平上皮内病変 (LSIL) (n = 52)、高悪性度の扁平上皮内病変 (HSIL) (n = 92)、および ICC (n = 5)。 |
- LSIL の女性における CST IV 膣マイクロバイオームの発生率が 2 倍に増加。HSIL の女性が 3 倍に増加。コントロールと比較して、浸潤がんの女性は 4 倍増加。 |
[ 133 ] |
| |
|
- HSIL マーカーP. anaerobiusおよびA. tetradiusの存在。 |
|
| |
|
- 特定の膣マイクロバイオーム CST の存在と優位性は、CIN と子宮頸がんの病因に関与している可能性があります。 |
|
| 横断研究 |
32 例: 非子宮頸部病変 (NCL: n = 10 HPV 陰性; n = 10 HPV 陽性)、SIL (n = 4 HPV 陽性)、および CC (n = 8 HPV 陽性) |
- 子宮頸部マイクロバイオームは、子宮頸がんの自然史のすべての段階で著しく異なります。 |
[ 7 ] |
| |
|
- CST VIII における IL-4 および TGF-β1 mRNA の子宮頸部レベルの中央値が高く、Fusobacteriumspp が優勢です。 |
|
| |
|
-Sneathiaspp.、Megasphaera elsdenii、およびS. satellesは、SIL ケースで最も代表的でした。 |
|
| システマティック レビューとネットワーク メタ分析 |
含まれている11の研究の分析 |
- 非乳酸菌種またはL. inersが優勢な膣内微生物叢は、L. Crispatusと比較して、有病率の HPV の 3 ~ 5 倍、hrHPV および異形成 / 子宮頸がんの確率が 2 ~ 3 倍高いことに関連していました。 |
[ 135 ] |
| 前向き研究 |
20~50歳の女性から採取した50個の頸膣スワブ検体(40個がhrHPV陽性、10個がhrHPV陰性) |
-子宮頸部疾患のある女性では、乳酸桿菌種の存在量が減少しました。CINおよび子宮頸がんの女性では、 L. Crispatusの量が大幅に減少しました。 |
[ 137 ] |
| |
|
- 嫌気性細菌の存在量が著しく増加: CIN および子宮頸がんの女性におけるG. vaginalis、P. anaerobius、およびPorphyromonas ueonis 。 |
|
| |
|
-G. vaginalisの存在は、CIN 2 または 3 および子宮頸がんを発症するリスクが高いことに関連しています。 |
|
| インビトロ研究 |
HPV16 陽性の子宮頸がん患者 6 例、HPV16 陽性のヒト子宮頸がん細胞株 CaSki および SiHa、HPV 陰性の子宮頸がん細胞株 C33A から得られた臨床サンプル |
- 隣接する正常組織と比較して、子宮頸がん組織における miR-27b 発現レベルの増加。 |
[ 148 ] |
| |
|
- miR-27b が子宮頸がん細胞株の増殖と浸潤を促進し、miR-27b が子宮頸がんのがん遺伝子として機能することが確認されました。 |
|
| |
|
- PPARγが促進する子宮頸がん細胞の増殖と浸潤の阻害、どちらも子宮頸がんにおけるPPARγの抗腫瘍的役割。 |
|
| |
|
- miR-27b は HPV16 E7 によって積極的に制御されました。 |
|
| |
|
・miR-27bはPPARγの発現を抑制した。 |
|
| |
|
- HPV16 E7 の過剰発現は、miR-27b の存在に応じて PPARγ の発現を抑制しました。HPV16 E7 は、miR-27b の刺激により PPARγ の発現を抑制することができます。 |
|
|
| 略語:HPV:ヒトパピローマウイルス、CIN: 子宮頸部上皮内腫瘍 |
| |
|
| 6. 子宮内膜がん |
| 子宮内膜がん (EC) は、特に先進国または高所得国において、女性で 5 番目に多いがんです [153,154,155]。 この主に閉経後の腫瘍は、子宮の内側上皮内膜の子宮内膜に由来する[156]。 子宮内膜様タイプの子宮内膜がん (特にエストロゲン依存性を伴う子宮内膜腺がん) は、約 80% の症例で発生する最も頻度の高い型ですが、非子宮内膜タイプ (すなわち、明細胞子宮内膜がん、漿液性子宮内膜がん、がん肉腫、およびその他のタイプを含む) )ははるかにまれです[157]。 この病気の原因は完全には解明されていません。 研究によると、好気性解糖障害やマイクロサテライト不安定性の存在を含む遺伝学によって説明できる子宮内膜がん症例はわずか20%であることが示されている[158,159]。 さらに、糖尿病、肥満、炎症、閉経状態、性腺ホルモンなどの環境要因が子宮内膜がんの発生に関与していることが示唆されている [156]。 増加する証拠は、子宮に存在する微生物叢が健康と病気におけるこの器官の機能を変更できることを示唆している[65,160]。 実際、子宮内細菌叢の「健康な」構成の破壊は、不妊症、子宮内膜炎、子宮内膜症、子宮内膜ポリープ、機能不全の月経出血、および子宮内膜がんと関連していることが判明した[161,162,163]。 Li ら [164] は、子宮内膜微生物叢の多様性の減少が、この疾患の重症度の増加と関連していることを示唆した。 マイクロバイオームのα多様性の減少は、子宮内膜がんの発達と関連していることがわかった[156]。 Li ら [164] は、子宮内膜 Prevotellaの存在量の増加と、血清 D ダイマーおよびフィブリン分解産物の増加との間に正の相関関係があることを示しました。 この所見は、腫瘍量が多いことを示唆している可能性があります。 別の研究では、Micrococcusの存在量が子宮内膜のインターロイキン 6 およびインターロイキン 17 メッセンジャー RNA レベルと相関し、子宮内膜がん発生における微生物叢と炎症のクロストークの関与を示していることがわかった [114]。 炎症は、子宮内膜がんの発生を促進する重要な要因であると思われる [165]。 浸潤性炎症細胞と局所組織ががんの発生に関与していることが示唆されている[150]。 骨盤の炎症は、子宮内膜がんの発生を加速することが示唆された [166]。 全国的な後ろ向きコホート研究の結果により、子宮内膜がんの発生における骨盤内炎症性疾患の役割が確認された[166]。 炎症は子宮内膜リモデリングサイクルに関与しており、放出されたサイトカインは子宮内膜粘膜に影響を与えて変化させる[167]。 がんリスク上昇の慢性炎症関連メカニズムには、DNA損傷、細胞増殖、および血管新生につながるフリーラジカル形成の促進が関与している可能性がある[168]。 利用可能なデータは、マイクロバイオームが炎症の最初の段階に関与し、免疫病理学的変化を引き起こし、最終的に癌の発症につながる可能性があることを示している[169,170]。 子宮内細菌叢は、転写因子の調節やその他のエピジェネティックおよびゲノム修飾を介して子宮内膜がんの発生を促進し、子宮上皮のゲノム安定性に影響を与える可能性があるようです。 このような修飾は、アポトーシスを妨げ、増殖を促進する可能性があります。 一部の微生物叢は、遺伝子毒素を放出し、宿主の DNA に損傷を与え、細胞の発がんを引き起こすこともできます。 子宮内細菌叢の乱れと子宮内膜がんとの関係の背後にある別の可能性のあるメカニズムには、腫瘍促進代謝産物を伴う細菌毒素の産生が含まれ、宿主細胞による慢性細菌炎症およびサイトカイン放出をもたらす[150]。 炎症誘発性サイトカインと抗菌ペプチドの放出は、炎症反応の発生を刺激します。 |
| 子宮内膜がんは、エストロゲンレベルの上昇やプロゲステロンとエストロゲン産生の不均衡など、ホルモン機能障害に関連する増殖性疾患である [171]。 このような状態は、制御されていないプロファイリングと肥大、およびその後の子宮内膜がんの発生に有利に働く[172,173]。 微生物叢の組成の変化は、ステロイド分子を強力なアンドロゲンに変換する可能性があり、子宮内膜がん患者でアンドロゲンと 11-オキシアンドロゲンが形成される可能性がある [156]。 次に、Chen et al [167] は、17 の細菌種の存在量が正常な子宮内膜と子宮内膜がんの間で異なることを実証しただけでなく、 活性化された子宮内膜細菌は、子宮内膜がん代謝プロセス (N-アセチル-β-グルコサミニルおよび 6-スルホ-シアリル ルイス x エピトープに関連する) および腫瘍移動に関与していた。 図 2 は、子宮内膜/子宮頸がんの発症に関与するメカニズムを示しています。 |
| |
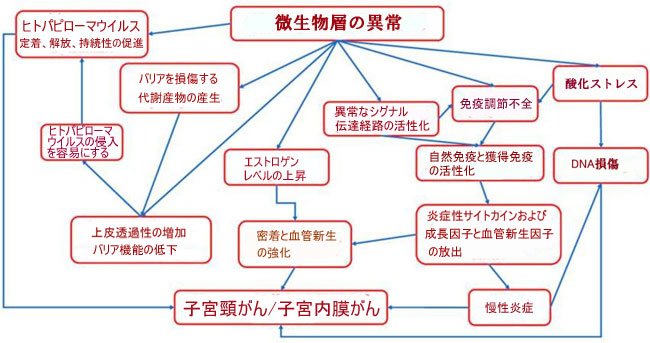 |
| 図 2 子宮内膜がん/子宮頸がんの発症に関与するメカニズム |
| |
| Walther-António ら [163] は、良性の子宮状態、子宮内膜増殖症、および子宮内膜がんの女性の生殖管に存在するマイクロバイオームのハイスループット比較分析を実施しました。 彼らは、評価された臓器(膣/子宮頸部、子宮、卵管、および卵巣)間のマイクロバイオームの相関関係を観察しました。 Prevotella と Lactobacillusは膣と子宮頸部に生息する優勢な種であり、Shigella とBarnesiellaは子宮で最も豊富でした。 彼らの研究では、マイクロバイオームの構成により、良性の子宮状態と子宮内膜増殖症との区別が可能になりました。 この発見は、マイクロバイオームが細胞形質転換の初期段階で役割を果たすことができることを示唆している可能性があります。 子宮内膜がんと過形成または子宮内膜がんと良性状態の患者のグループの間に有意差は観察されなかったため、著者らは、微生物プロファイルの一時的な乱れの後、マイクロバイオームが新しい平衡に達することを示唆した[163]。 さらに、彼らは、A. vaginae とPorphyromonas sp.の存在を明らかにしました。 低pH(> 4.5)を伴う婦人科管内では、子宮内膜がんのリスクが増加しました。 過形成の女性の子宮でこれら 2 つの細菌が発見されたことは、下部尿路には存在しないにもかかわらず、疾患の初期段階におけるそれらの役割を裏付けています。 さらに、他の研究では、細菌性膣炎、子宮内感染、および女性生殖管の他の侵襲性感染症におけるA. vaginae の関与の証拠が提供されている [174,175,176]。 細菌性膣炎の原因となるA. vaginae は、長期にわたる炎症状態を誘発し、最終的には局所的な免疫調節不全や、 Porphyromonas種による細胞内感染の促進につながることが示唆されました。 次に、Walsh ら [177] は、Porphyromonas somerae の存在が付随する子宮がんを非常に予測するものであることを明らかにしました。 別の研究では、良性子宮病変(BUL)グループと比較して、子宮内膜がんグループに Micrococcus sp.が豊富に存在することが示されており、これにはPseudoriibacter, Eubacterium, Rhodobacter, Vogesella, Bilophila, Rheinheimera,および Megamonas が豊富に含まれていた [178]。 |
| |
|
| 7.治療 |
|
| 7.1. ワクチン |
| ヒトパピローマウイルス 16 型 (HPV-16) は、浸潤性子宮頸がんの原因となる最も広範な型であると思われる [179,180,181]。 現在、ヒトパピローマウイルスを予防するためのほとんどのワクチンは、ヒトパピローマウイルス L1 由来のウイルス様粒子 (VLP) に基づいて開発されています。 これらのワクチンは、ヒトパピローマウイルス感染に対する保護を提供します。 ただし、すでに感染している患者には効果がありません[182]。 したがって、ヒトパピローマウイルス腫瘍性タンパク質に対する免疫原性を促進する有効なヒトパピローマウイルスワクチンが必要です。 さまざまな種類の治療用ワクチンが開発されているが、それらの大部分は、筋肉内または皮下経路を介した E6/E7 癌遺伝子の送達に基づいており、全身性免疫応答を引き起こす [183]。 皮下および筋肉内ワクチンは全身細胞性免疫を増強できるが、局所粘膜免疫は増強できないことが観察されている[184,185]。 乳酸菌(LAB)ベースのワクチンの有効性は、注射から粘膜免疫(鼻腔内、膣内、および経口)に切り替えることでも増加する [186]。 最後に、粘膜免疫応答の大きさは、乳酸菌発現 E6/E7 抗原の生存可能なコロニーの数に依存する [185]。 性器粘膜はヒトパピローマウイルス-16 の侵入の重要な場所であるため、粘膜投与ワクチンが開発されています。 現在の知識によると、細菌ワクチンの使用は、粘膜表面へのワクチン抗原の送達に最適なオプションであると思われます。 しかし、小児、高齢者、および免疫抑制患者では、生きた弱毒化細菌性病原体の送達がリスクをもたらす可能性がある [187]。 |
| 乳酸菌はライブ配信の手段として注目を集めています。 乳酸菌は、抗原の送達に使用でき、IL-12およびIL-10の発現をアップレギュレートし、未熟なヒト骨髄樹状細胞を活性化するため、ヒトパピローマウイルスワクチンの潜在的な成分として注目を集めています[188,189]。 Lactococcus lactis における ナイシン制御遺伝子発現 (NICE) システムは、粘膜表面での抗原の送達に現在利用できる最良の選択であるように思われる [179]。 |
| これらのタイプのワクチンは、E6 および E7 発がん性タンパク質に対する強力な体液性および粘膜免疫応答を引き起こすことが実証されています [190,191]。 外因性標的タンパク質(例えば、ヒトパピローマウイルス関連タンパク質)がLactobacillus のS層シグナルペプチドに容易に結合できることが研究により示されているため、抗腫瘍効果を発揮する組換えタンパク質ワクチンの開発が可能になる[87]。 目的の抗原を粘膜表面に送達するように改変された非病原性および非侵襲性のLactococcus spp.の適用は、有益な治療効果を誘発することが示唆された[192,193,194]。 このようなワクチンは、局所免疫応答と全身免疫応答の両方を引き起こすことがわかっています。 ただし、1 つの粘膜部位内の刺激は、通常、遠位の粘膜部位よりもその部位でより顕著な反応を引き起こします [179]。 現在、ヒトパピローマウイルス-16 L1、L2、E2、E6、および E7 抗原を標的とする組換え乳酸菌を含む粘膜ワクチンがいくつかある [179]。 生乳酸菌(E7抗原およびIL-12によって誘発される全身および粘膜免疫応答を発現する)による鼻腔内免疫は、マウスをヒトパピローマウイルス-16誘発腫瘍から保護した[195]。 さらに、Lactobacillus の経口摂取は有益であることがわかっており、副作用を引き起こすことはめったにありません [87]。 動物研究の結果は、ヒトパピローマウイルス-16 L1抗原を保有するL. lactisを投与されたマウスの経口免疫が、高レベルの粘膜IgA抗体の出現と関連していることを示した[196]。 Lactobacillus caseiは、細胞内ウイルス様粒子(VLP)に自己集合する組換えL1タンパク質の合成が可能であることが示唆された[197]。 別の研究では、L. lactisによって産生されるさまざまな形態のヒトパピローマウイルス -16 L1 タンパク質の混合物を介して全身および粘膜免疫応答を誘発する有効性についての証拠が提供された [198]。 さらに、ヒトパピローマウイルス-16 の L2 マイナーキャプシドタンパク質の N 末端領域には、免疫増強特性があることが示されている [199]。 固定型のヒトパピローマウイルス-16 L2 タンパク質を含む L. casei による経口免疫は、L2 特異的血清 IgG と粘膜 IgA 抗体の両方を引き起こすことが報告されている [200]。 乳酸菌ベースのヒトパピローマウイルスワクチンは、前臨床試験で ヒトパピローマウイルス E6/E7 関連の腫瘍性病変に抗腫瘍効果を及ぼすことがわかっている [179]。 組換え乳酸菌ワクチンによる経口ワクチン接種による子宮頸部および胃腸管内の強い粘膜免疫応答の誘発には、ガラクトース-1-リン酸ウリジルトランスフェラーゼ遺伝子 (GALT) およびインテグリン α4β7+ メモリー/エフェクター細胞の刺激が必要です。 このような効果は、ヒトパピローマウイルス-16 E7 抗原とともに L. casei を摂取した後に観察された [184]。 さらに、L. lactis 産生ヒトパピローマウイルス-16 E6/E7 腫瘍性タンパク質の経口投与は、膣リンパ球における E6 および E7 特異的 IL-2 および IFN-γ 陽性 CD4+ および CD8+ T 細胞のおよび主要組織適合遺伝子複合体タンパク質 I (MHCI) (E6/7 特異的 CD8+ T 細胞) および II (MHCII) (E6/7 特異的 CD4+ T ヘルパー) エピトープに対する免疫応答が著しく増強される腸粘膜リンパ球量の増加と関連していた[179,201,202]。 L. casei -PgsAE6/E7 を投与されたマウスでは、免疫系への影響が腫瘍サイズの縮小と生存率の上昇につながった[203]。 致死量の腫瘍細胞株 TC-1 をワクチン接種したマウスでさえ、組換えL. lactisの投与により、対照動物と比較して抗腫瘍保護とより長い生存率が得られた [201,202]。 しかし、L. lactisによる 1 回の免疫では、適切な量の抗原特異的抗体を誘発するのに十分ではない可能性があることが明らかになりました [196]。 健康なイラン人女性を登録した二重盲検無作為化プラセボ対照第I相臨床試験では、組換えL. lactis発現コドン最適化ヒトパピローマウイルス-16 E7がん遺伝子を含む経口ワクチンが、ヒトパピローマウイルス-16特異的血清IgGの産生および膣 IgA 抗体、ならびに膣分泌物および末梢血単核細胞における細胞傷害性 T リンパ球応答と関連していることが実証されました [190,204]。 さらに、子宮頸部上皮内腫瘍グレード 3 (CIN3) の患者を含む第 I/IIa 相臨床試験では、改変ヒトパピローマウイルス-16 E7 抗原を含むL. casei ワクチンに対する頸部リンパ球の E7 特異的細胞性免疫応答の改善が示された [191]。 |
| バイオリーダーズ法人(韓国) は、子宮頸部上皮内腫瘍の治療のためにL. casei の表面にヒトパピローマウイルス-16 E7 抗原を含む BLS-M07 経口ワクチンを開発した [179]。子宮頸部上皮内腫瘍グレード3 患者におけるその安全性と有効性を評価する臨床試験では、その使用が血清ヒトパピローマウイルス-16 E7 特異的抗体の産生を安全に増強し、その後体液性免疫を改善することが実証された [205]。 |
| しかし、いくつかの研究の結果は、粘膜および全身の免疫応答が細菌ベクターの抗原部位によって影響を受ける可能性があることを示している[179,196]。 ある研究では、粘膜免疫応答は、L. lactis MG1363 におけるヒトパピローマウイルス-16 L1 の細胞内産生の場合にのみ観察された [196]。 次に、Bermudez-Humaran et al [206] は、L. lactisにおけるヒトパピローマウイルス-16 E7 の細胞外発現の場合に、より大きな影響を報告しました。 いくつかの研究では、組換え抗原の細胞外だけでなく、細胞壁に固定された発現も、全身および膣の免疫応答を大幅に調節することが実証された[207,208,209]。 後者の形態の組換えE6および/またはE7タンパク質は、免疫応答の増加と関連していることが示唆された[201]。 |
| ポリ-ガンマ-グルタミン酸 (γ-PGA) を投与して、子宮頸がんに対する経口L. casei -E7 ベースのワクチンの抗腫瘍効果を高めることができる [210]。 ワクチン単独の使用と比較して、アデノウイルス発現カルレティキュリン-E7(Ad-CRT-E7)に加えて、組換えL. lactis発現E7による鼻腔内事前ワクチン接種後に、より大きな腫瘍抑制も観察された[211]。 乳酸菌は毒性物質を産生しないため、一般的に安全であると考えられています [212]。 動物研究と臨床試験の結果は、組換え乳酸菌の投与が重大な副作用を引き起こさないことを確認している [213,214]。 |
| 上記の調査と試行の結果を表 2 にまとめます。 |
| |
| 表2.乳酸菌 (LAB) ベースのワクチン研究 |
| ワクチン |
| 動物研究 |
| 調査対象エージェント |
投与経路 |
研究の種類 |
観察された効果 |
参照 |
| HPV16 E7 (LacE7) を発現する組換えL. casei |
粘膜(口腔) |
動物研究 |
- E7 特異的 IFN ガンマ産生細胞 (E7 1 型免疫応答を伴う T 細胞) |
[ 185 ] |
| を誘発 - 皮下または筋肉内抗原送達と比較して、T 細胞のより大きな誘導。 |
| - 粘膜の細胞傷害性細胞性免疫応答を誘発する |
| L. lactisMG1363 は、細胞内での発現または分泌のために、2 種類の HPV16 L1 をコードするプラスミドで形質転換されました。 |
オーラル |
動物研究 |
F9- HPV16 L1を分泌するL. lactisによる免疫化後の血清IgG応答。 |
[ 197 ] |
| L17 HPV16 L1 を発現するが,HPV を分泌する G10 による経口免疫後の膣 IgA 免疫応答 |
| - 免疫頻度によって影響を受ける HPV16 L1 特異的粘膜免疫応答。 |
| 細菌で産生された HPV16 由来の残基 11 ~ 200 を含む N 末端 L2 ポリペプチド (HPV16 L2 11–200) |
ワクチン |
動物研究 |
- CRPV および ROPV による皮膚および粘膜攻撃に対するウサギの効果的な保護 |
[ 200 ] |
| - 広く交差中和する血清抗体の生成 - 第 2 世代の予防 HPV ワクチン抗原としての L2 の可能性。 |
| L. caseiの表面にある部分的な HPV-16 L2 タンパク質 (N 末端の 1 ~ 224 アミノ酸) 。 |
粘膜(口腔) |
動物研究 |
- Balb/c マウスにおける L2 特異的血清 IgG および膣 IgG および IgA の産 |
[ 201 ] |
| 生 - マウスにおける全身および粘膜交差中和効果のトリガー |
| ヒトパピローマウイルス16型E7抗原を発現するL. lactisNZ9000 |
粘膜(口腔) |
動物研究 |
- 最高レベルの E7 特異的抗体と、多数の E7 特異的 CD4+ T ヘルパーおよび CD8+ T 細胞前駆体を誘発します。 |
[ 202 ] |
| - E7 発現腫瘍細胞株 (TC-1) によるチャレンジに対する強力な保護効果 -L. lactis |
| を含む pNZ8123-HPV16-optiE7は、in vivo で確立された腫瘍に対して強力な治療的抗腫瘍効果を示しました。- マウスにおける体液性および細胞性免疫応答の誘発 |
| L. lactisNZ9000の組換え株は、ネイティブおよびコドン最適化 E6 タンパク質 (SPusp45 分泌シグナルに融合) を発現します。 |
粘膜(口腔) |
動物研究 |
-ネイティブ E6 癌遺伝子を持つL. lactisと比較して、腫瘍増殖に対する阻害効果の向上、腫瘍サイズの進行に対する治療効果の向上、および生存率の向上 |
[ 203 ] |
| - 体液性および細胞性免疫の誘導 |
| L. caseiの表面に発現した HPV16 E7 抗原 |
粘膜(経口)ワクチン |
動物研究 |
- E7 特異的血清 IgG および粘膜 IgA 産生の増強。- コントロール ( L. casei-PgsA) 免疫化 |
[ 204 ] |
| を受けたマウスと比較して、E7 ベースのマウス腫瘍モデルにおける腫瘍サイズの縮小と生存率の増加。 |
| HPV16 E7 発現L. casei
L. casei-E7) とBacillus subtilisが分泌する γ-PGA の結合 |
粘膜(経口)ワクチン |
動物実験(TC-1マウスモデル) |
- 樹状細胞の活性化を含む自然免疫応答の増強 |
[ 211 ] |
| - TC-1 腫瘍細胞の増殖を有意に抑制し、L. casei E7 単独でワクチン接種したマウスと比較して生存率を増加させました。 |
| - ナチュラル キラー (NK) 細胞の活性化が著しく促進され、CD8+ T リンパ球の E7 特異的細胞溶解活性には影響しません。 |
| カルレティキュリン-E7 (Ad-CRT-E7) を発現するアデノウイルスと、その表面に固定された HPV-16 E7 (L1-E7) をコードするL. lactis
の組み合わせ |
L1-E7 の鼻腔内前免疫化と、Ad-CRT/E7 の単回適用 |
動物実験(マウスモデル) |
- コントロールと比較して、腫瘍抑制の約 80%。 |
[ 212 ] |
| - 治療後 300 日で 70% の生存率 (対照の 100% が 50 日までに死亡)。 |
| ・L1-E7+Ad-CRT/E7で処置したマウスの腫瘍における有意なCD8+細胞傷害性Tリンパ球浸潤。 |
| 臨床研究と治験 |
| 改変された全長 HPV16 E7 タンパク質を発現する弱毒化L. casei |
1、2、4、および 8 週目 (n = 10) または最適化されたワクチン製剤 (n = 7) での経口 (用量最適化研究中 (1、2、4、または 6 カプセル/日)) |
HPV16関連CIN3の患者 |
- 最適化された用量を投与されたほとんどの患者 (70%) は、治療の 9 週目に病理学的に CIN2 へのグレードダウンを経験しました |
[ 192 ] |
| - E7 特異的粘膜免疫が子宮頸部病変で誘発されました。 |
| NZ8123-HPV16-optiE7 ワクチンには、コドン最適化ヒトパピローマウイルス (HPV)-16 E7 癌遺伝子を発現する組換えL. lactisが含まれます |
経口ワクチンまたはプラセボ |
イランの健康なボランティア女性を対象に、用量漸増、無作為化、二重盲検、プラセボ対照の第 I 相臨床試験が実施されました。 |
- ワクチン接種は忍容性が高く、重大な副作用は報告されていません |
[ 205 ]。 |
| - 経口投与後の NZ8123-HPV16-optiE7 ワクチンに対する用量依存的な反応 |
| - この研究で達成された安全性と免疫原性プロファイルは、5 × 109 CFU/mL でのさらなる第 II 相試験を促進しますワクチン接種 |
| BLS-M07 (L. caseiの表面に発現する HPV 16 E7 抗原) |
経口投与 |
CIN 3 の患者を対象に実施された第 1/2a 相、用量漸増、安全性、有効性の予備試験 |
- 用量制限毒性なし。 |
[ 206 ] |
| 第 1 相:週 5 回、第 1、2、4、および 8 週に 500 mg、1000 mg、および 1500 mg の |
- グレード 3 または 4 の治療関連の有害事象または死亡はありません |
| 用量で。 第 2a 相:1000 mg の用量。 |
- RCI の等級付けの改善 (治療後 16 週間) |
| |
- 血清 HPV16 E7 特異的抗体産生の増加。 |
|
| |
|
| 7.2. プロバイオティクスとプレバイオティクス |
| プロバイオティクスは、宿主生物にとって有益な生きた微生物として定義されている[215,216]。 それらは、従来の食品、栄養補助食品、乳児用調製粉乳などに含まれる可能性がある [217]。 プロバイオティクスは、炎症、酸化ストレス、アポトーシス、増殖、転移など、腫瘍形成に関連するさまざまな生物学的プロセスに影響を与えることが実証されています [218,219,220]。 それらの有用性は、いくつかの病気の予防と治療に示唆されています。 プロバイオティクスとプレバイオティクス (腸内の有益な微生物の増殖を刺激する非消化性食品) はどちらも、抗病原性、抗炎症性、抗糖尿病性、免疫刺激性などの有益な特性を発揮します [221,222,223]。 しかし、一部の微生物は発がんに関与している可能性があるため、すべての微生物叢が有益であることがわかっているわけではない [216]。 Lactobacillusとその製品は、免疫学的メカニズムとがん関連経路への影響に関して、子宮頸がんの増殖を妨げる可能性があります。 Lactobacillusは、マクロファージ、T 細胞、樹状細胞 (DC)、および ナチュラルキラー細胞の抗腫瘍効果を増強します [224,225]。 それらはまた、自然免疫応答を刺激し、固形がんの低酸素ゾーン内に選択的に蓄積する可能性がある [226,227]。 Lactobacillusの上清、L. crispatus, L. jensenii, および L. gasseri は、CaSki 細胞の増殖を抑制することが実証されています [228]。 この研究では、Lactobacillus上清との細胞インキュベーション後に、S 期の数が著しく増加し、G2/M 期の細胞が減少することが示されました。 さらに、Lactobacillusの上清は、悪性腫瘍への移行に必要なサイクリンA、CDK2、および E6/E7 ヒトパピローマウイルスがん遺伝子の発現を減少させた [228,229]。 Nami ら [230] は、思春期および若い成人女性の膣分泌物から分離されたL. plantarum種のプロバイオティクスおよび抗がん特性を明らかにしました。 この株は、いくつかの病原菌に対して抗生物質感受性と抗菌作用を示しました。 さらに、ヒトがん細胞株の場合に顕著な抗がん活性を示しました。 しかし、正常なヒト臍帯静脈内皮細胞 (HUVEC) に対する目に見える細胞毒性効果は観察されなかった [230]。 別の研究では、母乳から分離されたLactobacillus株 (L. casei SR1, L. casei SR2, および Lactobacillus paracasei SR4) の同様の抗菌および抗がん特性が示されました [231]。 これらの細菌は、アポトーシス遺伝子 (カスパーゼ 3、カスパーゼ 8、カスパーゼ 9、BAD、および BAX) のアップレギュレーションと、BCL-2 のダウンレギュレーションを促進しました。 さらに、ヒトの膣に見られる L. gasseri 株(G10およびH15)は、HeLa細胞の増殖を妨げた[232]。 これらの菌株は、TNF-α の減少と IL-10 の増加を通じて、子宮頸がんに対して抗炎症効果を発揮しました。 L. rhamnosus とL. crispatusはまた、MMP2、MMP9、およびカスパーゼ 9 の発現を減少させ、転移を妨げる可能性がある [233]。 L. crispatusはE6/E7 の発現を miRNA のレベルで制限することがわかっています。 一方、 L. gasseriは E6 遺伝子のみに作用した [234]。 プロバイオティクス細菌は、進行子宮頸がん患者のシスプラチン療法などの抗腫瘍治療の効果を高めることもできる [235]。 シスプラチン治療に対する反応の改善は、Lactobacillusの投与後に細胞傷害性Tリンパ球およびナチュラルキラー細胞によって発現されるインターフェロンγ(IFN-γ)、パーフォリン1(PRF1)、およびグランザイムB(GZMB)のアップレギュレーションと関連していた[236]。 Hummelen ら [237] は、L. rhamnosus GR-1 と L. reuteri RC-14 の両方の経口投与が細菌性膣炎から保護するか、膣微生物叢における優勢な乳酸菌の量の急増によりそれを治癒することを示しました。 これらの外来種が群集構造を変化させるメカニズムには、両方の細菌によって産生されるバクテリオシン(ガッセリまたはラクトシン)の作用が関与している可能性がある [238]。 生きている乳酸菌に加えて、加熱殺菌されたL. casei YTT9018 から分離された生物学的応答修飾因子 (LC9018) も、子宮頸部がん(ステージ IIB または III) の患者グループで使用される放射線療法の効果を改善することがわかった。 . この併用療法は、放射線療法単独と比較して腫瘍サイズの大幅な縮小と関連しており、放射線療法中に患者を白血球減少症から保護するようにも見えた [239]。 さらに、LC9018を投与された患者は、放射線のみで治療された患者と比較して、より高い生存率とより長い無再発期間を示しました。 |
| プロバイオティクス細菌の抗腫瘍作用に関連する正確なメカニズムの知識はまだ限られており、さらなる研究が必要です。 多くの miRNA (miR-21、miR-29a、miR-9、miR-10a、miR-16、miR-20b、miR-106、miR-375、miR-125、および miR-34a を含む) の調節不全が、子宮頸がんの経過で報告されています[240]。 増加する証拠は、膣から分離されたLactobacillusやその他の菌株が、TLR-4、miR-21、miR200b などの調節にプラスの影響を与え、アポトーシスを刺激できることを示唆している [241]。 |
| |
|
| 8. 将来の展望と限界 |
| 微生物叢の調節不全と発がんとの関連性を理解する上での進歩にもかかわらず、根底にあるメカニズムを解明し、大規模集団の前向き研究で以前の発見を確認するには、さらなる研究が必要です. さらに、将来の研究では、膣内微生物叢を操作して子宮頸がんのリスクを低下させる戦略にも焦点を当てる必要があります。Lactobacillusワクチン投与後の子宮頸がんの発生率を評価する前向き研究が必要です。 将来の研究は、Lactobacillusが細胞の増殖と子宮頸がんを抑制する分子メカニズムの理解にも焦点を当てる必要があります. Lactobacillusは代替抗原を発現する担体として使用されるため、抗がん遺伝子またはカプセル化された抗発がん物質を発現するために使用できる可能性があります。 |
| ほとんどの研究の横断的な性質により、膣内微生物叢の組成、ヒトパピローマウイルス感染、および子宮頸部上皮内腫瘍/子宮頸がんの間の因果関係を特定する能力が制限される可能性があります。 さらに、子宮頸がんは、最初の急性ヒトパピローマウイルス感染から数年 (または数十年) にわたって発生するため、この分野の研究はより困難になります。 さらに、Lactobacillusの枯渇は、喫煙やバリア避妊なしの膣性交などのさまざまな要因に関連している可能性があるため、この分野の研究は、微生物叢プロファイルの観察された乱れが腸内毒素症によって引き起こされたことを確認するように慎重に設計する必要があります。 相互汚染の可能性があるため、サンプルの収集も研究の最終的な影響に影響を与える可能性があります。 |
| 今後の研究では、微生物叢と宿主の免疫系との相互作用に焦点を当て、ヒトパピローマウイルス感染の歴史も考慮する必要があります。 膣内微生物叢と宿主免疫系の間の相互作用に関与するメカニズムを深く理解することで、ヒトパピローマウイルスの持続性とその後の腫瘍性形質転換の説明が得られる可能性もあります。 一部の細菌株がヒトパピローマウイルスおよび子宮頸部異形成の場合に保護/病原効果を発揮できるかどうかについても確認が必要です。 最後に、高悪性度子宮頸部上皮内腫瘍の治療におけるプロバイオティクス/プレバイオティクスの治療効率を評価する必要があります。 |
| |
|
| 9. 結論 |
| 腸内細菌叢は、いくつかの病気を発症するリスクに影響を与える可能性があります。 したがって、幼児の腸内細菌叢の形成は非常に重要です。 初期の腸内微生物叢の発達は、出産方法、宿主の遺伝学、妊娠期間、および母乳に含まれる特定の食事成分など、さまざまな要因によって調節されます。 膣に生息する微生物叢は、ヒトパピローマウイルスの獲得と持続を調節するようであり、子宮頸部上皮内腫瘍の発症と進行のリスクに影響を与えます。 私たちの体に生息する細菌、特にビフィズス菌は、病原体によるコロニー形成から人間を保護する乳酸を生成するために、人体で利用可能なグリカン成分を使用することに特に適応していることがわかりました. これは、宿主と微生物相の共生を示しています。 多くの研究により、微生物の多様性の変化とマイクロバイオーム組成の乱れがさまざまな疾患の発症に関連している可能性があることが実証されています。 ただし、この現象の根底にある正確なメカニズムは完全には理解されていません。 「健康な」微生物叢組成の特定は、ヒトパピローマウイルス感染を予防し、感染した女性のクリアランスを刺激し、子宮頸部異形成のリスクを大幅に軽減するのに役立つ新しい治療薬 (プロバイオティクス) を開発する機会を提供する可能性があります。 プロバイオティクスは、アポトーシスを促進し、炎症を減少させ、増殖を妨げ、転移を抑制することが実証されているため、子宮頸がんの予防または治療におけるプロバイオティクスの可能性がすでに研究で示されています。 プロバイオティクスは、抗感染薬と組み合わせると、より顕著な効果を発揮するようです. 今後の研究では、子宮頸がんなどの疾患の発症に関連する微生物叢を介した免疫および生理学的反応に焦点を当てる必要があります。 病気の進行を予測し、病気の進行を防ぐための適切な対策を早期に実施できるようにする微生物バイオマーカーの同定も必要です。 |
| |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| |
