
Elena Daskalova et al., |
要約 |
| 背景:心臓の老化は、心筋リモデリングおよび血管新生の減少と関連している。これらの変化を天然物で抑制することは、大きな可能性を秘めた予防戦略である。本研究の目的は、アロニア・メラノカルパ果汁(AMJ)の補給が、高齢ラットの心臓における加齢性心筋リモデリングに及ぼす影響を評価することであった。 |
| 方法:健康な雄Wistarラット(n = 24)を3群に分けた。(1)若齢対照群(CY)—2ヶ月齢、(2)高齢対照群(CO)—27ヶ月齢、(3)AMJ群—27ヶ月齢の動物に、アロニア・メラノカルパ果汁(AMJ)を10 mL/kgの用量で105日間補給した。この期間後、動物の心臓を固定し、パラフィン包埋し、免疫組織化学および形態計測学的分析を実施した。 |
| 結果:AMJ群の心臓では、CO群と比較して血管および毛細血管密度が高いことが確認された。心筋におけるCD34+細胞の平均数は、CO群と比較してAMJ群で18.6%増加した(p < 0.05)。さらに、心筋におけるアンジオテンシン変換酵素2(ACE2)の免疫発現はCO群と比較してAMJ群で37%増加し(p < 0.05)、MASプロトオンコジーン受容体(MAS1)の免疫発現は6%増加した(p < 0.05)。 |
| 結論:AMJの適用の結果、顕著な血管新生が認められ、心筋の栄養が改善されたことを示唆している。本研究は、ポリフェノールを豊富に含むAMJがラットの加齢に伴う微小血管心筋リモデリングにプラスの影響を与えることを初めて実証し、健康な心臓老化の予防剤としてのAMJの可能性を示唆している。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. アロニア・メラノカルパ果汁 |
| 2.2. 試験動物 |
| 2.3. 免疫組織化学 |
| 2.4. 形態計測分析 |
| 2.5. 統計解析 |
| 3. 結果 |
| 3.1. α-SMA免疫発現およびCD34免疫発現 |
| 3.2. アンジオテンシン変換酵素2の免疫発現とMASプロトオンコジーン受容体の免疫発現 |
| 4. 考察-臨床所見 |
| 5. 結論 |
| 本文 |
| 1.はじめに |
| 加齢に伴い、心筋では血流低下、新生血管形成の減少、血管拡張障害など、様々な変化が観察され、心筋機能の低下につながる[1]。心血管生理学および病態生理学における重要な因子の一つは、レニン・アンジオテンシン・アルドステロン系(RAAS)である。この系において主要な作用を及ぼす物質はアンジオテンシンII(Ang II)であり、血管収縮作用、炎症促進作用、線維化促進作用を有する[2]。アンジオテンシン変換酵素2(ACE2)は、最近、レニン・アンジオテンシン・アルドステロン系に属することが明らかになった。アンジオテンシン変換酵素2は膜貫通タンパク質であり、カルボキシペプチダーゼとして機能する。アンジオテンシン変換酵素2の中心的な役割は、アンジオテンシンIIのバイオアベイラビリティを低下させ、アンジオテンシン(1-7)の形成を増加させることで、アンジオテンシン変換酵素の活性を阻害することである。アンジオテンシン変換酵素2がアンジオテンシンIIの有害な作用を阻害することで血管保護作用を示すというエビデンスが増加している[3,4]。 アンジオテンシン変換酵素2の存在は、内皮機能と血管緊張に直接関連しています。加齢に伴い、アンジオテンシン変換酵素2の発現は減少します[5]。さらに、心臓、脳、そして体全体の臓器における毛細血管密度と血管新生は加齢とともに低下し、最終的には身体機能と認知機能の低下につながることが分かっています[1,6]。 |
| アンジオテンシン変換酵素2の新生血管形成能に対する効果も、生体内および生体外の試験管内で研究されている。アンジオテンシン変換酵素2の過剰発現は内皮細胞の移動を促進し、組織内に新しい毛細血管を形成することが実験的に明らかになっている[7]。Singhらによると、レニン・アンジオテンシン・アルドステロン系システムはCD34細胞(訳者注:CD34とは、主に造血幹細胞や前駆細胞、内皮細胞などの表面に存在するタンパク質で、細胞の分化や増殖、細胞接着に関与しています)の血管修復機能を調節する。アンジオテンシン変換酵素2/アンジオテンシン(1-7)/Mas軸は血管修復能を活性化するが、アンジオテンシン変換酵素/アンジオテンシンII/AT1軸はこれらの機能を減弱させる。MASプロトオンコジーン受容体(Proto-oncogene Mas)遺伝子は、膜貫通タンパク質ファミリーに属するGタンパク質共役受容体をコードする。これはアンジオテンシン1-7の受容体として機能し、レニン・アンジオテンシン・アルドステロン系システムの一部として低血圧、平滑筋弛緩、心筋保護に関与する[8]。 Endtmannらによると、アンジオテンシン IIは内皮前駆細胞(EPC)の数を減少させ、生体内および生体外で内皮前駆細胞の機能不全を引き起こす[9]。最近、アンジオテンシン変換酵素2が内皮前駆細胞の機能に影響を与え、miR-18a/Nox2/ROS経路を介して老化した内皮細胞を低酸素/再酸素化誘発性障害から保護することが示された[10,11]。 |
| CD34は、造血幹細胞や内皮前駆細胞を含む複数の幹/前駆細胞に発現している細胞表面抗原である[8]。CD34は、小毛細血管や初期血管発達を支える組織に多く発現していることが明らかになっている[12,13]。Ribattiらの研究は、出生後の血管新生におけるCD34+細胞の新たな役割について説得力のある証拠を提供した[14]。このため、CD34+細胞はしばしば内皮前駆細胞と定義される。現在では、これらの細胞が間質由来因子1(SDF)や血管内皮増殖因子(VEGF)などの低酸素調節因子に反応して増殖し、虚血部位に移動して血管修復を促進し、それによって組織損傷を防ぐことが十分に文書化されている[15]。CD34+細胞集団を用いた自家細胞療法は、虚血性心筋疾患の治療における有望なアプローチとしてすでに浮上している[16]。 CD34+細胞は最近、さまざまな疾患における治療的血管新生を改善するために使用されており、血管、虚血、炎症性病態における治療応用の可能性も秘めている[17]。 |
| 高齢者の心筋機能の改善を目的とした天然由来製品の活用は、有益な予防戦略です。アロニア・メラノカルパ(Aronia melanocarpa)の果実には、抗炎症作用と抗酸化作用が実証されており、肝保護作用、免疫調節作用、抗変異原性作用、抗発がん作用、脂質低下作用、抗糖尿病作用、抗高血圧作用などの効果があります[18,19,20,21,22,23]。近年、ブラックチョークベリーの製品と抽出物は、その抗老化作用と老化防止作用に関して、科学的に大きな関心を集めています。様々な疾患モデルを用いた研究で、アロニア抽出物の抗老化効果は、寿命延長、抗増殖活性、糖・脂質代謝の改善、神経変性疾患の改善、胃保護作用として発現し、その根底にあるメカニズムはホルミシス効果、抗酸化防御の活性化、インスリン/IGF-1シグナル伝達の調節、抗炎症活性と関連している可能性があると結論付けられました[23]。健康な高齢ラットを用いたモデルでは、フェノール化合物、特にアントシアニンが豊富なブラックチョークベリー果汁が、海馬貫通路の神経線維密度を高めることで神経保護効果を示し[24]、老齢ラットの冠動脈の加齢性リモデリングを減少させることを明らかにしました[25]。 |
| 天然化合物が心筋の形態に及ぼす影響については、ほとんど研究が進んでいません。ほとんどの研究は、様々な植物抽出物や製剤(ローズマリー、ナツメグ-5、黒豆皮など)が心筋梗塞後または非虚血性心筋症モデルにおいて心臓リモデリングに及ぼす有益な影響を調査しています[26,27,28]。しかし、我々の知る限りでは、健康な高齢ラットのモデルにおいて天然物(クルクミン)が心臓血管新生に及ぼす影響を調査した研究は1件しかありません。この研究では、クルクミンがTSP1/NF-κB/VEGF-Aシグナリングを介して高齢ラットの心臓における血管新生を改善することが明らかになりました[29]。これらの知見に基づき、ポリフェノールを豊富に含むブラックチョークベリージュースは、ラットの加齢に伴う血管心筋リモデリングに有益な効果をもたらすという仮説を立て、これを本研究の目的としました。 |
| 2. 材料と方法 |
| 2.1. アロニア・メラノカルパ果汁 |
| アロニア・メラノカルパ果汁(乾燥固形分18.8 °Bx)は、Daskalovaら [24] の報告に従って調製した。概略としては、冷凍果実5kgを室温で解凍し、実験室用ミキサーで均質化した。均質化液を褐色ガラス瓶に移し、恒温振盪水槽で60℃に1時間保温した。その後、果肉をチーズクロスで濾過し、得られた液体分画を遠心分離して本研究に使用した。ブラックチョークベリーの果実は、2017年8月に完全に成熟した段階で、認可農家のトドル・ペトコフ氏(ブルガリア、スタラ・ザゴラ地区、カザンラク)によって納品されました。本研究で使用した果汁の詳細な分析プロトコルと化学組成(表1)は、Daskalovaら[24]に記載されています。 |
表1. アロニア・メラノカルパ果汁の化学組成(Daskalova et al. [24]より引用)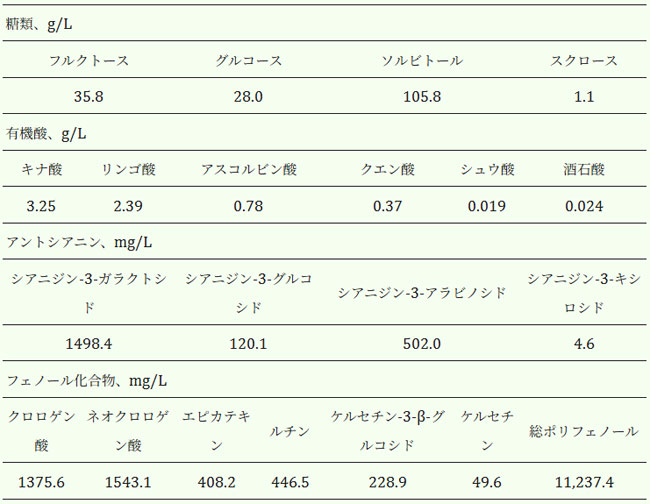 |
| 2.2. 試験動物 |
| 詳細な動物実験プロトコルはDaskalovaら [24] に示されている。簡単に説明すると、雄Wistarラット(n = 24)はプロヴディフ医科大学動物飼育室から提供され、標準的な実験室環境(ポリプロピレン製ケージに入れ、温度22 ± 3 °C、12時間明暗サイクル、相対湿度60 ± 5%に制御された清浄空気環境下で飼育)下で飼育された。ラットは3群に分けられた。(1) 若齢対照群(CY)—AMJを投与していない2ヶ月齢(n = 8)、(2) 高齢対照群(CO)—AMJを投与していない27ヶ月齢(n = 8)、(3) AMJ群—AMJ(10 mL/kg)を飲料水に1:1に希釈して105日間経口投与した27ヶ月齢の動物(n = 8)。補給期間は、私たちの過去の研究(Daskalova et al., 2019)に基づいています。ラットには標準的なげっ歯類用飼料(タンパク質13.45%、炭水化物51.6%、脂肪3.40%含有)と水道水を自由に摂取させました。1日あたりのジュース投与量は、体重測定(月2回)後に各動物で算出しました。AMJ群の動物には、1日分の希釈ジュースを摂取した後、清水を与えました。実験期間全体を通して、各動物は約440 mLのフルーツジュースを摂取しました。実験期間終了時に、動物を筋肉内麻酔しました。ケタミン90 mg/kgおよびキシラジン10 mg/kg(塩酸ケタミン、QN01AX03;BREMER PHARMA GmbH Production, 34414 Warburg, Germany;キシラジン、Bioveta Romania SRL, 400 089 Cluj-Napoca, Romania)を投与し、頸部断頭により安楽死させた。その後、動物の心臓を10%中性ホルマリンで固定し、パラフィン包埋した後、免疫組織化学、形態計測、および統計学的解析を実施した。 |
| 2.3. 免疫組織化学 |
| 本研究の対象症例すべてにおいて、Autostainer Link 48(Dako社、Agilent Technologies Inc.、Glostrup、Denmark)を用いて、全自動かつ標準化された手順で免疫染色を実施した。パラフィン切片(厚さ5µm)をEnVision FLEX Visualization Systems(Dako社、Agilent Technologies Inc.、Glostrup、Denmark)で20分間処理した。内因性ペルオキシダーゼは3%過酸化水素で5分間ブロッキングした。次に、切片を、α-SMAモノクローナル抗体1:5000(A-2547、Sigma Chemicals、St. Louis, MO, USA)、アンジオテンシン変換酵素2ポリクローナル抗体1:200(E-AB-12224、Elabscience Biotechnology Inc.、Houston, TX, USA)、MASプロトオンコジーン受容体モノクローナル抗体1:300(sc-390453、Santa Cruz Biotechnology Inc.、Santa Cruz, CA, USA)、およびCD34(QBEnd/10)一次抗体(05299233001、Roche、Rotkreuz, Switzerland)とともに30分間インキュベートしました。 |
| 3,3-ジアミノベンジジン二塩酸塩およびヘマトキシリンを含むEnVision FLEX可視化システムを用いて可視化した。4つの受容体に対するネガティブコントロールは、一次抗体を省略して同条件で同時に行った。染色切片はカナダバルサムで永久封入した。 |
| すべての顕微鏡写真は、Leica DM3000 顕微鏡 (Leica Microsystems、Wetzlar, Germany) と Flexocam C3 デジタル カメラ (Leica Microsystems、Wetzlar, Germany) を組み合わせて撮影されました。 |
| 2.4. 形態計測分析 |
| 形態計測分析には、ラットの心臓冠状溝直下から採取した厚さ5µmの組織切片を用いた。 |
| アンジオテンシン変換酵素2およびMASプロトオンコジーン受容体(MAS1)(訳者注:MAS1がん遺伝子(MAS受容体)は、Gタンパク質共役受容体であり、アンジオテンシンIIの代謝産物であるアンジオテンシン(1-7)と結合する)を免疫染色したスライスを用いて、左心室心筋における免疫反応の強度を測定した。ソフトウェアDP-Soft ver. 3.2(Olympus, Tokyo, Japan)を使用して、ピクセルの平均強度を任意単位(AU)で記録した。 |
| CD34陽性細胞数を算出するために、まず100倍の倍率で血管新生が最も活発な領域を特定した[1]。次に、これらの領域を200倍の倍率で撮影した。ソフトウェアを用いて顕微鏡写真に500/500ピクセルのグリッドを重ね合わせ、利用可能な細胞核に基づいてCD34免疫陽性細胞の平均数と単位面積あたりの平均細胞数(細胞密度)を測定した。象限境界線に沿って計数する際は、象限に入る細胞の2/3を含む核のみを計数した。 |
| 左心室断面における血管の平均数とα-SMAおよびCD34の免疫発現強度は、心臓壁における免疫組織化学反応に基づき、以下の凡例を用いて半定量的に推定した:-:発現なし、+:弱い発現、++:中等度の発現、+++:強い発現。測定はDP-Soft ver. 3.2ソフトウェア(Olympus, Tokyo, Japan)を用いて行った。 |
| 2.5. 統計解析 |
| 結果は平均値と標準偏差(SD)で示されている。3群の平均値の比較は、等分散を仮定した場合と仮定しない場合で、Tukey HSD検定またはGames-Howell検定(一元配置分散分析、事後検定)を用いて行われた。CD34陽性細胞と細胞密度の相関は、ピアソン係数(r)で測定された。p < 0.05を有意と判定した。データはIBM SPSS Statistics v.25ソフトウェア製品を用いて解析した。 |
| 3. 結果 |
| 3.1. α-SMA免疫発現およびCD34免疫発現 |
| 本研究では、3つの実験群の心筋におけるα-SMA(訳者注:α-SMA(アルファ・スムース・マッスル・アクチン/α平滑筋アクチン)は、細胞の収縮や移動、形態維持に関わる重要なタンパク質で、特に血管平滑筋細胞や筋線維芽細胞(線維化に関わる細胞)で発現し、病理検査では細胞の活性化や線維化(瘢痕形成)のマーカーとして広く用いられます)およびCD34の免疫組織化学染色を行い、心壁における血管の量と新生血管の出現を調べた。心筋において、α-SMA免疫陽性構造は茶色に染色された(図1D~F)。 |
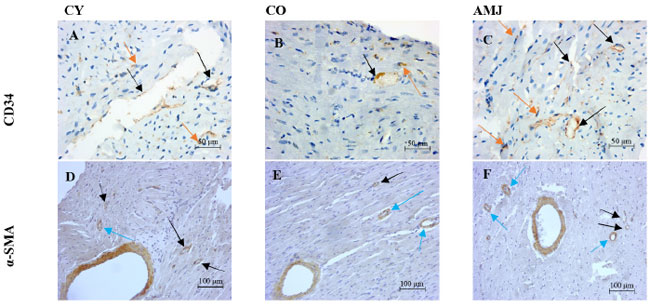 |
図1. ラット心筋 (A–C): 毛細血管(黒矢印)およびCD34+細胞(オレンジ矢印)におけるCD34免疫発現(倍率×200、スケールバー=50µm); (D–F): 毛細血管(黒矢印)および小口径血管(青矢印)におけるα-SMA免疫発現(倍率×100、スケールバー=100µm)。 |
| 心筋では、毛細血管を含む様々な口径の血管壁でα-SMAの発現が特に高いことがわかりました。すべての実験動物で、異なる口径の血管壁が明瞭に茶色に染まっていることが確認されました。また、α-SMA陽性の単一細胞の数が異なり、これは周皮細胞と筋線維芽細胞の存在を示しています。アロニアを補給した老齢動物のグループでは、COグループと比較して、大血管壁でより高い強度のα-SMA免疫反応を確認しました。AMJグループでは、COグループと比較して、薄壁の血管と毛細血管の密度が高く、心筋に多くの散在する単一細胞が存在することも顕著でした(図1D~F、表1、表2)。 |
| 表2. ラット心筋におけるα-SMAおよびCD34の免疫発現強度。半定量分析 |
 |
| 凡例: −、なし、+、弱い、++、中程度、+++、強い発現。 |
| CD34は膜タンパク質であり、血管内皮細胞、血管前駆細胞、線維芽細胞、および筋前駆細胞のマーカーとして機能します。私たちはCD34を血管新生のマーカーとして用いました。心筋では、CD34免疫陽性構造が茶色に染色されました(図1A~C)。 |
| 3群全てにおいて、薄壁血管壁と毛細血管においてCD34の明確な発現が観察され、これらを区別して定量化することができました。心筋におけるCD34免疫反応の強度を半定量的に解析した結果、アロニア投与群ではCO群と比較して強度が高く、CY群と同等の強度に達していました(表2)。 |
| 心筋におけるCD34陽性細胞の分布を半定量的に解析した結果、AMJ群ではCO群と比較して、心筋における総血管密度と毛細血管密度の両方が高かったことが示された。表3から明らかなように、CO群はCY群と比較して血管密度が低く、これは加齢に伴う自然な心筋リモデリングの現れである。 |
| 表3. α-SMAおよびCD34の発現に基づくラット心筋における血管密度と毛細血管密度の比較。半定量分析 |
 |
| 凡例: −、なし、+、弱い、++、中程度、+++、強い発現 |
| 単位面積あたりのCD34陽性細胞の平均数を統計的に解析したところ、CO群はCY群と比較して有意に低い値を示しました(p < 0.01)。これは自然な老化プロセスの表れです。AMJを補給した群では、CD34陽性細胞の平均数はCO群と比較して有意に高く(p < 0.05)、これは細胞の活発な増殖を示しています(図2)。 |
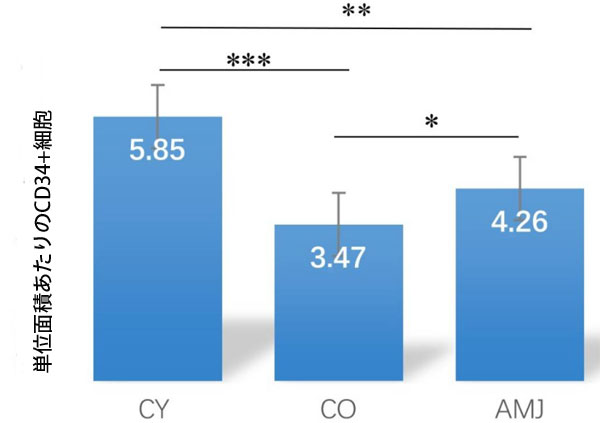 |
図2.単位面積あたりのCD34 +細胞数。 *** p < 0.001、** p < 0.01、* p < 0.05 |
| CD34陽性細胞数と単位面積あたりの細胞総数に関するデータ分析では、CY群では弱い正の相関(r = 0.212、p = 0.430)が、CO群では非常に弱い負の相関(r = -0.138、p = 0.610)が認められました。しかし、どちらの場合も、低い値とその統計的有意性の低さは、CD34陽性細胞の不均衡かつ非ランダムな分布を示しています(図3)。AMJ群では、単位面積あたりのCD34陽性細胞数と平均細胞数との間に高い正の相関が認められました(r = 0.601、p = 0.014)(図3)。 |
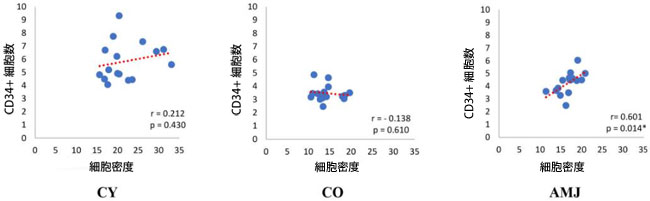 |
図3.単位面積あたりの CD34+ 細胞数と細胞密度の相関関係。 r—ピアソン相関、p—有意水準、* p < 0.05 |
| 3.2. アンジオテンシン変換酵素2の免疫発現とMASプロトオンコジーン受容体の免疫発現 |
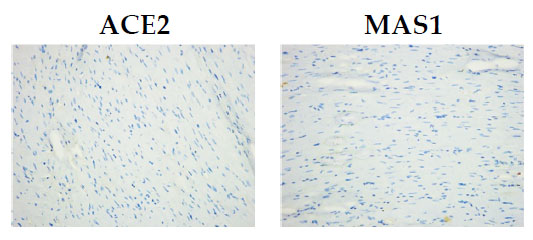
| ラット心筋切片における免疫組織化学染色の結果、アンジオテンシン変換酵素2(ACE2)は心筋細胞、心筋線維芽細胞、および冠動脈内皮細胞に広く発現していることが示された(図4)。MASプロトオンコジーン受容体タンパク質(MAS1)は、3つの実験群すべてにおいて、心筋細胞だけでなく、冠動脈および毛細血管にも検出された(図4)。 |
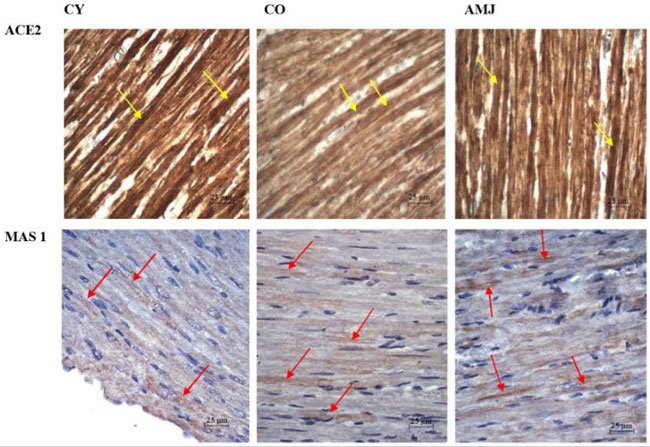 |
図4. ラット心筋。 心筋細胞におけるアンジオテンシン変換酵素2 (ACE2)免疫発現(黄色矢印)、(倍率×400、スケールバー=25µm)、および心筋細胞におけるMASプロトオンコジーン受容体免疫発現(赤色矢印)、(倍率×400、スケールバー=25µm)。 |
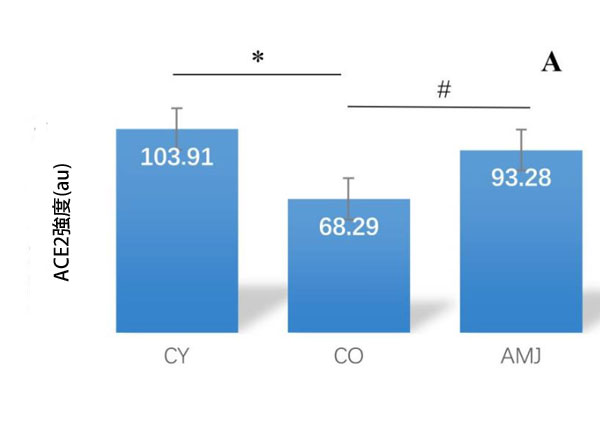
| 心筋におけるアンジオテンシン変換酵素2の免疫反応強度の形態計測解析では、AMJ群はCO群と比較して有意に高い値を示しました(p < 0.05)。CY群とCO群の比較では、CY群で有意に高い強度を示しました(p < 0.05)(図5)。これは、加齢に伴う酵素活性の低下を裏付けています(図5)。MASプロトオンコジーン受容体の免疫反応強度の形態計測解析では、AMJ群はCO群と比較して有意に高い値を示しました(p < 0.05)。CY群とCO群の比較では、CY群に有意差が見られました(p < 0.05)。 |
 |
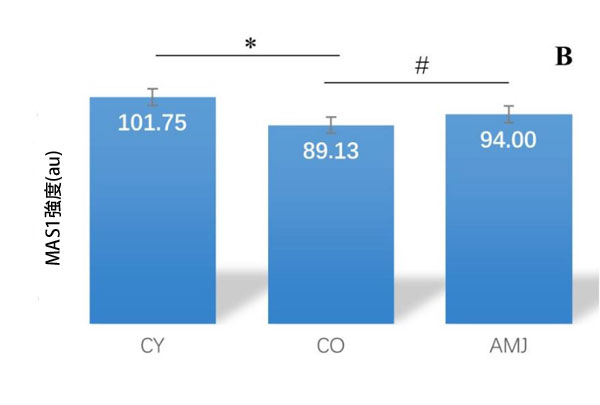 |
図5. ラット心筋 (A) アンジオテンシン変換酵素2 (ACE2)免疫発現強度: * p < 0.05; # p < 0.05; (B) MASプロトオンコジーン受容体(MAS1)免疫発現強度: * p < 0.05; # p < 0.05。 |
| 図 6 は、免疫組織化学プロトコルで一次抗体を省略して得られた 4 つの免疫反応のネガティブ コントロールの顕微鏡写真を示しています。 |
 |
 |
| 図6. 組織サンプル中の一次抗体を省略したCD34、α-SMA、アンジオテンシン変換酵素2 (ACE2)、MASプロトオンコジーン受容体(MAS1)のネガティブコントロール。すべての画像の倍率は200倍です。 |
| 4. 考察 |
| 本研究の結果は、アロニア・メラノカルパ果汁を摂取した老齢ラットの心筋において、新生血管の形成が明確に示された。これは、特に心筋において既に起こっていた加齢に伴うリモデリングを考慮すると、注目すべき結果である。 |
| 加齢心臓では、疾患のない症例でも左室心筋の肥厚が認められる。一方、左室心筋の肥厚に変化がない症例では、心筋細胞の肥大と総数の減少が同時に起こる。同時に、心筋間質におけるコラーゲン線維の相対的割合の増加が観察される[30]。いくつかの形態計測学的研究は、心筋の成長は主に収縮細胞容積の増加に起因することを示している[31,32,33]。ラットの心筋細胞は離乳期頃まである程度の増殖能力を保持する[34]。加齢心筋の生化学的および電気生理学的特性の同時変化と心室における肥大した筋細胞の減少は、加齢心臓において作業負荷が増大した状況下で心機能が制限されることを説明できる可能性がある[30]。成長期のラット心臓に関する研究では、左室心筋における毛細血管密度は生後急速に増加し、生後1ヶ月頃に最大密度に達することが示されています[35,36]。その後も心筋細胞集団は継続的に成長し、心筋細胞の直径が増大します。その結果、隣接する毛細血管が横方向に移動することで、毛細血管密度が低下します[35,36]。 |
| 毛細血管濃度の低下は、組織の酸素交換に利用可能な内皮表面積の減少と、心筋細胞への酸素輸送の平均拡散距離の延長につながる。これらの毛細血管特性は、高齢ラットの心室壁全体にわたる単一心筋細胞のびまん性喪失につながる局所虚血の構造的基盤となっている可能性がある[1]。Ilievらの実験データによると、ラットの出生後期の毛細血管網の発達は著しく低下し、左心室および右心室の両方において心筋細胞の表面積の増加に遅れをとる[1]。高齢ラットでは、コラーゲン沈着を伴う血管壁肥厚と大冠動脈の硬化が認められており、これは我々の以前の研究でも示されている[25,37]。これは、加齢過程における心筋栄養因子の劣化にさらに寄与する。さらに、加齢したヒトおよび動物で観察される心臓重量の増加は、毛細血管微小血管系を包含する冠動脈樹の比例的な拡大とは一致しない。この比例的な拡張の欠如は相対的な酸素欠乏につながり、心筋組織のジストロフィー変化を引き起こします[37]。 |
| 既存の文献には、ブラックチョークベリーの果実が心臓の血管新生プロセスに及ぼす影響に関するデータが限られている[38]。新しい血管が形成されるプロセスは、内皮前駆細胞(EPC)および成熟した内皮細胞の活性と関連している。血管新生は、組織リモデリングおよび虚血組織の再生の重要な要素である[6,39]。私たちの結果は、AMJグループの心筋中のCD34 +細胞の平均数がCOグループと比較して有意に高く、CD34 +細胞の数と心筋の細胞密度の間に正の相関関係があることを示しており、これは内皮前駆細胞の活発な増殖または血液からの遊走によるものと考えられる。心筋中の内皮前駆細胞の刺激は、補給の結果としてのアンジオテンシン変換酵素2およびMAS活性の増加と関連している可能性がある。 |
| CD34陽性細胞の分布の変動性を考慮すると、炎症反応や一般的な細胞増殖などの他の要因がこれらの結果に影響を与える可能性が高いと考えられます。様々な研究から得られたエビデンスは、炎症と組織修復におけるCD34陽性細胞の二重の役割を強調しています。例えば、CD34陽性細胞は、炎症性疾患において亢進するSDF-1αなどの走化性シグナルに反応して炎症部位に移動することが示されています[40]。これは、炎症がCD34陽性細胞の動員、ホーミング、および機能に影響を与える可能性を示唆しています。さらに、CD34陽性細胞はIL-10の分泌とTNF-αやIL-6などの炎症性サイトカインの抑制を通じて抗炎症効果を示し、全身性炎症環境を調節する可能性があります[41,42]。さらに、CD34+細胞はVEGF(訳者注:VEGFは「血管内皮増殖因子(Vascular Endothelial Growth Factor)」の略で、新しい血管の形成(血管新生)を促進するタンパク質です)などの低酸素調節因子に反応して血管新生や血管修復に役割を果たしており、その分布は単なるベースライン増殖ではなく虚血状態に関連している可能性がある[43]。 |
| これらの知見を踏まえると、CD34+細胞レベルの変動は、炎症反応、血管修復機構、そして加齢に伴う血管リモデリングや心筋虚血といった基礎にある全身状態との間の動的な相互作用を反映している可能性がある[44]。これらの考察は、炎症と増殖の両方がCD34+細胞の変動に寄与している可能性を示唆しており、これらの因子がどのように相互作用し、治療効果に影響を与えるかについて、さらなる研究が必要である。 |
| 前臨床研究のデータによると、CD34陽性細胞は内皮細胞へ分化し、血管系に統合され、血管新生因子を分泌することで、微小循環における血管再生を促進し、虚血誘発性組織障害における心筋灌流を改善することが示唆されている[17]。虚血部位への遊走は、CD34陽性細胞の修復機能を決定づける重要な特性である。この機能は主にVEGFやSDFなどの低酸素調節因子によって調節される[45]。 |
| 本研究では、アロニアジュース摂取後にアンジオテンシン変換酵素2/ MASプロトオンコジーン受容体軸の活性が有意に増加したことと、CD34陽性細胞数の増加、および心筋微小血管数の増加との間に相関関係が認められ、これらの相互接続性が示唆されました。Singhらの研究では、アンジオテンシン変換酵素2またはMas受容体の活性化が、SDFによって引き起こされる反応に匹敵するCD34陽性細胞の遊走を誘導することが示されました。アンジオテンシン-(1-7)の遊走に対する効果は、Mas受容体の活性化を介しています[8]。 |
| いくつかの研究により、アンジオテンシン変換酵素2は血管内皮細胞で高度に発現しており、内皮細胞機能の改善と関連していることが実証されている[46,47,48]。アンジオテンシン変換酵素2の新生血管形成能に対する効果も、in vivoおよびin vitroで研究されている。実験結果では、アンジオテンシン変換酵素2の過剰発現が内皮細胞の移動を促進し、組織内に新しい毛細血管が形成されることが示されている[7]。したがって、アンジオテンシン変換酵素2は内皮内で作用し、アンジオテンシン IIの分解を促進し、血管保護特性を持つ分子であるアンジオテンシン(1-7)の生成を増強することにより、アンジオテンシン IIレベルを調節すると推測される。内皮機能の改善は、アンジオテンシン変換酵素2が心血管保護効果を発揮するメカニズムである可能性が高い[7]。アンジオテンシン(1-7)は、糖尿病マウスから単離されたCD34 +細胞の血管修復機能を高めることが明らかになっている[49]。本実験において、老齢ラットの心筋におけるCD34陽性細胞数の増加とそれに伴う微小血管数の増加は、アンジオテンシン変換酵素/ MASプロトオンコジーン受容体軸の活性亢進に起因する可能性が高い。アルドステロン系はまた、一酸化窒素、活性酸素種、炎症因子の産生を調節することにより、心室中隔欠損(EC)の機能調節においても重要な役割を果たしている[50,51,52]。 |
| アロニアの抗酸化作用と抗炎症作用は、レニン・アンジオテンシン・アルドステロン系活性を調節する追加的なメカニズムを構成し、心保護効果に寄与しています。アンジオテンシン変換酵素2/ MASプロトオンコジーン受容体発現の増加は、局所的な心筋リモデリングだけでなく、全身的な変化によっても引き起こされる可能性があるという仮説を立てました。アロニアに関する研究から得られた裏付けとなるエビデンスは、炎症マーカーを減少させ、レニン・アンジオテンシン系を調節することで、アロニアが心血管系に全身的に影響を及ぼす可能性を示唆しています。 |
| アロニア・メラノカルパの果実は、アントシアニン、フラボノイド、その他のポリフェノール化合物が非常に豊富に含まれており、これらが抗酸化作用の基盤となっています。これらの成分は、スーパーオキシドアニオン(O₂⁻)、ヒドロキシラジカル(OH⁻)、過酸化水素(H₂O₂)などのフリーラジカルのスカベンジャーとして作用し、酸化ストレスシグナル伝達経路を調節して細胞の酸化ダメージを防ぎます。また、これらの化合物は、活性酸素種の解毒に重要な役割を果たすスーパーオキシドディスムターゼ(SOD)、カタラーゼ(CAT)、グルタチオンペルオキシダーゼ(GPx)などの内因性抗酸化酵素の活性を高めます[53,54]。アロニアには、ポリフェノール化合物、特にアントシアニンに関連する抗炎症作用があることが示されています。作用機序としては、活性化B細胞核因子κ軽鎖エンハンサー(NF-κB)の阻害が挙げられ、TNF-α、IL-6、IL-1βなどの炎症性サイトカインの発現を低下させます。チョークベリージュースに含まれるアントシアニンは、炎症カスケードに関与するシクロオキシゲナーゼ-2(COX-2)と誘導性一酸化窒素合成酵素(iNOS)の発現も阻害します。抗炎症効果は、プロスタグランジンやサイトカインなどの炎症性メディエーターの濃度低下によっても得られます[53,54]。 |
| 過去の研究では、チョークベリーエキスを摂取した心筋梗塞後患者において、C反応性タンパク質(CRP)、IL-6、VCAM-1などの炎症マーカーの減少という形で現れるチョークベリーの抗炎症作用が観察されています。これらの全身作用は炎症を軽減し、アンジオテンシン変換酵素2およびMASプロトオンコジーン受容体の発現を調節する可能性があります[52]。一方、アロニアはアンジオテンシン変換酵素阻害薬として作用することが示されており、アンジオテンシン変換酵素活性の低下を補うためにアンジオテンシン変換酵素2の発現を増加させる可能性があります。この作用は全身性であり、心臓だけでなく複数の臓器に影響を及ぼします[52]。 |
| アロニアには抗酸化作用と血管保護作用があり、これらは一酸化窒素(NO)の合成促進と血管保護作用として発現し、血管内皮機能の全身的改善を示唆しています。この機能改善は、酸化ストレスと炎症に対抗する代償メカニズムの一環として、アンジオテンシン変換酵素2の発現を増加させる可能性がある[55,56]。 |
| 高血圧症と動脈硬化症の応用モデルの研究では、アロニアの摂取がアンジオテンシン変換酵素活性の低下につながり、それが全身の炎症の軽減と血管機能の改善と相関していることが示されています[57,58]。 |
| 臨床所見 |
| 心臓病学における大きな治療課題の中でも、冠動脈疾患は際立っており、冠動脈における動脈硬化過程に起因する心臓への血流減少を特徴とします。これは、低酸素症、虚血性心不全、そしてリズム障害や伝導障害につながります。血流改善の基本原則は、血管拡張療法、ステント留置、または大動脈冠動脈バイパス術による血管再建です[59]。新しい医薬品の投与と最新世代のステント留置は、冠動脈疾患と診断された患者において良好な転帰を示しています。しかし、これらの治療法は、びまん性冠動脈狭窄、術後再狭窄、急性心筋梗塞後の心不全などの要因により、一部の冠動脈疾患患者には効果がない可能性があります。新生血管新生の新たな道を模索する中で、血管内皮細胞増殖因子をベースとした現在の治療法の探究は、アテローム性動脈硬化性プラーク内の血管新生を促進し、それによってプラークの不安定性を引き起こす可能性があるため、信頼性の低いものとなっています。新生血管新生の有望な新しい方法は、幹細胞をベースとした治療法です [60]。これらの考慮事項に照らして、治療的血管新生の概念は、過去 10 年間で大きな重要性を増しています。新生血管形成が虚血心筋への血流を効果的に改善できることを実証する研究が文献にますます多く登場しています。新生血管形成が起こる主なメカニズムは、血管新生と血管新生の 2 つです。前者では、毛細血管内の 内皮前駆細胞の組織化が in situ で起こり、後者では、既存の血管が分裂と折り畳まれて新しい血管が形成されます [59,60]。 |
| 血管、虚血、炎症性病態におけるCD34陽性細胞の有効な治療薬としての応用に関する前臨床および臨床的側面は、Hassanpourら[17]によって広範囲にレビューされている。CD34陽性細胞は、血管新生、抗炎症作用、および組織再生を促進する能力を有するため、治療薬として使用されている。CD34陽性細胞は、間質由来因子1や血管内皮増殖因子などの因子に反応して虚血または炎症部位に移動し、血管修復を促進し、組織損傷を予防する[40,61]。 |
| 臨床応用としては、心外膜および冠動脈における微小循環の改善、IL-10の分泌とNF-κBの阻害による炎症反応の減弱[41]、脳血管疾患における神経機能の改善および血管新生の改善などが挙げられます。CD34陽性細胞療法は、虚血性疾患および炎症性疾患、特に心血管系および脳血管系の病態の治療において既に有望な結果を示しています[61,62,63]。 |
| 治療上、アンジオテンシン変換酵素阻害は長期的な臓器保護を達成するための最も好ましい治療標的の一つである。革新的な治療方針の一つはアンジオテンシン変換酵素2産生の刺激である。いくつかのアンジオテンシン変換酵素2活性化剤とアンジオテンシン1-7/MasR作動薬が開発されている。さらに、植物細胞にバイオカプセル化された経口アンジオテンシン変換酵素2およびアンジオテンシン1-7を含む新たなアプローチが設計され、前臨床研究に使用され、有望な心臓保護効果が示されている[51]。血流改善のための既存の戦略を補完できる非常に魅力的なアプローチは、冠動脈疾患患者の日常の食事に機能性食品を取り入れることである。これは、動脈硬化プロセスを管理するための便利で費用対効果が高く、無害な方法である[39]。ブラックチョークベリーに含まれるポリフェノール化合物、特にアントシアニンは、複数のメカニズムを通じて、心臓の加齢に伴う変性変化を遅らせる効果が実証されている。これらには、酸化ストレスの軽減、炎症の緩和、内皮機能の改善、高脂血症および高コレステロール血症の調整、血圧の低下、および凝固プロセスへの影響が含まれる[39]。 |
| 5. 結論 |
| 本研究の結果は、アロニア・メラノカルパ果実由来の抗酸化物質を豊富に含む機能性飲料の摂取が、アンジオテンシン変換酵素2/ MASプロトオンコジーン受容体系の活性を高め、心筋における新生血管形成を促進することを示しています。これらの二重効果の解明は、現代社会において主要な死亡原因となっている心血管疾患に対する新たな治療法の発見を目指した広範な研究の焦点となっています。機能性食品・飲料による予防効果と治療効果の獲得は、有望な天然の代替療法であり、健康的な老化を促進する機会となります。本研究は、動物実験モデルに関連する制約と、新生血管形成の形態学的マーカーの限られた数を対象とした検討という制約を受けています。しかしながら、これらの予備的な知見は、この分野における研究の拡大と深化への励みとなるものです。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Life (Basel). 2024 Dec 28;15(1):23.に掲載されたBlack Chokeberry (Aronia melanocarpa) Juice Supplementation Affects Age-Related Myocardial Remodeling in Rats.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |