
Elena Daskalova , Mina Pencheva and Petko Denev |
要約 |
| 精子形成は、加齢とともに活動性が低下しますが、個体の生涯の終わりまで続くプロセスです。炎症、酸化、アポトーシスは、老化した精巣で観察される加齢関連疾患の病因および発症の予測因子と見なされるイベントです。抗酸化作用および抗炎症作用を持つ天然化合物の使用は、老化した精巣の炎症および酸化状態に有益な効果をもたらします。この研究の目的は、抗酸化物質が豊富なブラックチョークベリー (アロニアメラノカルパ) ジュースの投与が、ラットの精巣の酸化ストレスおよび老化のいくつかのマーカーに及ぼす影響を明らかにすることです。合計 24 匹の雄のウィスターラットを 3 つの実験グループに分けました。2 か月齢の若い対照群、27 か月齢の高齢対照群、および 3 か月間 10 mL/kg の用量でブラックチョークベリージュースを投与した 27 か月齢のラットです。 アロニアメラノカルパジュースの投与により、酸化ストレスが減少し、精細管とライディッヒ細胞における神経性一酸化窒素合成酵素、内皮性一酸化窒素合成酵素、MAS1 の免疫発現が増加しました。形態計測により決定された細管構造データでは、3 つのグループ間に有意差は見られませんでした。しかし、ライディッヒ細胞におけるチロシンタンパク質キナーゼ受容体-C (TRK-C )と神経栄養因子-3( NT3) の免疫反応の強度は、投与を受けた老齢動物では老齢対照群と比較して明らかに高かったことが分かりました。投与を受けた動物では、老齢対照群と比較して精細管周辺の血管数が有意に多かった。これらのデータは、アロニアメラノカルパジュースの投与により精巣の老化プロセスが遅くなり、ライディッヒ細胞の機能活性が維持されることを示しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. アロニアメラノカルパ ジュースの分析と組成 |
| 2.2. 動物 |
| 2.3. ヘマトキシリン-エオシン染色 |
| 2.4. 免疫組織化学 |
| 2.5. 形態計測分析 |
| 2.6. 統計分析 |
| 3. 結果 |
| 3.1. 右精巣重量 |
| 3.2. 通常のヘマトキシリン-エオシン染色 |
| 3.3. 細管の形態計測分析 |
| 3.4. 免疫組織化学 |
| 3.4.1.チロシンタンパク質キナーゼ受容体-C および 神経栄養因子-3免疫反応 |
| 3.4.2.神経性一酸化窒素合成酵素、内皮性一酸化窒素合成酵素、および MAS1 免疫反応 |
| 4. 考察 |
| 4.1. 形態学的変化 |
| 4.2. チロシンタンパク質キナーゼ受容体-Cおよび神経栄養因子-3免疫反応 |
| 4.3. 神経性一酸化窒素合成酵素、内皮性一酸化窒素合成酵素、および Mas1 免疫反応 |
| 4.4. ライディッヒ細胞の抗酸化物質とステロイド生成機能 |
| 5. 結論 |
| 本文 |
| 1.はじめに |
| 老化は、多くの内因性および環境要因によりすべての臓器に不可逆的な変化をもたらす自然なプロセスであり、精巣の変化は男性の生殖器系に対する老化の影響の 1 つです。これらの変化は精子の質と量の低下につながる可能性があり、これはテストステロンレベルの低下にも関連しています [1,2,3]。さらに、加齢に伴う精巣機能の低下は、全体的な健康状態と生活の質にも影響します [4]。加齢に伴う進行性の精巣退縮の発症には明確な時期はありません [5]。精巣の加齢に伴う変化は、精子形成上皮とセルトリ細胞(訳者注:セルトリ細胞は精子を形成していく細胞群を物理的・内分泌的にサポートし、これらの細胞の維持・分化に重要な働きをしています)およびライディッヒ細胞(訳者注:ライディッヒ細胞は精巣の間質に存在し、男性ホルモン(テストステロン)の産生・分泌を通じて種々の組織の雄性化を促進する)の両方に影響を及ぼし、退化の兆候が見られます [6]。加齢精巣の最も一般的な組織学的所見は、精細管における精子形成の変化です。ヒトとげっ歯類の両方で、加齢に伴う萎縮は局所的に始まり、精巣内の萎縮した細管は正常な精子形成の細管に隣接しています。精巣組織は代謝活動と細胞複製のレベルが特徴的に高いため、酸化ストレスは特に有害となる可能性があり、抗酸化能が特に重要になります[5,7]。 |
| さまざまな研究結果によると、成熟した精子の細胞質の量が限られていること、精子中の活性酸素種(ROS)抑制抗酸化物質の濃度が高いこと、精子構造中の不飽和脂肪酸のレベルが高いことなどにより、精子は他の細胞よりも酸化ストレスの影響を受けやすいことが分かっています[8]。 |
| ラットでは、酵素および非酵素抗酸化物質の発現が加齢とともに減少し、酸化ストレスによる損傷が増加することが証明されています。さらに、抗酸化物質であるグルタチオンのレベルは、高齢のラットで減少します[9]。 |
| 正常な精子機能(例えば、受精能獲得、過剰活性化、先体反応、受精)には、低レベルの活性酸素種が必要です[10]。最近、高齢マウスの酸化ストレスレベルの上昇により精巣ステロイド生成が減少し、グルコース代謝障害がアディポネクチン受容体の減少と相関していることが示されました[11]。活性酸素種の存在とその結果生じる酸化ストレスはアポトーシスと密接に関連しているため、加齢中のヒト精巣で説明されるアポトーシスイベントの増加は、少なくとも部分的には、加齢精巣における活性酸素種の蓄積によって説明できます[12]。 |
| 近年、腎臓および心血管機能の内分泌調節因子としてのレニン-アンジオテンシン系(RAS)の機能が見直されています[13]。さまざまな臓器における局所レニン-アンジオテンシン系の重要性が高まっています。プロレニン、レニン、アンジオテンシノーゲン、アンジオテンシン(Ang)I、アンジオテンシンII、アンジオテンシン変換酵素(ACE)、アンジオテンシン変換酵素2など、レニン-アンジオテンシン系のいくつかの成分がヒトおよび哺乳類の精巣および精巣上体で同定されたことは、男性の生殖における局所レニン-アンジオテンシン系の存在と関与を強く支持しています[14,15,16,17,18]。この局所レニン-アンジオテンシン系の要素の発現は、ヒトの生殖管のさまざまな部分で報告されています[13,19]。多数の遺伝子およびタンパク質分析により、ヒトおよび動物の精巣、精嚢、精巣上体、前立腺にレニン-アンジオテンシン系成分が存在することが確認されています[14,20]。 アンジオテンシン変換酵素2はアンジオテンシン変換酵素のヒトホモログであり、ヒトおよび動物の心臓、腎臓、精巣で高度に発現しています。いくつかの異なる研究により、精巣におけるアンジオテンシン変換酵素2の発現はラットではライディッヒ細胞、ヒトではライディッヒ細胞とセルトリ細胞に限定されていることがわかりました[21,22,23]。著者らはまた、アンジオテンシン変換酵素2が精巣機能を制御し、ライディッヒ細胞におけるステロイド生成やその他の機能を調節する役割を果たしていると示唆しています[24]。 |
| 神経栄養因子の機能はニューロンの生存と分化を維持することですが、既知の神経栄養因子とその受容体はすべて精巣で発現していることも実証されています [25]。動物では、チロシンタンパク質キナーゼ受容体(TRK)ファミリーの3つのメンバーが知られています。神経成長因子(NGF)に結合するTRK-A、脳由来神経栄養因子(BDNF)と神経栄養因子-4(NT-4)に結合するTRK-B、および神経栄養因子-3(NT3)に結合するTRK-Cです [26]。精巣胚発生中、神経栄養因子とその受容体は、発生全体を通じて生殖細胞で、またセルトリ細胞とライディッヒ体細胞で発現しています [26]。神経栄養因子は、出生後のライディッヒ細胞の分化や、オートクリンおよびパラクリン機構によるステロイド生成活性の調節にも役割を果たすことが示されています [27]。 |
| 一酸化窒素(NO)は反応性窒素種であり、血管新生、成長、思春期、老化などの重要な生理学的メカニズムを媒介する重要な分子であると考えられています [28]。一酸化窒素合成酵素(NOS)は、一酸化窒素の合成を担っています。これまでに、動物細胞で3つの一酸化窒素合成酵素アイソフォーム、すなわち神経性一酸化窒素合成酵素(nNOSおよびNOS 1)、誘導性一酸化窒素合成酵素(iNOSおよびNOS 2)、および内皮性一酸化窒素合成酵素(eNOSおよびNOS 3)が発見されています [29]。男性生殖系では、一酸化窒素は正常な生殖と生殖細胞のアポトーシスの調節に重要な役割を果たしています [28]。さらに、この単純な分子は、生殖細胞の進化、血液精巣関門におけるセルトリ細胞と生殖細胞のつながり、生殖細胞のアポトーシスなど、他の役割にも関与しています。さらに、一酸化窒素は正常および病的な精巣組織の両方に広く分布しているため、男性の生殖能力の重要な要因であると考えられています [28]。一酸化窒素/一酸化窒素合成酵素の生理学的役割は、一酸化窒素を介したさまざまなシグナル伝達経路のため多岐にわたります [30,31]。たとえば、一酸化窒素 は炎症の重要な調節因子として関与しており [31]、内分泌系の生理学的調節因子でもあります [32]。精巣では、一酸化窒素合成酵素が精子の運動性や成熟、生殖細胞のアポトーシスなど、さまざまな機能を調節することが示されている [32]。特に、精子の運動性における 一酸化窒素の最初の重要性は、精子に 3 種類の一酸化窒素合成酵素 (内皮性一酸化窒素合成酵素、誘導性一酸化窒素合成酵素、神経性一酸化窒素合成酵素) すべてが存在することを示す局在研究に由来しています [33]。これらの結果は、精子の正常な機能における一酸化窒素/一酸化窒素合成酵素の重要な役割を示唆しているようです [32]。 |
| 高齢者の精巣機能の改善を目的とした天然産物の適用は、貴重な予防戦略です。植物に含まれるポリフェノール化合物などの栄養素は、さまざまな調節メカニズムを通じてテストステロンの産生を刺激することができます [34]。ブラックチョークベリー(アロニアメラノカルパ)の果実は、ポリフェノールやビタミンCやEなどの他の抗酸化物質が豊富で、抗炎症および抗酸化特性が実証されており、肝臓保護、免疫調節、抗変異原性、抗がん、脂質低下、抗糖尿病、および降圧効果の基礎となっています [35]。最近、ブラックチョークベリーの製品と抽出物は、その抗老化特性と老化防止活性に関して真剣な科学的関心を集めています [35,36,37,38,39,40,41,42]。健康な自然老化ウィスターラットの同じモデルを使用した以前の研究では、アロニアメラノカルパフルーツジュースの補給により、冠動脈の加齢関連リモデリングが減少し、神経保護効果が明らかになり、高齢ラットの認知機能と運動機能が改善されることが実証されています [41,42]。しかし、文献には、アロニアメラノカルパ ベースの抽出物と製品が精巣の老化プロセスに及ぼす影響に関する実験的証拠が不足しています。そのため、アロニアメラノカルパの抗酸化特性と抗炎症特性が精巣の加齢関連プロセスに影響を与える可能性があるという仮定が、この研究の目的を決定しました。したがって、本研究の目的は、ポリフェノールが豊富なブラックチョークベリージュースの補給が、自発的に老化する老齢ラットの精巣の構造的および機能的変化に及ぼす影響を調査することです。 |
| 2. 材料と方法 |
| 2.1. アロニアメラノカルパ ジュースの分析と組成 |
| 以前の研究では、同じ健康な自然老化ウィスターラットのモデルと同じジュースが使用されており、ジュースの調製と化学分析の詳細な説明が含まれています [41]。簡単に説明すると、5 kg のアロニア メラノカルパ冷凍果実を室温で解凍し、実験室用ブレンダーで均質化しました。ホモジネートを茶色のガラス瓶に移し、60 °C の恒温振とう水浴で 1 時間インキュベートしました。その後、果肉をチーズクロスで濾過し、液体部分を遠心分離して研究に使用しました。総ポリフェノール含有量は、フォリン-チオカルテウ試薬を使用して測定しました。ポリフェノールと糖のHPLC分析は、HPLCシステム(Agilent 1220、Agilent Technology、Santa Clara, CA, USA、それぞれUV-Vis検出器と屈折率検出器を使用[41])で実施しました。[41]から取得したデータを表1に示します。 |
| 表1 アロニアメラノカルパフルーツジュースのポリフェノールと糖分含有量と組成([41]より引用) |
 |
| 2.2. 動物 |
| 詳細な動物実験プロトコルは、Daskalova らの研究 [41] に記載されています。雄の ウィスターラット (n = 24) は、プロヴディフ医科大学の動物飼育室から提供され、標準的な実験室環境 (ポリプロピレン製のケージに入れられ、温度 22 ± 3 °C、12 時間の明暗サイクル、相対湿度 60 ± 5% に保たれた清浄な空気環境) 下で飼育されました。ラットは 3 つのグループに分けられました。(1) 若齢対照群 (CY) - 2 か月齢でサプリメントなし (n = 8)、(2) 老齢対照群 (CO) - 27 か月齢でサプリメントなし (n = 8)、(3) アロニアジュース投与群(A) - 27 か月齢の動物に、飲料水で 1:1 の割合に希釈したアロニアメラノカルパジュース (10 mL∙kg−1) を 105 日間経口投与 (n = 8)。ラットには、標準的なげっ歯類用飼料(タンパク質 13.45%、炭水化物 51.6%、脂肪 3.40% を含む)と水道水を自由に摂取させた。体重測定(月に 2 回)後に、すべての動物の 1 日のジュース投与量を算出した。アロニアジュース投与群の動物には、1 日の希釈ジュース投与量を摂取した後、清水を与えた。実験期間全体を通じて、すべての動物が約 440 mL のフルーツジュースを摂取した。実験期間の終了時に、動物を筋肉内ケタミン 90 mg/kg/キシラジン 10 mg/kg で麻酔し、体重と体長(鼻肛門長と腹囲)を測定し、頸部断頭により安楽死させた。その後、正中陰嚢切開による両側精巣摘出術を実施した。右精巣の重量(絶対重量)を測定し、相対重量(精巣重量(g)/体重(g)× 100)を計算した。精巣は 10% 中性ホルマリンで固定し、固定後にパラフィンに包埋しました。通常の組織学的、免疫組織化学的、形態計測学的、および統計学的分析を実施しました。 |
| 2.3. ヘマトキシリン-エオシン染色 |
| 通常のヘマトキシリン-エオシン(HE)染色は、標準的な方法論に従って次のように実施しました。切片の脱ワックス、アルコールから水への濃度を下げて再水和、必要に応じて固定色素の除去、ミョウバンヘマトキシリンで 5 分間染色、切片が「青」になるまで 5 分間流水でよく洗浄、1% 酸性アルコール (70% アルコール中の 1% HCl) で 5~10 秒間分化、水道水でよく洗浄 (10~15 分)、1% エオシン Y で 10 分間染色、流水で 1~5 分間洗浄、アルコールを使用して脱水し、その後透明化してマウントします。 |
| 2.4. 免疫組織化学 |
| ラット精巣から採取した切片(厚さ5µm)を脱パラフィンし、モノクローナル抗体(TRK-C、1:1000(sc-517245)、NTR3、1:100(sc-376561)(Santa Cruz Biotechnology, Inc.、Heidelberg, Germany))およびポリクローナル抗体(神経性一酸化窒素合成酵素(nNOS1)、1:100(E-AB-70065)、内皮性一酸化窒素合成酵素(eNOS3)、1:300(E-AB-32268)、MAS1、1:200(E-AB-67951)(Ellabscience Biotechnology Inc.、Houston, TX, USA))を使用して免疫組織化学分析を行った。免疫組織化学のプロトコルは、以前の論文(Daskalova et al.)[42]で詳細に説明されている。すべての顕微鏡写真は、Leica DM3000 LED 顕微鏡 (Leica Microsystems、Wetzlar, Germany) と Flexocam C3 デジタル カメラ (Leica Microsystems、Wetzlar, Germany) を組み合わせて撮影されました。 |
| 2.5. 形態計測分析 |
| 形態計測分析では、ラットの精巣から採取した厚さ 5 µm の組織切片を連続的に切断して使用しました。 |
| 定量的形態計測研究には、次の項目が含まれていました:
−精細管上皮の厚さ (μm) −精細管の平均周囲長 (μm) −精細管の表面積 (μm2) −1 つの精細管を取り囲む血管の平均数 −精細管内の精原細胞、精母細胞、精細胞の平均数。 |
| まず、画像解析装置が自動的に調整され、画像解析装置によって生成された測定単位 (ピクセル) が実際の測定単位 (μm) に変換されます。 |
| 全ての測定は、動物 1 匹につき 5 枚のスライスと、存在する精細管のすべての断面の検査から構成されました。精細管のパラメータは、スライスに円形の切り口を入れ、倍率 100 倍ですべての細管を測定することで確立されました。各細管の精子形成上皮の厚さを 6 か所で測定しました。管を取り囲む血管を数え、すでに数えられている血管は他の隣接する管については数えませんでした [5,43,44]。精子形成の定量分析は、円形に切断された精細管上の各タイプの精子形成細胞の核のみを数えることで行いました。各動物から 5 つの切片を、マイストリッヒとヘス法 [45] を使用して数えました。測定は、LAS X ソフトウェア (Leica Microsystems、Wetzlar, Germany) を使用して手動で行いました。 |
| 2.6. 統計分析 |
| 結果は平均値と標準偏差 (SD) で示されています。3 つの平均値の比較には、Tukey の HSD を使用した事後多重比較による一元配置分散分析を使用しました。2 つの平均値の比較には、独立サンプル検定を使用しました。ノンパラメトリック検定には、Mann–Whitney の 2 つの独立サンプル検定を使用しました。精細管の面積と精細管の周囲長と精子形成上皮の厚さとの相関は、ピアソン係数 (r) で測定しました。p < 0.05 を有意と見なしました。統計分析は、IBM SPSS Statistics (v25) を使用して実施しました。 |
| 3. 結果 |
| 3.1. 右精巣重量 |
| 実験群間の右精巣重量の比較では、若年対照群と 高齢対照群の間 (p < 0.05)、および アロニアメラノカルパジュース投与群と 若年対照群の間 (p < 0.05) に有意差が認められました (表 2)。これは自然な加齢変化の現れです。 |
| 表2 右精巣重量の比較 |
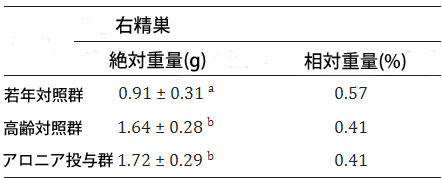 |
結果は平均値±標準偏差として表されます。同じ上付き文字でマークされた値の間には有意差はありません (p < 0.05)。 CY—若年対照群、CO—高齢対照群、A—アロニアメラノカルパジュース投与群。 |
| 3.2. 通常のヘマトキシリン-エオシン染色 |
| 組織形態学的データは図 1 に示されています。若年対照群の標準的な精巣ヘマトキシリン-エオシン染色では、わずかな量の疎性結合組織を含む狭い間質を持つ、密に配列した精細管の精巣実質が示されました。精細管の基底膜は薄い層として現れました。精細管は、大きな核と精原細胞、精母細胞、丸い初期精子、細長い後期精子を含む精子形成細胞で区別されるセルトリ細胞の重層上皮で、この順序で精細管の基底部から管腔外部まで並んでいました。大部分の管腔は、管腔内に成熟した精子の尾部が存在し、活発な精子形成の兆候を示していました。ライディッヒ細胞は、かなりの数の血管を伴って、管腔間の間質に視覚化されました (図 1)。 |
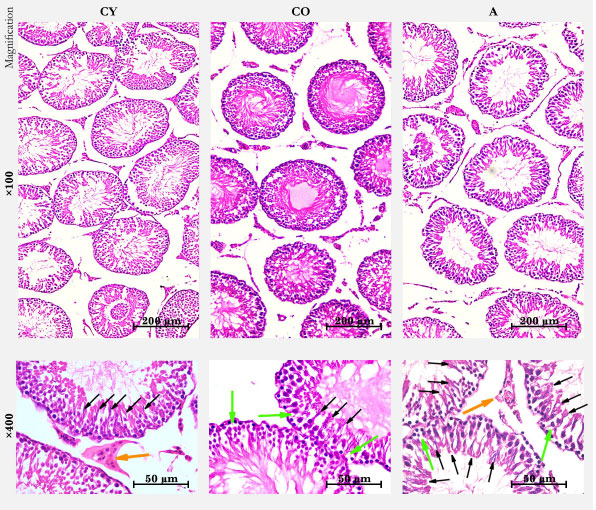 |
図 1 ラットの精巣、ヘマトキシリン-エオシン染色、倍率 ×100/×400。 CY—若年対照群、CO—高齢対照群、A—アロニアメラノカルパジュース投与群。 緑色の矢印—細胞の空胞化、オレンジ色の矢印—ライディッヒ細胞、黒色の矢印—成熟した精子の尾部、活発な精子形成の兆候。 |
| 標準ヘマトキシリン-エオシン染色による精巣では、老年対照群は薄くなった精子形成上皮に顕著な空胞化が認められた。若年対照群と比較すると、精子の量が少なく、精子形成の兆候を示す細管の数が少ないことが顕著であった。細管の基底膜は肥厚し、強く波打っていた。間質腔は明らかに拡大していた。ライディッヒ細胞には、付随する血管の数が減少していることを除いて、目に見える外部変化はなかった (図 1)。アロニアメラノカルパジュース投与群では、ヘマトキシリン-エオシン染色で、老年対照群と同様に、細管の基底膜が肥厚し波打っていることが示された。精細管では、目に見える形で保存されたセルトリ細胞、活発な精子形成を示す細管の数が比較的多く、細管腔内の成熟精子の数が多かった (図 1)。精細管では、細胞質が空胞化した細胞も観察された。ライディッヒ細胞に隣接した血管が豊富に存在し、血液供給が充実していることが印象的でした (図 1)。アロニアメラノカルパジュース投与群の尿細管はより密に配置されており、尿細管間隙のコラーゲン繊維の量と分布に変化は見られませんでした。したがって、これは尿細管の周囲に検出された血管数の増加と関係している可能性が非常に高いと考えられます。 |
| 表 3 は、3 つの実験群のラットの精細管における精原細胞 (Sg)、精母細胞 (Sc)、精子細胞 (St) の定量分析のデータを示しています。データの統計分析では、3 つのパラメータすべてにおいてグループ間で次の有意差が見られました: 高齢対照群vs. 若年対照群(p < 0.05); アロニアメラノカルパジュース投与群vs. 高齢対照群(p < 0.05)。 |
| 表3 アロニアメラノカルパジュース投与による生殖細胞数への影響 |
 |
| 結果は平均値±標準偏差として表されます。各列の同じ上付き文字でマークされた値には有意差はありません (p < 0.05)。CY—若年対照群、CO—高齢対照群、アロニアメラノカルパジュース投与群。 |
| 3.3. 細管の形態計測分析 |
| 湾曲した精細管の構造の形態計測分析の結果を図 2 に示します。 |
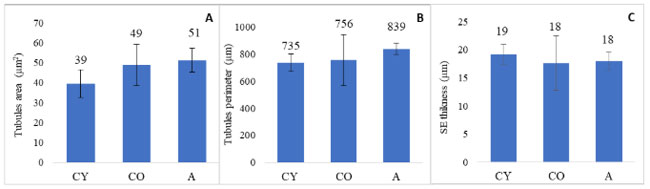 |
| 図 2 尿細管形態の形態計測分析 |
(A) 尿細管面積 (µm2)、(B) 尿細管周囲長 (µm)、(C) 精子形成上皮の厚さ (SET) (µm)。結果は平均値 ± 標準偏差として示されています。 CY—若年対照群、CO—高齢対照群、A—アロニアメラノカルパジュース投与群。 |
| 統計分析の結果、尿細管面積、尿細管周囲長、精子形成上皮の厚さに関して、3 つの実験群間の差は有意に達しなかったことが示されました。3 つの尿細管形態パラメータの相関分析では、それらの間に有意な相関は見られませんでした (図 3)。 |
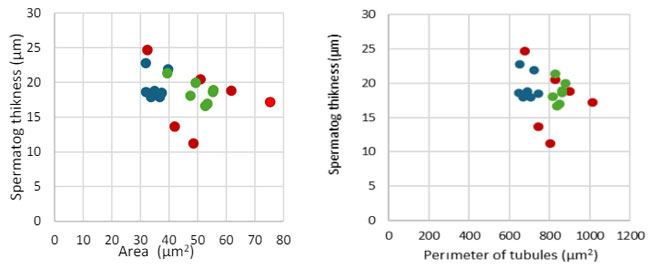 |
| 図 3 尿細管面積および尿細管周囲長と精子形成上皮の厚さの相関関係(各群の症例は次のように色分けされています:CY—青、CO—赤、A—緑)。 |
| 図 4 は、3 つの実験群のラットの精細管周囲の血管の平均数を形態計測分析したデータを示しています。この結果は、組織学的説明の結果を決定的に裏付けています。 |
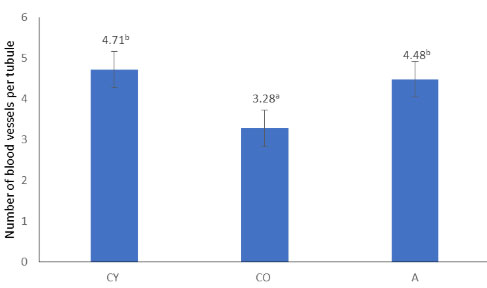 |
| 図 4 尿細管を囲む血管の平均数の形態計測分析 |
結果は平均値 ± 標準偏差として表されます。同じ上付き文字でマークされた値の間には有意差はありません (p < 0.05)。 CY - 若年対照群、CO - 高齢対照群、A - アロニアメラノカルパジュース投与群。 |
| 3.4. 免疫組織化学 |
| 3.4.1.チロシンタンパク質キナーゼ受容体-C および 神経栄養因子-3免疫反応 |
| 図 5 は、ラット精巣における チロシンタンパク質キナーゼ受容体-C(TRK-3)および 神経栄養因子-3(NT3)の免疫反応の顕微鏡写真を示しています。 |
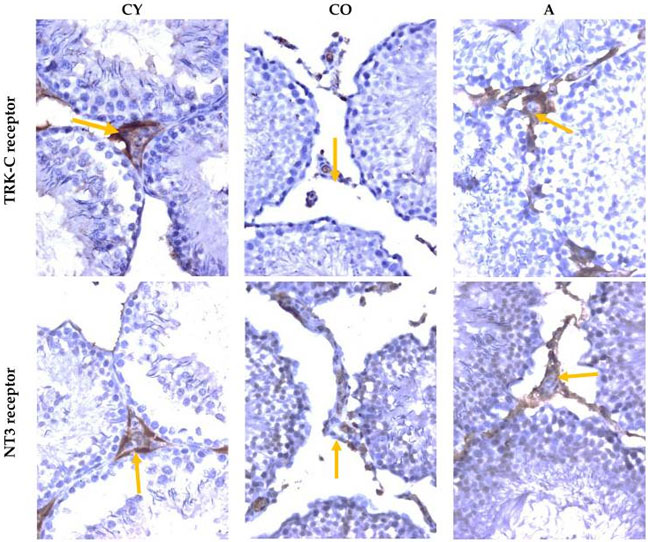 |
| 図5 ラットの精巣 |
チロシンタンパク質キナーゼC受容体(TRK-C)免疫反応、神経栄養因子3(NT3)受容体免疫反応、×400、黄色の矢印—ライディッヒ細胞。 CY—若年対照群、CO—高齢対照群、A—アロニアメラノカルパジュース投与群。 |
| ライディッヒ細胞におけるチロシンタンパク質キナーゼ受容体Cおよび 神経栄養因子3に対する免疫応答の強度の半定量分析では、高齢対照群では若年対照群と比較して低下が見られ、これは加齢に伴うプロセスの現れです。アロニアメラノカルパジュース投与群の動物では、高齢対照群と比較してチロシンタンパク質キナーゼ受容体Cおよび神経栄養因子3に対する免疫応答の強度が高かったことが報告されていますが、これは精巣のライディッヒ細胞における神経栄養因子の活性増加の表れです (表 4)。 |
| 表4 ラット精巣における神経栄養因子3受容体およびチロシンタンパク質キナーゼ受容体Cの免疫発現強度。半定量分析。 |
 |
| 凡例: - なし、+ 弱い、++ 中程度、+++ 強い発現。 |
| 3.4.2.神経性一酸化窒素合成酵素、内皮性一酸化窒素合成酵素、および MAS1 免疫反応 |
| 図 6 は、ラット精巣における 神経性一酸化窒素合成酵素(nNOS)、内皮性一酸化窒素合成酵素(eNOS)、および MAS1 の免疫反応の顕微鏡写真を示しています。精細管では、アロニアメラノカルパジュース投与群の神経性一酸化窒素合成酵素は細長い精子細胞と成熟精子で高い割合を示し、円形精母細胞では低いことがわかりました。高齢対照群では、神経性一酸化窒素合成酵素は主に成熟精子細胞で視覚化されます。若年対照群では、細長い精子細胞と成熟精子の両方と、円形精子細胞と未分化精原細胞で神経性一酸化窒素合成酵素の発現が増加していることがわかりました (図 6、表 5)。間質では、3 つのグループ (若年対照群、高齢対照群、および アロニアメラノカルパジュース投与群) すべてで、神経性一酸化窒素合成酵素がライディッヒ細胞と血管の内皮で高度に発現していることがわかりました。 |
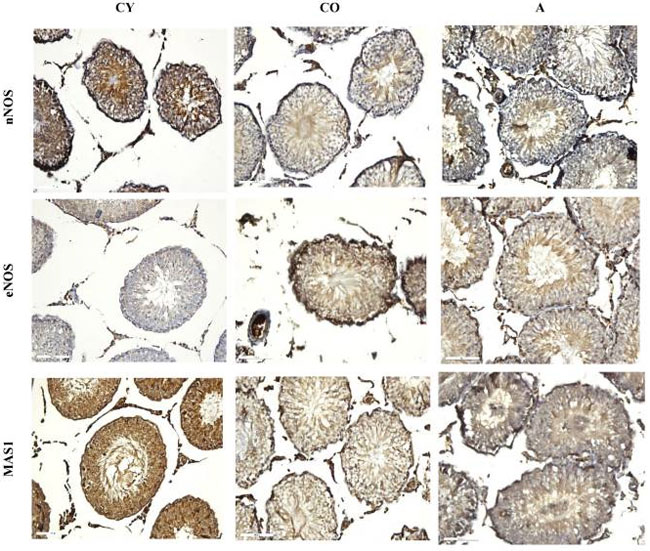 |
図 6 ラット精巣神経性一酸化窒素合成酵素(nNOS)、内皮性一酸化窒素合成酵素(eNOS)、および MAS1 免疫反応、×200。 CY—若年対照群、CO—老年対照群、A—アロニアメラノカルパジュース投与群。 |
| 表5 ラット精巣における神経性一酸化窒素合成酵素(nNOS)、内皮性一酸化窒素合成酵素(eNOS)、MAS1の免疫発現強度。半定量分析。 |
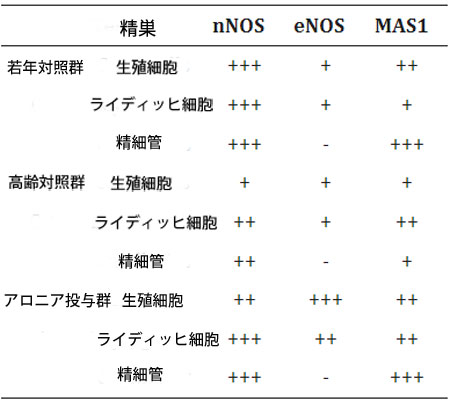 |
| 凡例: - なし、+ 弱い、++ 中程度、+++ 強い発現。 |
| 内皮性一酸化窒素合成酵素の解析では、アロニアメラノカルパジュース投与群の精細管の方が高齢対照群および若年対照群に比べて高い発現レベルを示しました。アロニアメラノカルパジュース投与群は、内皮性一酸化窒素合成酵素は主に細長い精子細胞および成熟精子で検出され、円形精母細胞ではほとんど観察されませんでした。高齢対照群では、内皮性一酸化窒素合成酵素 はすべての精細管細胞 (未分化精原細胞、円形精子細胞、細長い精子細胞、成熟精子) に拡散して存在しますが、精原細胞および筋線維芽細胞では明確に観察されます。若年対照群では、内皮性一酸化窒素合成酵素 は細長い精子細胞および成熟精子細胞ではほとんど観察されませんでした。間質では、内皮性一酸化窒素合成酵素 は アロニアメラノカルパジュース投与群でより強く発現し、高齢対照群および 若年対照群ではより弱い発現を示しましたが、血管の内皮では 3 つの群すべてで観察されませんでした (図 6、表 5)。 |
| 若年対照群における MAS1 受容体の発現に関しては、精細管のすべての細胞、ライディッヒ細胞、および間質の血管内皮で高い発現強度が認められました。アロニアメラノカルパジュース投与群および 老年対照群では、MAS1 受容体は両群とも丸く細長い精子細胞および成熟精子細胞で可視化され、アロニアメラノカルパジュース投与群の方が反応強度が高かった。間質では、MAS1 は主にライディッヒ細胞で可視化され、アロニアメラノカルパジュース投与群および 老年対照群の血管内皮では検出されませんでした (図 6、表 5)。 |
| 図 7 は、アロニアメラノカルパジュース投与群の 神経性一酸化窒素合成酵素(nNOS)、内皮性一酸化窒素合成酵素(eNOS)、および MAS1 の免疫反応の強度値が 若年対照群と類似していることを視覚的に表しています。 |
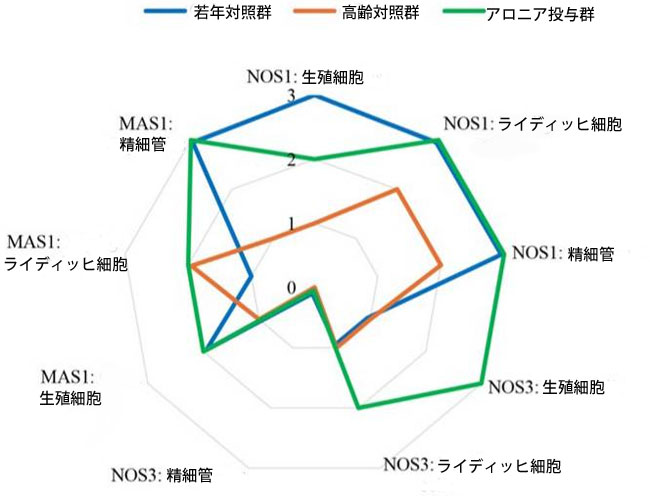 |
| 図7 ラット精巣における神経性一酸化窒素合成酵素(nNOS)、内皮性一酸化窒素合成酵素(eNOS)、MAS1の免疫発現強度の図。 |
| 4. 考察 |
| 4.1. 形態学的変化 |
| 本研究では、生理学的に老化した動物を生殖老化のモデルとして使用しました。この無病モデルでは、ブラックチョークベリージュースの投与がラットの体細胞および器官測定パラメータに有意な影響を与えないことが明らかになりました。肉眼レベルでは補給による目に見える変化はありませんでしたが、顕微鏡データでは、尿細管構造の維持、尿細管間腔の縮小、および豊富な血管に囲まれたライディッヒ細胞の存在が説得力を持って示されました。アロニアメラノカルパジュース投与群の精子形成上皮の厚さは、若年対照群および老年対照群で観察されたものと同様の値を示しました。ただし、3 つの実験群間の尿細管面積の変動は非常にわずかでした。高齢対照群と若年対照群で発見された精巣組織学的構造の加齢に伴う変化は、他の著者らが説明したものと同様です [5,46,47]。サプリメントを摂取した動物の保存された精細管構造の形態学的所見は、免疫組織化学的所見と相関していた。ライディッヒ細胞における神経栄養因子の強度が高いことは、その機能的活性が高く、それに応じたテストステロン産生レベルが高いことと対応している。テストステロンは精子形成の強力な刺激物である。サプリメントを摂取した動物群におけるライディッヒ細胞の機能的活性が高まっていることを示すもう 1 つの兆候は、細胞に隣接して見られる血管の多さである。これらの肉眼的解剖データは、ラットの精巣重量の変化は、他の著者らが述べているように、加齢とともに通常起こることを示した [5,46,48]。 |
| 4.2. チロシンタンパク質キナーゼ受容体-Cおよび神経栄養因子-3免疫反応 |
| ニューロトロフィンがライディッヒ細胞に誘導する機能活性については、すでに文献で十分に説明されている [49]。ニューロトロフィン(神経栄養因子)は、体細胞のセルトリ細胞とライディッヒ細胞、および精子形成上皮の両方に影響を及ぼす。その調節作用は胚発生中に始まり、生殖を調節する雄個体の生涯を通じて継続する [50]。いくつかの研究では、神経成長因子 (NGF) やニューロトロフィン 3 (NT3)などの特定の神経成長因子の効果が、成体ライディッヒ細胞の発達に重要である可能性があることが示唆されている [50]。ニューロトロフィン 3は、チロシンタンパク質キナーゼファミリーのメンバーである チロシンタンパク室キナーゼ(TRK)-C 受容体に結合し、抗アポトーシス効果を発揮する [50]。出生前、NT3 は精索の形成と生殖細胞の分化の調節、および雄の性別の決定に関与している。 ニューロトロフィン 3は胚発生中に精巣のセルトリ細胞から分泌される[51]。ニューロトロフィン 3プロモーターにはセルトリ細胞転写因子SOX9の結合部位が含まれており、SOX9はライディッヒ細胞の発達を制御するニューロトロフィン 3の発現を刺激する[52]。 |
| 結果は、高齢対照群では 若年対照群と比較して TRK-C および NT3 受容体免疫反応の強度が低下していることを示しており、これは精巣で起こっている加齢に伴う変化の表れです。サプリメントの影響下では、チロシンタンパク質キナーゼ-C および ニューロトロフィン 3受容体免疫反応の強度が上昇していることが分かりました。これは、ライディッヒ細胞の刺激と機能活動の増加の表れである可能性があります。これは、テストステロン分泌の増幅にもつながる可能性があります。ライディッヒ細胞の周囲に血管が多く存在することも、細胞の活動増加のもう 1 つの兆候であり、精巣の栄養状態の改善の兆候でもあります。 |
| 最近、加齢による酸化ストレスの条件下では、神経栄養因子が酸化的に修飾され、その有効性が低下することがわかっています [53]。一方、ポリフェノールは、脳由来神経栄養因子(BDNF)、神経成長因子 (NGF)、神経栄養因子3(NT3)、神経栄養因子4(NT4)などの神経栄養因子の合成を促進し、チロシンタンパク質キナーゼ-C受容体に直接結合する能力を高め、ホスファチジルイノシトール3キナーゼ(PI3K)/タンパク質キナーゼB(AKT)、ミトゲン活性化タンパク質キナーゼ(MAPK)、シグナル伝達および転写活性化因子3(STAT3)、活性化cAMP応答配列結合タンパク質(CREB)などの経路を介して転写、翻訳、増殖、成長、生存を調節できることが示されています [54]。食事性ポリフェノールが精巣の神経栄養因子に及ぼす影響については、文献にデータが不足しています。機能性食品がこれらの因子に及ぼす影響に関する報告は、主に脳の構造と機能に焦点を当てている[55,56,57,58,59,60,61,62,63]。 |
| 4.3. 神経性一酸化窒素合成酵素、内皮性一酸化窒素合成酵素、および Mas1 免疫反応 |
| 3 つの 一酸化窒素合成酵素(NOS)アイソフォームはすべて精巣に存在し、細胞分布のパターンはそれぞれ異なりますが、重複しています。神経性一酸化窒素合成酵素(nNOS)、誘導性一酸化窒素合成酵素(iNOS)、および 内皮性一酸化窒素合成酵素(eNOS) は、精巣上皮のセルトリ細胞と生殖細胞の両方に存在します [64,65,66,67]。また、ライディッヒ細胞 [68] のほか、筋様細胞、内皮細胞、筋線維芽細胞、および精子にも存在します [64,65,67]。一酸化窒素合成酵素は精巣のすべての種類の細胞に存在するため、一酸化窒素/一酸化窒素合成酵素は精子形成に必要であると考えられます。私たちの結果は、高齢対照群のライディッヒ細胞と精子形成上皮における神経性一酸化窒素合成酵素および 内皮性一酸化窒素合成酵素 に対する免疫反応の強度が、若年対照群と比較して加齢とともに低下し始めていることを示しました。 アロニアメラノカルパジュース投与群では、ライディッヒ細胞と精子形成上皮における神経性一酸化窒素合成酵素と内皮性一酸化窒素合成酵素 に対する免疫反応の強度が増加し、若い対照群の強度に近づきました。これは、おそらく加齢中に生じる酸化ストレスの増加に対する保護反応として、一酸化窒素合成プロセスが活性化されたことを示しています。最近まで、一酸化窒素合成酵素がどのように制御されるかは明らかではありませんでした。ホルモンとサイトカインは、精巣における一酸化窒素合成酵素を制御することが知られている 2 つの分子クラスです。 |
| 内皮性一酸化窒素合成酵素と誘導性一酸化窒素合成酵素の発現レベルは、正常状態と病的状態によって異なります。これら2つのアイソフォームの過剰発現は、精子の運動性や生存率の低下、生殖細胞のアポトーシスの活性化、文字通り精子形成の妨害など、生殖組織における破壊的なプロセスを引き起こす可能性があります。病的プロセスと生理的プロセスの両方において、一酸化窒素の逆説的な機能は、体の全体的な状態と酸化剤/抗酸化剤のバランスメカニズムに依存します[28]。 |
| ヒト生殖器官には、アンジオテンシンIIやアンジオテンシン(1-7)などのさまざまなレニン-アンジオテンシン系ファミリーメンバーが見つかっており、アンジオテンシンIIサブタイプ2受容体(AT1R)、アンジオテンシンIIサブタイプ2受容体(AT2R)、およびプロトオンコゲンMas受容体の発現も確認されています。すべての成分は、成熟、生殖調節の微調整、血管新生、および腫瘍細胞の増殖を含む生理学的および病理学的プロセスに対するレニン-アンジオテンシン系の局所的影響を媒介するために必要です[22,68,69]。 |
| アンジオテンシン変換酵素2(ACE2)は主要なアンジオテンシン-(1-7)形成酵素であり、アンジオテンシン IIからAng-(1-7)を生成することができる[70]か、または、より効率は低いが、アンジオテンシン Iをアンジオテンシン-(1-9)に加水分解することによってアンジオテンシン-(1-7)を生成することができ[71]、その後、アンジオテンシン変換酵素(ACE)および中性エンドペプチダーゼ加水分解によってアンジオテンシン-(1-7)が生成されます[72]。アンジオテンシン-(1-7)は、Gタンパク質共役型Mas受容体の内因性リガンドとして機能することが確立されています[73,74]。この細胞表面受容体は、脳、心臓、腎臓、内皮、および精巣で高度に発現しています[74]。アンジオテンシン変換酵素2発現パターンと同様に、精巣のMas mRNAはライディッヒ細胞とセルトリ細胞に見られ、ライディッヒ細胞での発現がはるかに高くなっています[73]。さらに、Masノックアウトマウスの最近の研究では、Masの欠失がライディッヒ細胞におけるテストステロン生合成に関与する酵素(ステロイド生成急性調節タンパク質および3β-ヒドロキシステロイド脱水素酵素1および6)の発現に影響を与えることが明らかになり、男性生殖器系におけるアンドロゲン代謝の調節におけるMasの可能性のある役割を示唆している[74]。 |
| 4.4. ライディッヒ細胞の抗酸化物質とステロイド生成機能 |
| Zhao らは最近、酸化ストレスと慢性炎症が、老化したライディッヒ細胞における生体内および生体外の両方でのテストステロン産生の低下に関与していることを実証しました。彼らの結果は、活性化 B 細胞の核因子 κ 軽鎖エンハンサー (NF-κB) と p38 マイトジェン活性化タンパク質キナーゼ (p38 MAPK) の 2 つのシグナル伝達経路の活性化がシクロオキシゲナーゼ 2 阻害剤 (COX2) の上方制御につながり、老化で一般的に見られる酸化ストレス反応と慢性炎症に機能的に関連するという証拠を提供することで、加齢に伴うテストステロン合成の低下の調節におけるシクロオキシゲナーゼ 2 阻害剤の重要性を強調しています [75]。精巣における活性酸素種の加齢に伴う蓄積は、精液の質の低下の主な原因の 1 つであることが示されています [7,11,76]。 |
| ライディッヒ細胞はステロイド生成と精子形成に必須である。ライディッヒ細胞はシトクロムP450、黄体形成ホルモン受容体(LH-R)を発現し、アンドロステロンを分泌する[77]。ステロイド生成のプロセスは、基礎条件下で活性酸素種を生成するため、活性酸素種損傷の影響を非常に受けやすい。さらに、活性酸素種作用は、ステロイド生成プロセスがシトクロムP450酵素によって調節される部位で起こる[78]。一方、ライディッヒ細胞、セルトリ細胞、精巣精子形成細胞および体細胞は、基礎および炎症状況において、インターロイキン-1(IL-1)、インターロイキン-6(IL-6)、腫瘍壊死因子(TNF)など、いくつかの免疫調節性および炎症性サイトカインを産生する[79]。これらの発現の増加は、炎症につながる活性酸素種、特にH2O2の産生を刺激し、ライディッヒ細胞を酸化ストレスにさらす[80]。ライディッヒ細胞は細胞内抗酸化防御システムを持っており、活性酸素と抗酸化物質のバランスを維持することで細胞の損傷を防ぎます[81]。しかし、広範囲の酸化損傷によりライディッヒ細胞の修復機構が損なわれると、細胞はプログラム細胞死を起こし、ライディッヒ細胞数が減少し、テストステロンの産生が不十分になります[82]。 |
| 活性酸素種と炎症性サイトカインは密接に関連しており、サイクルを維持しています。活性酸素種は熱ショックタンパク質を誘導し、これが炎症性サイトカインと細胞接着分子(CAM)の発現を刺激します[83]。これらの結果は、白血球や常在細胞(マクロファージ、内皮細胞、線維芽細胞など)などの活性酸素種産生白血球(WBC)の刺激につながります[84]。活性酸素種の過剰産生または内因性抗酸化酵素の過剰消費に起因する活性酸素種の蓄積は、主に細胞機能障害、DNA損傷、ミトコンドリア損傷、脂質過酸化、細胞アポトーシスなどの損傷特性に関連しています[85]。 |
| 私たちの研究は、これまであまり研究されてこなかった分野に光を当てています。そのため、本稿では、アロニアメラノカルパジュースに含まれる食物ポリフェノール、すなわちアントシアニン、ケルセチン、カテキン、クロロゲン酸などについてのみ議論します。表 1 に示すように、ジュースは特にフェノール化合物が豊富で、累積含有量は 11,000 mg/L を超えています。クロロゲン酸とネオクロロゲン酸に代表されるヒドロキシ桂皮酸が主な個々のフェノール化合物であり、アントシアニン(シアニジン-3-ガラクトシド、シアニジン-3-グルコシド、シアニジン-3-アラビノシド、シアニジン-3-キシロシド)がそれに続きます。植物フラボノイドは、がん予防、心血管疾患や神経変性疾患のリスク低減、老化に伴う症状の遅延など、数多くの健康上の利点に関連付けられています [40]。フラボノイドはコレステロールや他のステロイドに似た化学構造を持ち、ライディッヒ細胞におけるアンドロゲンの産生に影響を与える可能性があります。そのため、1960年代初頭以来、500を超える出版物で、さまざまなフラボノイドがテストステロン産生に及ぼす影響が報告されています。しかし、最近になってようやく、ステロイド合成に対するフラボノイドの影響の分子メカニズムが部分的に解明されました[40]。加齢は、成人ライディッヒ細胞におけるステロイド生成急性調節タンパク質(StAR)レベルの低下と関連しており、ミトコンドリアのコレステロール輸入が不完全になり、テストステロン産生が低下します。加齢に伴うテストステロン産生の低下は、フラボノイドまたはその誘導体の補給によりStARおよび/またはシトクロムP450ファミリー11サブファミリーAメンバー1(Cyp11a1)遺伝子発現を増加させることで遅らせることができます[86,87]。 |
| Huらの研究結果によると、研究対象となった4種類のアントシアニンはすべて、活性酸素種生成を阻害し、ミトコンドリア膜の潜在的な損傷を軽減し、テストステロン産生の増加に寄与することが証明されている。その中でも、ジグリコシドを含むCy-3,5-ジグルコシドは、抗酸化能の点で最も優れており、細胞機能障害を改善し、StAR発現を増加させる[88]。 |
| Martinらは、フラボノイドとイソフラボノイドの使用による精巣ステロイド生成の促進について詳細に議論した[34]。Kingらは、アロニアメラノカルパジュースに含まれる有効成分であるケルセチン、カテキン、アントシアニンなどのポリフェノールがライディッヒ細胞におけるステロイド生成に良い影響を与えることを発見した。CAMP応答性エレメント結合タンパク質1(Creb1)は、ライディッヒ細胞におけるStARを含むステロイド生成遺伝子の発現の重要な活性化因子である[89]。Cormierらは、ケルセチンがCAMP応答性エレメント結合タンパク質1の転写活性とシトクロムP450ファミリー11サブファミリーAメンバー1および遺伝子フェレドキシン1(Fdx1)のプロモーター活性を増強することにより、ステロイド生成に良い影響を与えることを報告した[90]。他の著者らは、ケルセチンがStAR mRNAレベル、StARプロモーター活性、およびMA-10ライディッヒ細胞によるステロイドホルモン産生を増加させることを報告している[91]。Wangによれば、ライディッヒ細胞におけるStAR発現とステロイド生成も、ケルセチンに反応して性決定領域Yボックス2(Sox2)シグナル伝達を阻害することによって促進される[92]。 |
| 老化の特徴の 1 つは、老化関連分泌表現型 (SASP) と呼ばれるさまざまな生理活性因子を分泌する老化細胞の増加であり、ケルセチンは老化細胞を標的とする第一世代の老化防止剤の 1 つです [93]。さらに、Yu らは、雄ラットにカテキン、エピカテキン、エピガロカテキンガレートを投与してから 8 時間後に血漿テストステロン値が上昇したと報告しています [94]。化学組成データから明らかなように、ブラックチョークベリージュースは特にアントシアニンが豊富です。これらのフラボノイドは、テストステロン産生を調節する可能性という点では特に研究されていませんが、ライディッヒ細胞でシクロオキシゲナーゼ 2 阻害剤活性を阻害し、MAPK 経路の活性を調節できることが知られているため、ステロイド生成を促進する可能性があります。どちらのメカニズムも、ライディッヒ細胞での StAR 発現に影響します [95,96]。 |
| 5. 結論 |
| 私たちの研究データは、ポリフェノールが豊富なブラックチョークベリージュースの投与がラットの精巣の老化プロセスを遅らせることができることを初めて実証しました。この介入により、精巣環境の抗酸化能力が強化されると同時に、ライディッヒ細胞の機能活性が促進されることが観察されています。湾曲した精細管の健全性が維持され、血管数が増加し、精巣環境における神経栄養因子と抗酸化分子の存在が高まったことは、アロニアメラノカルパジュースの抗老化効果の具体的な証拠となります。アロニアメラノカルパは、その強力な抗酸化特性により、抗老化剤としての展開の有望な候補として期待されています。機能性食品の可能性を活用することで、この果物の用途は精巣機能の強化を超えて、より広範な健康上の利点にまで及びます。この総合的なアプローチは、精巣の健康を増進するだけでなく、男性の健康と生活の質の全体的な向上にも貢献します。この研究には、精子パラメータとアポトーシスマーカーを調査しなかったことに関連して、いくつかの限界があることに留意する必要があります。しかし、これは、より具体的な分析によるさらなる詳細な研究の基礎となり得る信頼できる情報を提供する初期研究です。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Curr Issues Mol Biol. 2024 May; 46(5): 4452–4470.に掲載されたBlack Chokeberry (Aronia melanocarpa) Juice Supplementation Improves Oxidative Stress and Aging Markers in Testis of Aged Rats..を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |